Устройство бактериородопсина намного проще
системы хлорофилльного фотосинтеза. Белковая часть бактериородопсина представляет собой одну полипептидную цепь средней длины, которая не содержит других коферментов и простетических групп, кроме ретинштя. Бактериородопсин чрезвычайно устойчив: без потери активности его можно кипятить в автоклаве при + 130°С, изменять содержание NaCl в омывающем мембрану растворе от нуля до насыщения, в широких пределах менять рН этого раствора. Более того, можно удалить выступающие из мембраны концевые участки полипептид-ной цепи и даже расщепить эту цепь в одном месте по середине без ущерба для активности насоса. В то же время эффективность бактериородопсина как преобразователя энергии сравнительно низка: всего 20% энергии светового кванта превращается в ΔμΗ+ . При этом на один поглощенный квант через мембрану переносится один ион Н+ .
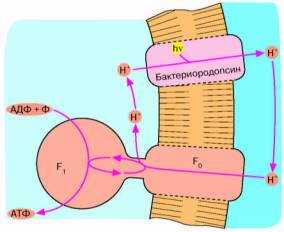
Рис. 4. Бактериородопсиновый фотосинтез со-
лелюбивых архебактерий. Ионы Н* откачиваются из клетки бактериородопсином - белком, содержащим ретиналь в качестве хромофора, то есть группировки, поглощающей видимый свет. Ионы Н* возвращаются в клетку, двигаясь "под гору" через Н*-АТФазный комплекс F0 F,. При этом оказывается, что 1-Г-АТФаза катализирует обратную реакцию, то есть синтез АТФ, а не его гидролиз
Хлорофилльный фотосинтез
Хлорофилльный фотосинтез отличается от бак-териородопсинового большей эффективностью использования светового кванта. Он устроен таким образом, что либо на каждый квант переносится через мембрану не один, а два иона Н+ , либо помимо транспорта Н+ происходит запасание энергии в форме углеводов, синтезируемых из СО2 и Н2 О. Вот почему бактериородопсиновый фотосинтез был оттеснен эволюцией с авансцены. Он сохранился только у бактерий, живущих в экстремальных условиях, где более сложный и менее устойчивый Хлорофилльный фотосинтез, по-видимому, просто не может существовать.
Хлорофилльный фотосинтез катачизируется ферментной системой, включающей несколько белков. Квант света поглощается хлорофиллом, молекула которого, перейдя в возбужденное состояние, передает один из своих электронов в фотосинтетическую цепь переноса электронов. Эта цепь представляет собой последовательность окислительно-восстановительных ферментов и коферментов, находящихся во внутренней мембране бактерий или хлоропластов растений, где локализованы также белки, связанные с хлорофиллом. Компоненты цепи содержат, как правило, ионы металлов с переменной валентностью (железо, медь, реже марганец или никель). При этом железо может входить в состав тема (в таком случае белки называются цито-хромами). Большую роль играют также негемовые железопротеиды, где ион железа связан с белком через серу цистеина или реже азот гистидина. Помимо ионов металлов роль переносчиков электронов играют производные хинонов, такие, как убихинон, нластохинон и витамины группы К.
Перенос по цепи электрона, отнятого от возбужденного хлорофилла, завершается по-разному в зависимости от типа фотосинтеза. У зеленых бактерий, использующих комплекс хлорофилла и белка, называемый фотосистемой 1 (рис. 5, а), продуктом оказывается НАДН, то есть восстановленная форма НАД+ . Восстанавливаясь, то есть присоединяя два электрона, НДЦ+ связывает также один Н+ . В дальнейшем образованный таким образом НАДН окисляется, передавая свой водород на различные субстраты биосинтезов.
Что касается хлорофилла, окисленного цепью, то у зеленых серных бактерий он получит недостающий электрон от сероводорода (H2 S). В результате образуются также элементарная сера и ион Н+ . Белок, окисляющий H2 S, расположен на внешней поверхности бактериальной мембраны, а белок, восстанавливающий НАД+ , — на внутренней ее поверхности. Вот почему оказывается, что запускаемый светом перенос электронов от H,S к НАД+ образует ионы Н+ снаружи и потребляет их внутри бактерии. При этом внутренний объем клетки заряжается отрицательно относительно внешнего. Тем самым создается ДДН +, которая потребляется Н+ -АТФ-синтазой (комплексом факторов F0 и FJ, образующей АТФ при переносе ионов Н "под гору", то есть снаружи внутрь.
Другой тип бактериального фотосинтеза обнаружен у пурпурных бактерий (рис, 5, б). Здесь действует набор ферментов, отличающихся от ферментного комплекса зеленых бактерий. Это несущая хлорофилл фотосистема 2 и комплекс III. Как и в предыдущем случае, процесс начинается с поглощения кванта хлорофиллом. Первоначально перенос электронов происходит по фотосистеме 2.
Затем вступает комплекс III, способный транспортировать электроны сопряженно с откачкой ионов Н+ из бактерии. Процесс завершается возвращением электрона с комплекса III на хлорофилл. Что касается ионов Н+ , то они возвращаются в клетку через Н+ -АТФ-синтазу, образуя АТФ.
Отличительная черта фотосинтеза у пурпурных бактерий состоит в том, что система не нуждается во внешнем доноре электронов. Откачка ионов Н* осуществляется путем циклического переноса электронов, поддерживаемого энергией света. Данное обстоятельство можно отнести, по-видимому, на счет эволюционного усовершенствования фотосинтеза пурпурными бактериями, которые по многим признакам являются эволюционно более продвинутой группой, чем зеленые серные бактерии.
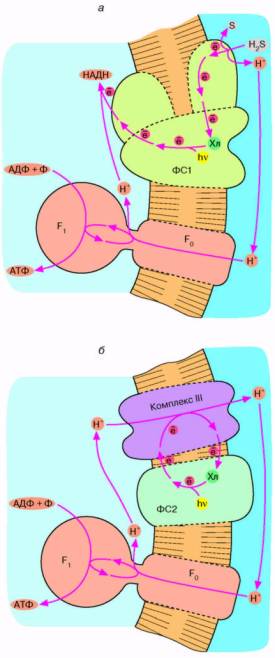
Рис. 5. Хлорофиллычый фотосинтез зеленых серных (а) и пурпурных (б) бактерий: а - хлорофилл, связанный с особым белковым комплексом - фотосистемой 1 (ФС1), возбуждается квантом света и отдает электрон по цепи электронных переносчиков на НАД*. Восстанавливаясь, НАД* связывает внутриклеточный ион Н*. Потеря электрона на хлорофилле компенсируется окислением сероводорода до серы и иона Н* снаружи бактериальной клетки. Движение Н* внутрь клетки через комплекс F0 F, дает АТФ; б - хлорофилл, связанный с белком фотосистемы 2 (ФС2), поглощает квант света и запускает циклический перенос электронов. В этом процессе участвуют переносчики электронов ФС2 и дополнительного белкового комплекса III. Перенос электронов комплексом III сопряжен с откачкой ионов Н* из клетки. Откачанные ионы Н* возвращаются через комплекс F0 F, с образованием АТФ.
Следующим шагом в эволюции фотосинтеза стали, по-видимому, цианобактерии. Цепь переноса электронов в этом случае представляет собой комбинацию: а) фотосистемы 1 зеленых бактерий, б) фотосистемы 2 и комплекса III пурпурных бактерий и в) дополнительного комплекса, расщепляющего воду на О2 и Н+ (рис. 6). Фактически донором электронов вместо сероводорода (встречающегося в достаточных количествах лишь в некоторых природных нишах) служит вездесущая вода, запасы которой практически неограничены. В результате конечный акцептор электоров — НАДФ+ восстанавливается, а вода окисляется. Образующийся НАДФН окисляется затем сложной системой восстановления углекислого газа до глюкозы. Таким образом, фотосинтез цианобактерии параллельно с образованием АТФ дает углевод — одно из главных резервных веществ современных живых клеток. Нет сомнений, что цианобактерия является эволюционным предшественником хлоропластов — органелл зеленых растений, энергетика которых устроена в основном по той же схеме, что показана на рис. 6.
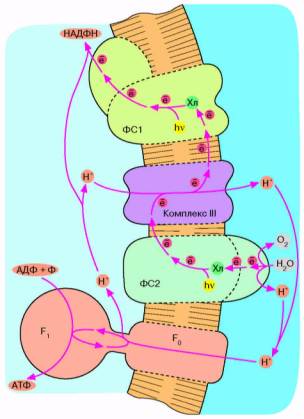
Рис. 6. Хлорофилльный фотосинтез цианобактерии. Квант света, поглощенный хлорофиллом фотосистемы 1, возбуждает перенос электронов по цепи, что завершается восстановлением НАДФ* до НАДФН. Окисленный хлорофилл фотосистемы 1 восстанавливается комплексом III, который, в свою очередь, получает электрон от фотосистемы 2. Допирование электрона фотосистемой 2 требует еще одного кванта света (поглощаемого хлорофиллом этой фотосистемы). Потеря электрона на хлорофилле фотосистемы 2 компенсируется за счет окисления молекулы воды до О2 и Н*. Ферменты, катализирующие всю цепь реакций переноса электрона от Н2 О до НАДФ*, расположены в мембране таким образом, что ионы Н* откачиваются из бактериальной клетки, чтобы затем войти внутрь через F0 F, и сделать АТФ. В хлоро-ппастах зеленых растений происходят те же события, но ориентация всех ферментов противоположна той, которая имеет место у цианобактерии и показана на рис. 6. Соответственно у хлоропластов фотосинтетическая цепь накачивает ионы ИГ внутрь, а комплекс F0 F, переносит их наружу.
ДЫХАТЕЛЬНЫЙ МЕХАНИЗМ ЭНЕРГООБЕСПЕЧЕНИЯ.
Побочным продуктом фотосинтеза у цианобактерии и растений служит молекулярный кислород. Нарастание его концентрации в атмосфере привело к появлению ферментов, убирающих этот сильный окислитель, опасный для жизнедеятельности. Вероятно, первой функцией ферментов, восстанавливающих О, до Н2 О, было снижение внутриклеточной концентрации кислорода. Однако в дальнейшем аэробная клетка научилась извлекать пользу из этого процесса, создав дыхательную цепь электронного транспорта, сопряженного с откачкой ионов Н+ .
Дыхательная цепь некоторых современных бактерий включает уже знакомый нам комплекс III, служащий связующим звеном между двумя другими белковыми комплексами. Однако это уже не фотосистемы 1 и 2, а ферменты, выполняющие функции, противоположные таковым фотосистем 1 и 2. Ферменты, о которых идет речь, были названы комплекс I и комплекс ГУ.
Комплекс I не восстанавливает никотинамид-ный нуклеотид, а окисляет его. Комплекс IV не окисляет воду до О2 , а восстанавливает О, до воды. В итоге мы имеем сложную цепь реакций, начинающихся с окисления НАДН и кончающихся восстановлением О,. Все три комплекса дыхательной цепи способны откачивать из клетки ионы Н+ сопряженно с переносом электронов (рис, 7).
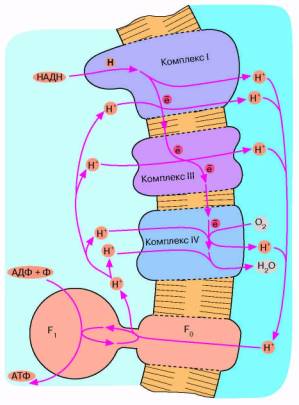
Рис. 7. Механизм дыхательного фосфорилирова-ния в аэробных бактериях и митохондриях. Ферментные комплексы I, III и IV катализируют перенос электронов от НАДН к О2 с образованием воды. Перенос электронов сопряжен с откачкой ионов Н*. Возвращение ионов Н* через F0 F, приводит к синтезу АТФ
Подобно тому как хлоропласты произошли от цианобактерии, митохондрии животных, растений и грибов ведут свое происхождение от аэробных бактерий. Поэтому неудивительно, что митохонд-риальная дыхательная цепь описывается той же схемой, что изображена на рис. 7.
ЗАКЛЮЧЕНИЕ
Знания, накопленные при изучении современных организмов различной степени сложности, позволяют сформулировать непротиворечивую концепцию эволюции биоэнергетических систем. Эта концепция дает ключ к пониманию не только путей становления механизмов превращения энергии в клетке, но и позволяет объяснить, почему химия и физика живой клетки базируются на двух основных классах веществ: а) нуклеиновых кислотах и нуклеотидах и б) белках. Вкратце система взглядов, о которой идет речь, может быть суммирована следующей схемой эволюции жизни.
1. Образование азотистых оснований (пуринов и пиримидинов), а затем и нуклеотидов из Н2 О, NH3 , СО2 , HCN и некоторых других простейших соединений под действием ультрафиолетового излучения Солнца.
2. Использование остатков аденина, а затем также других пуринов и пиримидинов в нуклеотидах для поглощения ультрафиолетового света. Приэтом энергия ультрафиолетовых квантов оказывается движущей силой для синтеза АТФ из АДФ и фосфата или для осуществления других энергоемких реакций коферментами-нуклеотидами (адени-новый фотосинтез).
3. Образование резервных веществ за счет энергии АТФ (гликогенез) с тем, чтобы их последующее расщепление могло поддержать ресинтез АТФ при отсутствии ультрафиолетового света (гликолиз).
4. Изменение спектральных свойств атмосферы, ставшей плохо проницаемой для ультрафиолета, и замена "аденинового" фотосинтеза на фотосинтез, использующий видимый свет. В качестве пигментов используется ретиналь, а затем хлорофилл. В результате АТФ, бывший до того как преобразователем световой энергии, так и "конвертируемой энергетической валютой", утрачивает первую из этих двух функций, сохранив только вторую.
5. Увеличение концентрации О2 в атмосфере в результате деятельности фото синтезирующих организмов и появление ферментов, поглощающих кислород с целью его детоксикации.
6. Создание современных дыхательных систем, преобразующих в АТФ энергию окисления субстратов кислородом.
ЛИТЕРАТУРА.
1. Уайт А., Хендлер Ф., Смит Р. и др. Основы биохимии. М.:Мир, 1981.
2. Саган К.В. // Происхождение предбиологических систем/Под ред. А.И. Опарина. М.: Мир, 1966. С. 211.
3. Понамнерума С.В. // Там же. С. 224.
4. Скулачев В.П. Аккумуляция энергии в клетке. М.: Наука, 1969.
5. Скулачев В.П. Мембранные преобразователи энергии. М.: Высш. шк., 1989.
6. Скулачев В.П. Энергетика биологических мембран. М.: Наука, 1989.
7. Скулачев В.П. Кислород в живой клетке: добро и зло // Соросовский Образовательный Журнал. 1996. № 3. С. 4-16.
8. Скулачев В.П. Законы биоэнергетики //Там же. 1997. № 1. С. 9-14.
* * *
Владимир Петрович Скулачев, действительный член Российской Академии наук, президент Российского биохимического общества, директор Института физико-химической биологии им. А.Н. Белозерского МГУ. Автор фундаментальных работ по энергетике клетки, 300 статей в российских и международных журналах, шести монографий и одного учебника. Лауреат Государственной премии СССР, премии им. А.Н. Баха Президиума АН. Основатель отечественной школы энергетики биологических мембран. В течение многих лет читает курс биоэнергетики для студентов биологического факультета МГУ.
29-04-2015, 01:57
