Содержание:
Эволюция биологических механизмов запасания энергии
1. "Ультрафиолетовый фотосинтез" с аденином в качестве антенны, улавливающей свет
2. Аденинсодержащие коферменты
3. Рнк, Днк, белки и мембраны
Как избежать разрушительных эффектов ультрафиолетового света
1. Запасные энергетические ресурсы и гликолиз
2. Протонные каналы и Н+ -атфаза предотвращают закисление клетки при гликолизе
Возникновение фотосинтеза, использующего видимый свет
1. Бактериородопсиновый фотосинтез
2. Хлорофилльный фотосинтез
3. Дыхательный механизм энергообеспечения
ФОТОСИНТЕЗ И БИОСФЕРА
1. Запасание энергии
2. Ассимиляция двуокиси углерода
3. Выделение молекулярного кислорода
4. Молекулярные основы преобразования и запасания энергии света при фотосинтезе
ЗАКЛЮЧЕНИЕ
СПИСОК ЛИТЕРАТУРЫ
ЭВОЛЮЦИЯ БИОЛОГИЧЕСКИХ МЕХАНИЗМОВ ЗАПАСАНИЯ ЭНЕРГИИ
Использование внешних энергетических ресурсов для совершения полезной работы - универсальна функция всех живых систем. Столь же непреложным фактом является то обстоятельство, что химия современной жизни базируется прежде всего на процессах, осуществляемых белками и нуклеиновыми кислотами. Что касается белков, то их выдающаяся роль в жизненных явлениях объясняется, скорее всего, необычайным разнообразием свойств молекул этого класса, обусловленным наличием в их структуре самых различных химических группировок, которые удается уникальным образом расположить в пространстве. Вот почему среди биохимиков бытует афоризм: "Белок может все". Однако в явном противоречии с этой максимой находится факт, состоящий в том, что такие важнейшие функции клетки, как хранение и реализация генетической информации, обеспечиваются прежде всего нуклеиновыми кислотами, а составляющие их мономеры-нуклеотиды используются клеткой в качестве коферментов и "конвертируемой энергетической валюты". В принципе можно представить себе, например, особый белок, кодирующий структуру другихбелков (как думал когда-то Н.К. Кольцов) или конферменты, сделанные из аминокислот либо других веществ ненуклеотидной природы. И если этого в действительности не происходит, то нужно искать какие-то достаточно веские основания. Ниже изложена концепция, предполагающая, что решение загадки лежит в происхождении жизни.
Современные биохимические механизмы, без сомнения, несут на себе отпечаток эволюционного прошлого, так сказать, "родимые пятна" своей истории. Не исключено, что выбор пал на нуклеиновые кислоты по причине, сегодня уже не актуальной, но сыгравшей решающую роль на заре становления живых систем.
"УЛЬТРАФИОЛЕТОВЫЙ ФОТОСИНТЕЗ" С АДЕНИНОМ В КАЧЕСТВЕ АНТЕННЫ, УЛАВЛИВАЮЩЕЙ СВЕТ
Синтез АТФ из АДФ под действием ультрафиолетового света. Путь от смеси органических и неорганических молекул к первой живой клетке был, по-видимому, столь долог, что требовался некий постоянный источник энергии, доступный в течение всего периода возникновения жизни. Среди возможных кандидатов на роль такого источника, пожалуй, предпочтительнее всего ультрафиолетовый свет. Он поглощается любыми химическими веществами, резко повышая их реакционную способность благодаря большому запасу энергии ультрафиолетового кванта. Есть основания считать, что на заре биологической эволюции ультрафиолетовые кванты свободно достигали поверхности Земли, лишенной в те времена современной кислородсодержащей атмосферы с ее поглощающим ультрафиолетовый свет озоновым слоем.
Моделируя атмосферу древнейшей Земли. К. Саган пришел к выводу о существовании в ней "окна" в области 240—290 нм, прозрачного для ультрафиолетового света, поскольку основные простые компоненты этой атмосферы (Н2 О, СН4 , NH3 , CO2 , CO и HCN) поглощают свет короче 240 нм, а формальдегид, также входивший, как полагают, в ее состав, имеет максимум поглощения длиннее 290 нм. Именно в этом "окне" располагаются спектральные максимумы пуринов и пиримидинов.
Еще в 60-е годы С. Понамперума и сотрудники экспериментально показали, что облучение ультрафиолетовым светом синильной кислоты ведет к химическому синтезу аденина и гуанина. Обнаружено также, что облучение смеси метана, аммиака, водорода и воды вызывает образование как пуринов, так и пиримидинов, причем с наибольшим выходом для аденина. Ультрафиолетовый свет можно использовать также для синтеза аденозина из аденина и рибозы и далее аденозинмоно- и дифосфатов из аденозина и этилметафосфата. Но, пожалуй, наиболее важный опыт был поставлен теми же авторами с АДФ. Оказалось, что облучение смеси АДФ и этилметафосфата ультрафиолетовым светом дает АТФ с достаточно хорошим выходом, причем этот процесс демонстрируется в строго стерильных условиях и в отсутствие каких-либо белков.
К. Саган и С. Понамперума приводят следующие доводы в пользу заключения о том, что в качестве антенны для ультрафиолетового света аденин имеет преимущества по сравнению с другими пуринами и пиримидинами: 1) наибольшее поглощение света в спектральном "окне", о котором шла речь выше; 2) наибольшая стабильность к разрушительному действию ультрафиолетового света и 3) большее время жизни возбужденного состояния, возникающего в ответ на поглощение ультрафиолетового кванта.
Расчеты Л.А. Блюменфельда и М.И. Темкина привлекли наше внимание к тому факту, что величины изменения свободной энергии при нарушении ароматической структуры аденина близки к энергии реакции синтеза АТФ из АДФ и неорганического фосфата.
Приняв во внимание все названные выше обстоятельства, мы предположили следующий механизм фосфорилирования за счет ультрафиолетового света в первичных живых клетках:
1) адениновая часть АДФ поглощает ультрафиолетовый квант, что переводит ее в возбужденное состояние с нарушенной системой двойных связей. При этом аминогруппа аденина, соответствующая в обычном состоянии ароматической, приобретает свойства алифатической, что облегчает ее электро-фильную атаку атомом фосфора неорганического фосфата;
2) возбужденный аденин АДФ фосфорилируется, давая изомер АТФ, третий фосфорил которого находится при аминогруппе аденина;
3) фосфорил переносится с аденина на конечный (второй) фосфат АДФ. Такой перенос должен облегчаться тем обстоятельством, что расстояние между аминогруппой аденина и вторым фосфатом в АДФ в точности равно размеру еще одного (третьего) фосфатного остатка. Перенос фосфорила с аде-ниновой "головы" нуклеотида на фосфатный "хвост" должен сопровождаться его стабилизацией, поскольку весьма лабильный фосфоамид заменяется на менее лабильный фосфоангидрид (рис. 1).
Стадии 2 и 3 гипотетичны и призваны объяснить механизм синтеза АТФ под действием ультрафиолетового света в опытах С. Понамперумы и сотрудников [3].
АДЕНИНСОДЕРЖАЩИЕ КОФЕРМЕНТЫ
Аденин и реже другие пурины или пиримидины входят в состав ключевых коферментов и простетических групп ферментов, таких, как никотинамидадениндинуклеотид (НАД+ ), никотинамидадениндинуклеотидфосфат (НАДФ+ ), флавинадениндинуклеотид (ФАД), кофермент А (КоА), тиаминопирофосфат (производное витамина В,), витамин В12 . Все эти соединения, как правило, построены по одному и тому же принципу. Они содержат: 1) ту или иную функциональную группу, непосредственно участвующую в катализе, 2) пурин или реже пиримидин и 3) гибкую связку, позволяющую сблизить две другие части молекулы. Особенно наглядно устройство динуклеотидов: в них плоские остатки никотинамида (в НАД+ и НАДФ+ ) или изоаллоксазина (в ФАД) лежат на также плоском остатке аденина. Продемонстрирован перенос энергии от остатка аденина к остатку никотинамида или изоаллоксазина в ответ на поглощение аденином ультрафиолетового кванта. Поэтому можно предположить, что аденин, возбуждаясь ультрафиолетовым светом, передавал энергию на функциональную группу кофермента, который использовал эту энергию для проведения энергоемких химических реакций (например, восстановления простых веществ среды до более сложных соединений первичной клетки).
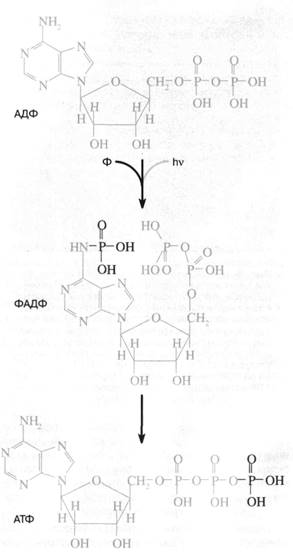
Рис. 1. Схема "аденинового" фотосинтеза -предполагаемого первичного механизма запасания энергии в живой клетке. Квант ультрафиолетового света поглощается адениновой частью аденозиндифосфата (АДФ), переводя ее в возбужденное состояние. Возбуждение облегчает присоединение неорганического фосфата (Ф) к аминогруппе аденина. В результате образуется ФАДФ, изомер аденозинтрифосфата (АТФ), где третий фосфат присоединен не к пирофосфатно-му "хвосту", а к адениновой "голове" АДФ. Затем происходит перенос фосфата от "головы" к "хвосту" с образованием обычного АТФ
РНК, ДНК, БЕЛКИ И МЕМБРАНЫ
В дальнейшем не слишком специфичный и нерегулируемый катализ, осуществляемый низкомолекулярными коферментами, был дополнен (а затем и вытеснен) процессами с участием высокомолекулярных катализаторов-ферментов, отличающихся огромной избирательностью в отношении субстратов и возможностью регулировать катализ. По-видимому, первыми ферментами были рибонуклеиновые кислоты (РНК) - полимеры, составленные из мономеров-нуклеотидов. Можно полагать, что адениновый фотосинтез катализировался комплексами РНК с магниевыми солями АДФ и фосфата. При этом РНК могла бы выполнять также роль антенны, собирающей ультрафиолетовый свет и передающей возбуждение на АДФ.
Надо сказать, что еще и сегодня в некоторых (весьма немногочисленных) случаях биохимические реакции могут катализироваться в искусственных условиях рибонуклеиновыми кислотами (так называемыми рибозимами). Однако несомненно, что каталитические функции современных организмов осуществляются белками, обладающими большим, чем РНК, разнообразием химических группировок и их сочетаний.
Синтез белков, включая кодирование их структуры, первоначально осуществлялся рибонуклеиновыми кислотами. Затем функция кодирования была передана дезоксирибонуклеиновым кислотам (ДНК), а сам катализ стал обслуживаться комплексами РНК и специальных белков (рибосомами и факторами трансляции), информационными и транспортными РНК и соответствующими ферментами.
Другим важнейшим изобретением биологической эволюции стали жиры и жироподобные вещества, прежде всего фосфолипиды. Замечательной особенностью фосфолипидов является их способность самопроизвольно, без какой-либо помощи извне, образовывать тончайшую пленку, непроницаемую для гидрофильных веществ, таких, как нуклеотиды-коферменты, РНК, ДНК, белки и углеводы. Эта пленка (мембрана) представляет собой бислой, образованный двумя рядами молекул фосфолипидов, соприкасающихся гидрофобными (углеводородными) "хвостами". При этом гидрофильные "головы" (фосфатные остатки) фосфолипидов оказываются на двух противоположных поверхностях мембраны.
С образованием мембран стало возможно говорить о первичной живой клетке, содержимое которой было отделено от внешней среды достаточно надежным барьером. Появление клетки как обособленного мельчайшего пузырька могло бы сыграть роль в защите от неблагоприятных эффектов ультрафиолетового облучения.
Как избежать разрушительных эффектов ультрафиолетового света
Запасные энергетические ресурсы и гликолиз
Ультрафиолетовый свет - обоюдоострое оружие. Он хорош тем, что способен развязать разнообразные химические реакции, среди которых могут быть полезные, как, например, фосфорилирование адениновой аминогруппы АДФ. Но в то же время (и по той же причине) ультрафиолетовый свет опасен: он может разрушить уже синтезированные молекулы живой клетки. Одним из способов уменьшить ультрафиолетовую опасность могли стать запасные вещества - энергетические ресурсы, образуемые на свету, чтобы затем использоваться в темноте. Ультрафиолетовый свет, достигающий поверхности океана, не может проникать на сколько-нибудь значительную глубину из-за мутности, наличия растворенных веществ, поглощающих ультрафиолетовые кванты и, быть может, флуктуации плотности морской воды. Фактически только очень тонкий поверхностный слой подвергается бомбардировке этими квантами. Данное обстоятельство позволяет предположить следующий механизм энергообеспечения первичных живых клеток. Под действием движения слоев жидкости в океане клетки постоянно циркулировали между тонкой верхней пленкой воды, доступной для ультрафиолетового света, и более глубокими слоями, которых он не достигал. При этом вблизи поверхности происходил синтез АТФ, использовавшегося для образования резервных соединений, которые затем расщеплялись на глубине, поддерживая ресинтез АТФ. В результате короткие экспозиции на ультрафиолетовом свету чередовались с гораздо более длительными периодами, где ультрафиолетовой опасности уже не было (рис. 2). Кроме того, резервные вещества помогали клеткам пережить ночь.
Хорошими кандидатами на роль энергетического резерва первичных клеток могли быть неорганические пиро- и полифосфаты. Они и сегодня играют эту роль у некоторых видов живых существ. Например, в клетках грибов полифосфаты образуются из АТФ в условиях избытка энергетических ресурсов и расщепляются, давая АТФ, при дефиците источников энергии. Однако в подавляющем большинстве дошедших до нас организмов функцию легко мобилизуемого энергетического резерва выполняют не полифосфаты, а углеводы. Их синтез за счет энергии АТФ (гликогенез) представляет собой длинную последовательность реакций, намного более сложную, чем синтез полифосфатов из АТФ.
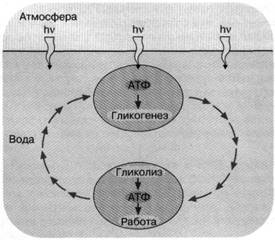
Рис. 2. Энергетика первичной живой клетки, основанная на "адениновом" фотосинтезе. Предполагается, что ультрафиолетовые кванты, достигая поверхности первичного океана, использовались клеткой для синтеза АТФ, который запускал синтез углеводородов (гликогенез). Клетка, увлекаемая потоком океанской воды с поверхности на некоторую глубину, оказывалась вне досягаемости ультрафиолетового облучения. Здесь происходило расщепление накопленных углеводов и синтез АТФ, использовавшегося для совершения клеткой различных типов полезной работы
Преимущество углеводов перед полифосфатами состоит в том, что в них запасены не только энергия, но и "строительный материал". Расщепление углеводов (гликолиз) дает помимо АТФ карбоновые кислоты, такие, как пировиноградная кислота, которая может использоваться клеткой при биосинтезе самых разнообразных соединений.
Описаны два основных типа гликолиза. В одном случае (спиртовое брожение) конечными продуктами расщепления углеводов оказываются этиловый спирт и углекислый газ — вещества, легко проникающие через мембрану клетки. Это обстоятельство имеет как преимущества (нет проблемы переполнения клетки конечными продуктами гликолиза), так и недостатки (трудно вернуться назад, к углеводу, если конечные продукты уже вышли из клетки и разбавились в океане внешней среды).
Указанный недостаток отсутствует во втором, сегодня гораздо более распространенном типе гликолиза, когда конечным продуктом оказывается молочная или какая-либо другая карбоновая кислота. Молочная кислота не проникает через мембрану, не покидает пределы клетки и потому может быть использована клеткой для ресинтеза углеводов, когда возникает такая возможность. Неудачно лишь то, что молекулы молочной кислоты, образуясь, диссоциируют с образованием ионов лактата и водорода. Последние также не могут пройти через мембрану, остаются в клетке и закисляют ее содержимое. Закисление, если его не предотвратить,
должно привести к гибели клетки из-за кислотной денатурации белков. Решение этой проблемы описано в следующем разделе.
ПРОТОННЫЕ КАНАЛЫ И Н+-АТФАЗА ПРЕДОТВРАЩАЮТ ЗАКИСЛЕНИЕ КЛЕТКИ ПРИ ГЛИКОЛИЗЕ
У современных клеток проблема проникновения через клеточную мембрану веществ, которые сами по себе не могут сквозь нее пройти, решается с помощью встроенных в мембрану белков-переносчиков. В частности, известны белки — переносчики ионов Н+ . Так называемый фактор F0 — белок, входящий в состав Н+ - АТФ - синтазы, действует как переносчик Н+ или протонный канал.
Можно предположить, что у первичных гликолизирующих клеток фактор F0 функционировал при отсутствии фактора F1 второго компонента Н+ - АТФ - синтазы, разрешая ионам Н+ , образующимся при гликолизе, покинуть пределы клетки. Тем самым предотвращалось закисление внутриклеточной среды, которая оказывалась в равновесии по ионам Н+ с внеклеточной средой. Единственным ограничением гликолиза в такой ситуации должно было стать закисление внеклеточной среды, что автоматически вело к закислению содержимого клетки. Снять данное ограничение можно было достроив белок - переносчик ионов Н+ (фактор F0 ) другим белком, называемым фактором F,. способным использовать энергию АТФ для активной откачки из клетки ионов Н+ через фактор F0 . Известно, что Н+ - АТФ - синтаза (комплекс факторов F0 и fj), действуя в обратном направлении, способна катализировать вместо синтеза АТФ пиролиз АТФ, сопряженный с откачкой ионов Н+ . Этот процесс носит название Н+ - АТФазной реакции. Можно полагать, что с образованием Н+ - АТФазы завершилось формирование первичной клетки, использовавшей ультрафиолетовый свет в качестве источника энергии для жизнедеятельности (рис. 3).
ВОЗНИКНОВЕНИЕ ФОТОСИНТЕЗА, ИСПОЛЬЗУЮЩЕГО ВИДИМЫЙ СВЕТ
Бактериородопсиновый фотосинтез
Со временем все меньше ультрафиолетовых квантов достигало поверхности Земли. Причиной тому было образование озонового слоя атмосферы в условиях повышения в ней концентрации кислорода. Кислород образовывался, по-видимому, вследствие фотолиза паров воды под действием того же ультрафиолетового облучения. Чтобы выжить в новых условиях, древние клетки должны были переключиться с ультрафиолетового света на какой-либо иной источник энергии, все еще доступный для них в новых условиях. Таким источником стал, вероятно, видимый свет.
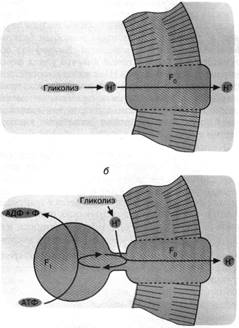
Рис. 3. Как первичная клетка могла избавиться от ионов НГ, образуемых гликолизом: а - облегченная диффузия ионов Н+ посредством белка (фактора F0 ), образующего Непроводящий путь сквозь клеточную мембрану; б - комплекс факторов F0 и F, (Н+ - АТФаза) активно откачивает из клетки ионы Н+ за счет гидролиза АТФ. Мембранные липиды показаны горизонтальной штриховкой, белки не заштрихованы
Другой сценарий эволюции мог бы состоять в том, что возникновение фотосинтеза, использующего видимый свет, произошло еще до помутнения атмосферы, а именно при проникновении жизни в более глубокие уровни океана, лишенные ультрафиолета. Замена опасного ультрафиолетового излучения на безопасный видимый свет могла бы быть тем признаком, который лег в основу естественного отбора на данном этапе эволюции. В рамках этой концепции создание озонового слоя имеет биогенную природу, явившись результатом фотолиза воды системой хлорофилльного фотосинтеза зеленых бактерий и цианобактерий.
Новый фотосинтез должен был, как и прежде, образовывать АТФ, который к тому времени уже прочно занял место в центре метаболической карты, выполняя роль "конвертируемой энергетической валюты" клетки. Однако аденин уже не мог играть роль улавливающей свет антенны, так как его максимум поглощения находится в ультрафиолетовой, а не в видимой области спектра. До нас дошли два типа фотосинтетических устройств, использующих видимый свет. В качестве антенны в одном из них служит хлорофилл, а в другом — производное витамина А, ретиналь, соединение с особым белком, названным бактериородопсином. Хлорофилл обнаружен у зеленых растений и почти у всех фотосинтезирующих бактерий. Исключение составляет одна группа соле- и теплоустойчивых архебактерий, содержащих бактериородопсин. Тем не менее именно бактериородопсин выглядит как эволюционно первичный механизм запасания клеткой энергии видимого света.
Бактериородопсин — светозависимый протонный насос. Он способен активно откачивать ионы Н+
из клетки за счет энергии видимого света, поглощенного ретиналевой частью его молекулы. В результате световая энергия превращается в трансмембранную разность электрохимических потенциалов ионов Н+
(сокращенно протонный потенциал, или ∆![]() Н
+
). Для бактерий ∆
Н
+
). Для бактерий ∆![]() Н
+
- это свободная энергия ионов Н+
, откачанных из клетки во внешнюю среду. Ионы Н+
как бы стремятся вернуться в клетку, где их стало меньше и где возник недостаток положительных электрических зарядов из-за действия бактериородопсинового Н+
- насоса. Энергия света, запасенная таким образом в виде ∆
Н
+
- это свободная энергия ионов Н+
, откачанных из клетки во внешнюю среду. Ионы Н+
как бы стремятся вернуться в клетку, где их стало меньше и где возник недостаток положительных электрических зарядов из-за действия бактериородопсинового Н+
- насоса. Энергия света, запасенная таким образом в виде ∆![]() Н
-, освободится, если позволить ионам Н+
войти обратно в клетку. У микробов, имеющих бактериородопсин, ионы Н+
входят через комплекс факторов F0
и F1
таким образом, что освобождающаяся энергия используется для синтеза АТФ. Нетрудно представить себе, как возник фотосинтез АТФ, катализируемый бактериородопсином и комплексом F0
F1
С появлением бактериородопсина клетка научилась создавать
Н
-, освободится, если позволить ионам Н+
войти обратно в клетку. У микробов, имеющих бактериородопсин, ионы Н+
входят через комплекс факторов F0
и F1
таким образом, что освобождающаяся энергия используется для синтеза АТФ. Нетрудно представить себе, как возник фотосинтез АТФ, катализируемый бактериородопсином и комплексом F0
F1
С появлением бактериородопсина клетка научилась создавать
29-04-2015, 05:18
