Зміст
Вступ
1. Види поглинальної здатності ґрунтів
2. Особливості поглинання аніонів
3. Ємність поглинання аніонів
Висновок
Список використаної літератури
Вступ
Поглинання аніонів зумовлюється рядом факторів, насамперед особливостями самих аніонів, складом ґрунтових колоїдів, їх електричним потенціалом і реакцією середовища.
Нітрати і хлориди не утворюють важкорозчинних солей і тому в ґрунтах не закріплюються в результаті хімічного поглинання. Сульфат-іон поглинається ґрунтами в невеликій кількості. Поглинання фосфатів - явище, широко розповсюджене в природних умовах.
Склад ґрунтових колоїдів значною мірою впливає на поглинання аніонів. Чим більше в ґрунті глинистих мінералів і колоїдів з базоїдними властивостями, тим більше аніонів вона здатна поглинути.
1. Види поглинальної здатності ґрунтів
К. К. Гедройц виділяв п'ять видів поглинальної здатності ґрунтів: механічну, біологічну, фізичну, хімічну і фізико-хімічну.
Механічна поглинальна здатність - властивість ґрунту не пропускати через себе частки, скаламучені у фільтрівній воді. Навіть при найважчому механічному складу між механічними елементами і мікроагрегатами майже завжди залишаються простори, що утворюють складну мережу пор і канальців. Ці отвори мають різну форму і діаметр, скривлення; канали нерідко перериваються і закінчуються тупиками. Тому ґрунтом затримуються не тільки частки крупніші діаметра пор, але і більш дрібні. Механічне поглинання збільшується в міру замулювання ґрунту, після деякого заповнення каналів частками неї [3, 84].
Механічна поглинальна здатність залежить від гранулометричного й агрегатного складу ґрунту, а також від щільності додавання. Ґрунтові суспензії з діаметром скаламучених часток більш 0,001 мм цілком затримуються глинистим ґрунтом. Піщанисті і крупноагрегатні пухкі ґрунти виявляють погану механічну поглинальну здатність. Завдяки механічній поглинальній здатності в дрібних ґрунтових порах затримуються окремі мікроорганізми розміром >0,00025 мм.
Механічна поглинальна здатність широко використовується в техніці. Наприклад, водоочищення виробляється фільтруванням води через піщанисті відстійники; за допомогою замулювання досягають зменшення фільтрації води через стінки і дно зрошувальних каналів (кольматаж).
Біологічна поглинальна здатність - закріплення речовин у тілах організмів. Вона здійснюється рослинами, мікроорганізмами і тваринами, що живуть у ґрунті. Головна особливість біологічного поглинання – вибіркове засвоєння з розчинів з мінімальним вмістом найбільш важливих для організмів речовин у присутності великих кількостей інших сполук. Завдяки цьому у верхніх горизонтах ґрунтів разом з гумусом акумулюються азот, фосфор, кальцій і ряд інших хімічних елементів [3,84].
Фізична поглинальна здатність (аполярна адсорбція) означає зміну (збільшення або зменшення) концентрації молекул розчиненої речовини в шарі розчину, що оточує ґрунтові колоїди. Вона залежить від кількості колоїдів ґрунту (тобто від механічного складу і гумусованості останньої), а також від їх якості (первинні і глинисті мінерали, органічні колоїди). Аполярна адсорбція обумовлюється вільною поверхневою енергією ґрунтових часток. Ґрунт і розчин, що знаходиться в ній, являють собою дисперсну систему, у якій тверді частки є дисперсною фазою, а розчин - дисперсійним середовищем. На границі зіткнення ґрунтових часток з дисперсійним середовищем виявляється вільна поверхнева енергія, вимірювана добутком поверхневого натягу розчину на сумарну величину поверхні часток. Чим вище ступінь дисперсності ґрунтових часток, тим більше їх поверхнева енергія. В міру подрібнювання часток різко зростає їх загальна і питома поверхня. Наприклад, при роздробленні куба з довжиною ребра 1 см до величини 0,1 μ сумарна поверхня зростає від 6 см2 до 60 м2 . У шарі ґрунту 20 см при вмісті 10% колоїдних часток сумарна поверхня ґрунтових часток на 1 га складе 70 тис. га. При такій великій поверхні величина поверхневої енергії буде значною.
За фізичними законами усяка дисперсна система прагне зменшити свою поверхневу енергію. Це можливо лише за рахунок укрупнення дисперсної фази або зменшення поверхневого натягу [3,85].
Стосовно води, що має при 0° С поверхневий натяг 75,2 дин/см, розчинені речовини поділяються на понижуючий поверхневий натяг і підвищувальні його. До останнього відносяться неорганічні кислоти, основи, солі, а також органічні сполуки з великою кількістю гідроксилів (наприклад, цукру). Знижують поверхневий натяг органічні кислоти, спирти, алкалоїди і деякі інші сполуки. Унаслідок прагнення дисперсної системи до зменшення поверхневої енергії відбувається концентрація розчину органічних кислот, спиртів, алкалоїдів на границі поділу дисперсної фази і дисперсійного середовища, тобто виявляється позитивна адсорбція названих сполук. Особливістю фізичної адсорбції є поглинання ґрунтом цілих молекул. Речовини, що підвищують поверхневий натяг, викликають негативну адсорбцію: на границі поділу дисперсної фази і дисперсійного середовища виявляється більш низька концентрація в порівнянні з загальним об`ємом розчину. До речовин, що підвищують поверхневий натяг, відносяться хлориди і нітрати. Унаслідок негативної фізичної адсорбції вони легко виносяться з ґрунту з водою, що пересуваються по профілю. Вимивання хлоридів із ґрунтової товщі має позитивне значення, тому що надлишок хлору-іона шкідливий для рослин. Негативна адсорбція нітратів може привести до виносу їх за межі кореневого шару.
Хімічна поглинальна здатність - це здатність ґрунту закріплювати у формі важкорозчинних сполук іони, що надходять у розчин. Закріплення іонів у результаті хімічного поглинання відбувається в тому випадку, коли в ґрунтовому розчині утримується сіль, що утворює з речовинами, що знаходяться в ґрунті, важкорозчинні сполуки.
Наприклад, у ґрунтах нейтральних або слабколужних (чорноземи, каштанові, сіроземи й ін.) внесені фосфорнокислі добрива (суперфосфат) закріплюються в ході реакції з бікарбонатом кальцію, що знаходиться в розчині:
![]()
У ґрунтах, що мають кислу реакцію (червоноземи, дерено-підзолисті), при наявності вільних гідратів окислів заліза й алюмінію може спостерігатися хімічне поглинання фосфат-іона в результаті утворення важкорозчинних фосфатів заліза й алюмінію. Наприклад:
![]()
Фізико-хімічна поглинальна здатність ґрунтів пов'язана з адсорбцією іонів у подвійному електричному шарі колоїдів. К. К. Гедройц називав фізико-хімічну поглинальну здатність ґрунтів обмінною. Якщо ґрунт обробити розчином солі, то відбудеться реакція між катіонами розчиненої солі і катіонами, що знаходяться в шарі компенсуючих іонів, колоїдних міцел. При цьому еквівалентні кількості катіонів міняються місцями, тобто катіони з розчину перейдуть у шар компенсуючи іонів, а катіони із шару компенсуючих іонів, у розчин. Сукупність ґрунтових сполук, здатних до реакцій обмінного поглинання, одержала назву ґрунтового поглинаючого комплексу (ППК). Головну частину ППК складають колоїди [3,86].
Катіони, що знаходяться в шарі, що компенсує, колоїдних міцел і здатні до реакцій обміну, одержали назва поглинених або обмінних.
Фізико-хімічна поглинальна здатність у колоїдів, заряджених негативно, виявляється стосовно катіонів. Наприклад, реакцію обміну між ППК ґрунту з розчином хлористого калію можна представити наступною схемою:
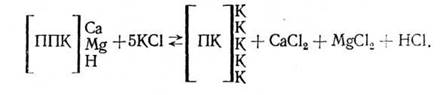
У випадку позитивного заряду колоїдів поглиненими іонами є аніони. Наприклад, якщо подіяти на красноземний ґрунт, що містить поглинений фосфат-іон, розчином їдкого натру, відбудеться реакція:
![]()
2. Особливості поглинання аніонів
Реакція середовища змінює електричний потенціал колоїдів. Підкислення середовища сприяє великому поглинанню аніонів; підлужування - навпаки. Чорноземи, що характеризуються реакцією, близької до нейтрального, поглинають менше аніонів, чим кислі підзолисті й особливо красноземні ґрунту (табл. 1).
Таблиця 1. Поглинення аніонів (в мг-екв. На 100 г ґрунту) (по І. Н. Антипову-Каратаєву і А.І.Рабінерсону)
| Ґрунт | SO4 2- (із 0,02 н. Н2 SO4 ) | РО4 3- (із 0 ,05 н. Н3 РО4 ) |
| Чонозем | 3,0 | 18,3 |
| Підзолиста | 4,2 | 41,9 |
| Краснозем | 7,8 | 74,0 |
Поглинання аніонів у природних умовах виявляється в декількох формах. Розрізняють хімічне, фізико-хімічне і біологічне поглинання аніонів, а також осадження їх у результаті механічного захоплення при коагуляції колоїдів. Нітрати і хлориди не утворюють важкорозчинних солей, і тому вони в ґрунтах не закріплюються в результаті хімічного поглинання [4,108].
Сульфат-іон дає з кальцієм важкорозчинну у воді сполуку, тобто поглинається хімічно. Реакції хімічного осадження мають велике значення в поглинанні фосфат-іонів. Вони закріплюються в ґрунтах у формі високоосновних фосфатів Са і Mg. Утворення важкорозчинних основних фосфатів кальцію можливо в ґрунтах з реакцією, близькою до нейтральної, у результаті обміну з катіонами кальцію, що знаходяться в дифузійному шарі ґрунтових колоїдів:
![]()
У кислих ґрунтах фосфати поглинаються при взаємодії з іонами заліза, алюмінію і марганцю. Хімічне осадження фосфатів протікає по наступних схемах:
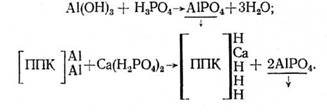
Фосфати в природних умовах також поглинаються в результаті фізико-хімічної адсорбції. В адсорбції фосфатів беруть участь амфотерні ґрунтові колоїди (гідрати окислів заліза й алюмінію, ґрунтові білки), а також деякі глинисті мінерали.
Обмінне поглинання фосфат-іона амфотерними колоїдами найбільше яскраво виражено в кислих ґрунтів (дерново-підзолисті, червоноземи). Аморфні гідрати окислів алюмінію і заліза відрізняються значно більшою здатністю до поглинання фосфатів у порівнянні з кристалічними гідроокислами заліза й алюмінію, тому що останні мають меншу поверхню.
Глинисті мінерали можуть хімічно поглинати фосфат-іони завдяки наявності в кристалічних ґратах гідроксилів-іонів, здатних до реакцій обміну. Гідроксили-іони виявляються в дифузійному шарі колоїдних часток у місцях зламу мінералів. В. М. Клечковський і Н. В. Каширкина (1950) вважають за можливе для каолініту обмін фосфат-іонів на гідроксил-іон не тільки на зламах кристалів, але і на поверхні октаєдричного шару. Для монтморилоніту, у якого октаєдричний шар закритий по обидва боки тетраєдричними шарами, таке поглинання неможливе [4,109].
Ряд авторів пояснюють поглинання аніонів амфотерними властивостями органічних колоїдів (білкові сполуки ґрунту). Ф. Фюр і Е. Бремнер (1964) допускають можливість фіксації нітритного азоту органічною частиною болотних і мінеральних ґрунтів.
Органічні колоїди відіграють у поглинанні аніонів менш помітну роль у порівнянні з мінеральними.
Більш гумусовані ґрунту, що містять багато органічних речовини (чорноземи, дерново-карбонатні), адсорбують фосфат-іони слабше, ніж малогумусні.
3. Ємність поглинання аніонів
Розміри поглинання аніонів обумовлені складом колоїдів, їх будовою і ступенем дисперсності. Адсорбційна здатність глинистих мінералів стосовно фосфат-іона залежить від процентного вмісту несилікатних окислів заліза й алюмінію (R2 O3 ), а також від величини відносини Sі2 O, R2 O3 . Тому що несилікатних R2 O3 у більшості ґрунтів мало, то головна роль у поглинанні фосфат-іона належить глинистим мінералам. Чим більше в колоїдах R2 O3 і чим менше співвідношення Sі2 O*R2 O3 , тим вище здатність колоїду до адсорбції фосфатів. Наприклад, з монтморилонітне відношення Sі2 O: R2 O3 =4, тоді як у каолініту воно дорівнює двом, тому каолініт значно більше поглинає фосфат-іона в порівнянні з монтморилонітом після вирівнювання ступеня дисперсності шляхом розтирання. Зі збільшенням ступеня дисперсності (після розтирання) поглинання аніонів різко зростає (табл. 2).
Таблиця 2. Поглинання фосфору глинистими мінералами і несилікатними полуторними окислами (по Н. І. Горбунозу, 1962)
| Поглинач | Поглинено мг Р2 О5 на 100 г мінералу |
| Монтморилоніт до розтирання | 450 |
| Монтморилоніт після розтирання | 8000 |
| Галуазит до розтирання | 1200 |
| Галуазит після розтирання | 8000 |
| Каолініт до розтирання | 50 |
| Гідроокис заліза аморфний | 9500 |
| Гідроокис заліза окристалізована | 88 |
| Гідроокис алюмінію аморфний | 15 700 |
| Гідроокис алюмінію окристалізована | 114 |
Зміна реакції середовища дуже впливає на поглинання аніонів ґрунтовими колоїдами. Наприклад, поглинання фосфат-іона в підзолистому ґрунті збільшується в б раз при підкисленні розчину з рн 7,3 до рн 3,5 (С. Г. Рыдкий, 1935). У лужному середовищі молекули фосфорнокислої солі можуть бути поглинені необмежено: фосфат-іон адсорбується в потенціаловизначальному шарі негативно заряджених амфолітоидів, а зв'язаний з ним катіон стає в шар противоіонів (С. Н. Іванов, 1962). При поглинанні фосфат-іона в потенціалвизначаючому шарі збільшується фізико-хімічне поглинання катіонів. Встановлено, що органічні плівки, що обволокують мінеральні агрегати, охороняють ґрунт від необмінного поглинання фосфатів [4,110].
Для аніонів, як і для катіонів, можна обчислити ємність поглинання. Ємністю поглинання аніонів називається сумарна кількість здатних до обміну поглинених аніонів. Ця величина виражається в міліграм-еквівалентах на 100 г ґрунти. Відношення кількості обмінних аніонів, що утримуються в ґрунті, (Л) до ємності поглинання аніонів (ЕА ), виражене у відсотках, являє собою ступінь насиченості ґрунтів аніонами:
![]()
Аніони ґрунтом поглинаються тим інтенсивніше, чим вище концентрація розчину, що впливає на ґрунт.
Міцність закріплення аніонів і насамперед фосфат-іона відіграє важливу роль в агрономічній практиці. Найбільш міцно зв'язані з ґрунтом фосфат-іони, поглинені в результаті хімічного осадження. Легше інших обмінюються на інші іони фосфат-іони, адсорбовані фізико-хімічним шляхом.
Висновок
К.К. Гедройц виділяв п'ять видів поглинальної здатності ґрунтів: механічну, біологічну, фізичну, хімічну і фізико-хімічну.
Поглинання аніонів у природних умовах виявляється в декількох формах. Розрізняють хімічне, фізико-хімічне і біологічне поглинання аніонів, а також осадження їх у результаті механічного захоплення при коагуляції колоїдів.
Фізико-хімічна поглинальна здатність ґрунтів пов'язана з адсорбцією іонів у подвійному електричному шарі колоїдів. К. К. Гедройц називав фізико-хімічну поглинальну здатність ґрунтів обмінною.
Розміри поглинання аніонів обумовлені складом колоїдів, їх будовою і ступенем дисперсності. Зі збільшенням ступеня дисперсності (після розтирання) поглинання аніонів різко зростає
Глинисті мінерали можуть хімічно поглинати фосфат-іони завдяки наявності в кристалічних ґратах гідроксилів-іонів, здатних до реакцій обміну.
Зміна реакції середовища дуже впливає на поглинання аніонів ґрунтовими колоїдами.
Список використаної літератури
1. Александрова Л.Н. Органическое вещество почвы и процессы его трансформации. - Л.: Наука, 1980.
2. Назаренко I.I. Ґрунтознавство: Навч. nociбник. – Чернівці: Рута, 1998, 1999.
3. Орлов Д.С. Химия почв. – М.: изд-во Моск. Ун-та, 1985. – 376 с.
4. Почвоведение/ Под ред. И.С.Кауричева. - М.: Агропромиздат,1989.
5. Почвоведение. В 2 ч./Под. ред. В.А.Ковды, Б.А.Розанова. -М.:Высш.шк.,1988.
29-04-2015, 00:40
