ЗМІСТ
ВСТУП
ГЛАВА 1 ХАРАКТЕРИСТИКА РОЗЧИНІВ
1.1 КЛАСИФІКАЦІЯ РОЗЧИНІВ
1.2 ТЕОРЕТИЧНІ ОСНОВИ ПРОЦЕСУ РОЗЧИНЕННЯ
1.3 ТИПИ РОЗЧИНЕННЯ
1.4 ТЕОРІЯ ГІДРАТАЦІЇ
1.5 СПОСОБИ ОБТІКАННЯ ЧАСТИНОК РІДИНОЮ
ГЛАВА 2 ХАРАКТЕРИСТИКА РОЗЧИННИКІВ
2.1 ВИМОГИ ДО РОЗЧИННИКІВ
2.2 ВОДА ОЧИЩЕНА
2.3 СПИРТ ЕТИЛОВИЙ
2.4 ХЛОРОФОРМ
2.5 ЕФІР МЕДИЧНИЙ
2.6 ГЛІЦЕРИН
2.7 ЖИРНІ ОЛІЇ
2.8 МАСЛО ВАЗЕЛІНОВЕ
2.9 ДИМЕКСИД — ДИМЕТИЛСУЛЬФОКСИД
ГЛАВА 3 ВЛАСНА ТЕХНОЛОГІЯ РОЗЧИНІВ
3.1 ВОДНІ РОЗЧИНИ
3.2 СПИРТОВІ РОЗЧИНИ
3.3 ГЛЩЕРИНОВІ РОЗЧИНИ
3.4 ОЛІЙНІ (МАСЛЯНІ) РОЗЧИНИ
ВИСНОВКИ
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
ВСТУП
Розчини - це однофазні системи перемінного складу, утворені не менш чим двома незалежними компонентами. По фізико-хімічних властивостях розчини займають проміжне положення між хімічними сполуками і механічними суспензіями. Від хімічних сполук розчини відрізняються змінністю складу, від механічних сумішей - однорідністю.
Розчини - сама велика група рідких лікарських форм. Як лікарська форма розчини мають ряд переваг:
а) лікарські речовини в стані розчину в порівнянні з багатьма іншими лікарськими формами, особливо твердими (порошки, таблетки, пігулки), швидше всмоктуються і скоріше роблять терапевтичну дію;
б) застосування розчину виключає дратівне вплив на слизуваті оболонки гіпертонічних концентрацій, що утворяться при контакті слизуватої оболонки з чи порошками таблетками (калію чи амонію броміди, йодиди й ін.);
в) розчини зручні для прийому. Їхня технологія досить проста.
Однак розчини не позбавлені і деякі недоліки. Вони не відрізняються портативністю, при збереженні часто виявляються хитливими. Гіркий смак багатьох ліків підсилюється при їхньому розчиненні.
Розчини, одержувані в умовах фармацевтичного підприємства, являють собою велику групу ліків, у яких лікарська речовина розчинена в чи воді якому або неводному розчиннику (олія, гліцерин, спирт).
Характерною рисою розчинів заводського виготовлення є невисока концентрація лікарської речовини, що знаходиться в межах 1-5% і в рідких випадках сягаюча 20%.
ГЛАВА 1 ХАРАКТЕРИСТИКА РОЗЧИНІВ
1.1 КЛАСИФІКАЦІЯ РОЗЧИНІВ
Розчини — це рідкі гомогенні системи, які складаються із розчинника та одного або декількох компонентів, розподілених у ньому у вигляді іонів або молекул.
Медичні розчини різноманітні за властивостями, складом, способами одержання і призначенням. Виготовляються вони переважно на фармацевтичних виробництвах системи аптечних управлінь Міністерства охорони здоров'я України. Окремі розчини, виготовлення яких вимагає проведення хімічних реакцій, одержують на хіміко-фармацевтичних заводах Міністерства медичної й мікробіологічної промисловості України (наприклад, рідина Бурова та ін.).
Розчини мають багато переваг перед іншими лікарськими формами, тому що значно швидше всмоктуються у шлунково-кишковому тракті. А вадами розчинів є їх великий об’єм, можливі гідролітичні і мікробіологічні процеси, що спричиняють швидке руйнування готового продукту.
Знання технології розчинів важливе при виготовленні майже всіх інших лікарських форм, де розчини є напівпродуктами або допоміжними компонентами.
Розчини займають проміжне становище між хімічними сполуками і механічними сумішами. Від хімічних сполук розчини відрізняються змінністю складу, а від механічних сумішей — однорідністю. Тому розчинами називають однофазні системи змінного складу, утворені не менш як двома незалежними компонентами. Найважливіша особливість процесу розчинення — це його спонтанність. Достатньо простого зіткнення речовини з розчинником, щоб через деякий час утворилася однорідна система, тобто розчин.
Розчинники можуть бути полярними і неполярними речовинами. До перших належать рідини, які поєднують велику діелектричну сталу, великий дипольний момент із наявністю функціональних груп, що забезпечують утворення координаційних (здебільшого водневих) зв'язків: вода, кислоти, нижчі спирти й гліколі, аміни та ін. Неполярними розчинниками є рідини з малим дипольним моментом, які не мають активних функціональних груп, наприклад вуглеводні, галоїдоалкіли тощо.
При виборі розчинника доводиться керуватися переважно емпіричними правилами, оскільки запропоновані теорії розчинності не завжди можуть пояснити співвідношення між складом і властивостями розчинів.
Здебільшого спираються на стародавнє правило: «Подібне розчиняється в подібному». Практично це означає, що для розчинення якоїсь речовини найбільш придатні ті розчинники, які структурно подібні, а тому мають близькі або аналогічні хімічні властивості.
Розчинність рідин у рідинах коливається в широких межах. Відомі рідини, що необмежено розчиняються одна в одній (спирт і вода), тобто вони подібні за типом міжмолекулярного впливу. Є рідини, обмежено розчинні (ефір та вода), і такі, що практично нерозчинні одна в одній (бензен і вода).
Обмежена розчинність спостерігається в сумішах ряду полярних і неполярних рідин, поляризованість молекул яких, а отже й енергія міжмолекулярних дисперсійних взаємодій різко відрізняються. За відсутності хімічних взаємодій розчинність максимальна в тих розчинниках, міжмолекулярне поле яких за інтенсивністю близьке до молекулярного поля розчиненої речовини. Для полярних рідких речовин інтенсивність поля частинок пропорційна діелектричній сталій.
Діелектрична стала води дорівнює 80,4 (при 20 °С). Отже, речовини, що мають високі діелектричні сталі, більшою чи меншою мірою розчинятимуться у воді. Наприклад, добре змішується з водою гліцерин (діелектрична стала 56,2), етиловий спирт (26), а нерозчинні у воді петролейний етер (1,8), тетрахлорометан (2,24). Однак це правило не завжди прийнятне, особливо щодо органічних сполук. У таких випадках на розчинність речовин впливають різні конкуруючі функціональні групи, їх кількість, відносна молекулярна маса, розмір і форми молекул та інші чинники. Наприклад, дихлоретан, діелектрична стала якого дорівнює 10,4, практично не розчиняється у воді, тоді як діетиловий етер, що має діелектричну сталу 4,3, розчиняється в ній при 20 °С у кількості 6,6 %. Мабуть, пояснення цьому слід шукати у здатності етерного атома оксигену утворювати з молекулами води нестійкі комплекси типу оксонієвих сполук.
Зі збільшенням температури взаємна розчинність обмежено розчинних рідин здебільшого зростає. Часто при досягненні певної для кожної пари рідин так званої критичної температури рідини повністю змішуються одна з одною (фенол і вода при критичній температурі 68,8 °С і вище розчиняються у будь-яких пропорціях). При зміні тиску взаємна розчинність дещо змінюється.
Розчинність газів у рідинах прийнято виражати коефіціентом поглинання, який вказує, скільки об’ємів даного газу, доведеного до нормальних умов (температура 0 °С, тиск 1 атм), розчиняється в одному об’ємі рідини при даній температурі й парціальному тискові газу в 1 атм. Розчинність газу в рідинах залежить від природи рідин і газу, тиску і температури. Залежність розчинності газу від тиску виражається законом Генрі, за яким розчинність газу в рідині прямо пропорційна його тискові над розчином при незмінній температурі. Однак при високих тисках, особливо для газів, які хімічно взаємодіють із розчинником, спостерігаються відхилення від закону Генрі. 3 підвищенням температури розчинність газу в рідині зменшується.
Будь-яка рідина має обмежену розчинювальну здатність. Це означає, що певна кількість розчинника може розчинити лікарську речовину в кількостях, які не перевищують означеної межі. Розчинністю речовини називається її здатність утворювати з іншими речовинами розчини. Дані про розчинність лікарських речовин наводяться у фармакопейних статтях. Для зручності в Державній фармакопеї України вказується приблизна кількість розчинника (мл), необхідна для розчинення 1 г речовини в інтервалі температур від 15 до 25 °С.
За ступенем розчинності розрізняють речовини:
—дуже легкорозчинні — до 1 мл;
—легкорозчинні — від 1 до 10 мл;
—розчинні — від 10 до 30 мл;
—важкорозчинні — від 30 до 100 мл;
—малорозчинні — від 100 до 1000 мл;
—дуже малорозчинні — від 1000 до 10 000 мл;
—практично нерозчинні — понад 10 000 мл.
Крім цього, оперують такими термінами:
—«частково розчинні» — ним користуються для характеристики сумішей, які містять розчинні та нерозчинні компоненти;
—«змішується з...» — це термін для характеристики рідин,
що змішуються із зазначеним розчинником у будь-яких співвідношеннях.
Розчинність кожної лікарської речовини у воді (або в іншому розчиннику) залежить від температури. Для переважної більшості твердих речовин розчинність з підвищенням температури зростає. Однак бувають винятки (наприклад, солі кальцію).
Деякі лікарські речовини можуть розчинятися повільно (хоча й розчиняються у значних концентраціях). Щоб прискорити розчинення таких речовин, вдаються до їх до нагрівання, попереднього здрібнення або перемішування суміші.
Розчинів, з якими працюють фармацевти, дуже багато. Залежно від обраного розчинника їх можна розподілити на кілька груп:
—водні.
—спиртові.
—гліцеринові.
—олійні.
За агрегатним станом розчинних лікарських речовин
розрізняють:
—розчини твердих речовин;
—розчини рідких речовин;
—розчини з газоподібними лікарськими засобами.
Згідно з ДФУ розчини як лікарську форму використовують у таких лікарських засобах:
—вушні лікарські засоби (вушні краплі та аерозолі, вушні
промивки);
—лікарські засоби для парентерального застосування (ін’єкційні, інфузійні засоби);
—лікарські засоби, що знаходяться під тиском;
—назальні лікарські засоби (назальні краплі та рідкі аерозолі, назальні промивки);
—настойки (розчини екстрактів у спирті відповідної концентрації);
—очні лікарські засоби (очні краплі, очні примочки);
—піни медичні (рідкий лікарський засіб, що знаходиться
в контейнері під тиском);
—рідкі лікарські засоби для орального застосування.
1.2 ТЕОРЕТИЧНІ ОСНОВИ ПРОЦЕСУ РОЗЧИНЕННЯ
Розчинення — спонтанний дифузійно-кінетичний процес, який відбувається при зіткненні речовини, що розчиняється, з розчинником.
У фармацевтичній практиці розчини одержують із твердих, порошкоподібних, рідких та газоподібних речовин. Як правило, одержання розчинів із рідких речовин, взаєморозчинних або таких, що змішуються між собою, відбувається без особливих труднощів, як просте змішування кількох рідин. А от розчинення твердих речовин, особливо тих, що розчиняються повільно і важко, є складним і трудомістким процесом. У процесі розчинення можна виділити умовно кілька стадій:
1.Поверхня твердого тіла контактує з розчинником. Контакт супроводжується змочуванням, адсорбціею і проникненням розчинника в мікропори частинок твердого тіла.
2.Молекули розчинника взаємодіють із шарами речовини на
поверхні розділення фаз. При цьому відбувається сольватація
молекул або іонів і відрив їх від поверхні розділення фаз.
3.Сольватовані молекули або іони переходять у рідку фазу.
4. Вирівнювання концентрацій в усіх шарах розчинника. Тривалість першої та четвертої стадій залежить переважно відшвидкості дифузійних процесів. Друга й третя стадії часто відбуваються миттєво або досить швидко і мають кінетичний характер (механізм хімічних реакцій). Із цього випливає, що швидкість розчинення залежить переважно від характеру дифузійних процесів.
Більшість твердих речовин є кристалічними. Розчинення кристалічної речовини складається з двох процесів, що відбуваються одночасно: сольватації (у даному випадку гідратації) частинок і руйнування кристалічних ґраток.
На рис. 1 показано процес розчинення натрію хлориду (кристалічна іонна сполука) у воді (полярна рідина). Іон натрію хлориду взаємодіє з дипольними молекулами води: до позитивного іону Nа+ диполі звернені своїми негативними полюсами, а до негативних іонів С1- — позитивними. Поступово диполі води проникають між іонами Nа+ і С1- у твердій фазі, відриваючи їх від кристалу.
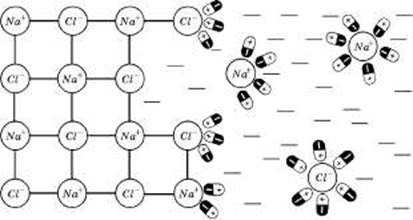
|
Рис. 1. Схема процесу руйнації кристалічних ґраток натрію хлориду у воді
Для ефективності розчинення важливо, щоб сили зчеплення між молекулами розчинника і частинками речовини, що розчиняється, були більшими за сили взаємного притягання цих частинок між собою. Вода порівняно з іншими розчинниками має велику полярність (найвище значення діелектричної сталої). Саме цією властивістю зумовлюються висока іонізаційна здатність води та її руйнівна дія на кристалічні ґратки багатьох полярних сполук.
При розчиненні речовин спостерігається поглинання або виділення теплоти. Поглинання теплоти вказує на витрачання енергії. Пояснюється це тим, що для переходу речовини з твердого стану в рідкий, тобто для розчинення кристалічних ґраток, обов'язково потрібна енергія. Наприклад, іони натрію та хлору до розчинення натрію хлориду у воді фіксовані у вузлах кристалічних ґраток, мають при цьому тільки обертові й коливальні рухи. Після розчинення іони починають відносно вільно рухатися всередині розчину, а для цього необхідне збільшення їхньої кінетичної енергії. Саме це й відбувається за рахунок відбирання енергії в розчинника у формі теплоти, внаслідок чого відбувається охолодження розчину. Чим міцніші кристалічні ґратки, тим значніше охолодження розчину.
Виділення теплоти при розчиненні речовини завжди вказує на активну сольватацію, тобто утворення сполук між розчинною речовиною і розчинником.
Кінцевий тепловий ефект розчинення потрібно розглядати як суму двох складників — позитивного теплового ефекту сольватації (Д) і негативного теплового ефекту руйнації кристалічних ґраток (С):
Знак теплового ефекту розчинення залежатиме від того, який складник переважає. Якщо кристалічні ґратки міцні, складник С чисельно більший від Д, у цьому разі розчинення речовини відбувається з поглинанням теплоти. I навпаки, у речовин зі слабкими кристалічними ґратками і сильно сольватованих (гідратованих) превалює складник Д, при цьому розчинення відбувається з виділенням теплоти. Часто позитивний і негативний теплові ефекти розчинення виявляються однаковими або дуже близькими, у таких випадках при розчиненні ми не спостерігаємо охолодження або розігрівання розчину.
Тепловий ефект розчинення відносять до 1 моля речовини, що розчиняється в досить великій кількості розчинника. 3 поглинанням теплоти розчиняються багато кристалічних речовин. 3 виділенням теплоти розчиняються луги та деякі інші речовини.
При розчиненні кристалогідратів у воді спостерігається більш низький тепловий ефект, ніж при розчиненні безводної солі.
Рідини здатні по-різному змішуватись одна з одною — від повної нерозчинності до змішування в будь-яких кількісних співвідношеннях.
У формі водних розчинів звичайно застосовують рідкі лікарські речовини, що мають повну взаємну розчинність, але можуть бути прописані й речовини з обмеженою розчинністю у воді. У разі розчинення полярних сполук відбуваються гідратація полярних молекул та дисоціація їх у розчині на вільні гідратовані іони (рис. 2). Наприклад, так поводяться молекули НСІ, що дисоціюють у водних розчинах на вільні гідратовані іони Н+ і С1-.
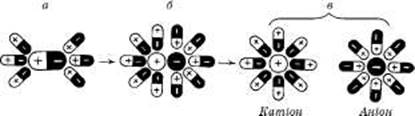
Рис. 2. Схема іонізації полярного електроліту
При розчиненні неорганічних кислот у воді спостерігається виділення теплоти. Очевидно, що у всіх цих випадках позитивний ефект гідратації значно вищий за негативний тепловий ефект руйнації асоціатів молекул. Аналогічна картина спостерігається і при розчиненні етилового спирту у воді.
При розчиненні рідин у рідині помітніше, ніж при розчиненні твердих речовин у рідині, відбувається збільшення або зменшення сумарного об’єму. Збільшення сумарного об’єму звичайно залежить від руйнації асоціатів молекул. Зменшення сумарного об’єму (стиснення, концентрація) найчастіше спричиняється утворенням сполук між рідинами, що змішуються.
Зміна об’єму розчину, якщо вона викликана його самоохолодженням або саморозігріванням, має тимчасовий характер, тому її слід враховувати під час готування розчинів заданого об’єму.
Уперше дифузійний механізм розчинення описав А. М. Шукарев у 1896 році. За його рівнянням швидкість процесу залежить від різниці концентрацій і поверхні розділення фаз. Сучасна теорія про розчинення твердих тіл ґрунтується на уявленні про цей процес як про кінетику гетерогенних процесів, під час яких можуть проявлятися і дифузійні, і міжфазні процеси (хімічні). Ця теорія розвинута в наукових працях О. Б. Здановського, М. Товдіна, О. Брама та ін. Відправним положенням дифузійно-кінетичної теорії слід вважати наявність пограничного дифузійного шару і його вплив на зміну швидкості процесу.
1.3 ТИПИ РОЗЧИНЕННЯ
Залежно від співвідношення дифузійних і кінетичних (міжфазних) механізмів можливі три основні типи розчинення:
1.Дифузійний, якщо значення коефіцієнта швидкості міжфазного процесу менше швидкості дифузійного процесу в 5 та більше разів.
2.Кінетичний, якщо значення коефіцієнта швидкості міжфазного процесу більше швидкості дифузійного процесу в 5 та більше разів.
3.Дифузійно-кінетичний, якщо значення коефіцієнта швидкості міжфазного і дифузійного процесів порівнювані.
На виробництві розчинення бажано проводити в кінетичній області, прискорюючи дифузійні процеси перемішуванням рідкої фази. Однак для повільно- і важкорозчинних речовин міжфазний процес відбувається навіть при інтенсивному перемішуванні.
Змочування твердого тіла залежить від полярності поверхні та розчинника. Гідрофільні і гідрофобні властивості поверхні можуть змінюватися внаслідок адсорбції повітря, вологи або домішок. На змочування і проникнення розчинника у пори впливають також пористість і шорсткість поверхні, наявність дефектів кристалічних ґраток й мікротріщин. Для кращого змочування і для запобігання адсорбції здрібнення доцільно проводити в середовищі розчинника, іноді з додаванням поверхнево-активних речовин.
Вступаючи в контакт при змочуванні, молекули чи іони твердої фази і розчинника починають взаємодіяти, утворюючи відповідні сольвати або їх асоціати. У близьких за властивостями і структурою розчинних системах (наприклад сполуки гомологічного ряду або ізомери між собою майже не взаємодіють) властивості розчинених речовин і розчинника зберігаються, змінюється лише концентрація речовини в розчині і може змінитися агрегатний стан. Однак частіше між розчинником і поверхневими молекулами твердих тіл утворюються водневі зв'язки, відбувається міждипольна взаємодія. Це приводить до утворення сольватів, асоційованих комплексів із різним ступенем стійкості та до дисоціації комплексів і молекул на іони. У таких розчинах розчинна речовина і розчинник знаходяться в зміненому стані порівняно з початковим.
1.4 ТЕОРІЯ ГІДРАТАЦІЇ
За молекулярно-кінетичною теорією гідратації при розчиненні речовин, що дають частинки з досить високою густиною заряду (іони Са, Мg, ін.), молекули розчинника, які знаходяться навколо цих частинок, притягуються, їх рухливість зменшується, уповільнюється обмін з іншими молекулами. Це явище одержало назву позитивної гідратацїї. Деякі іони, такі як К, Nа, Вг, I, С1, неначе відштовхують молекули розчинника, що спричиняє збільшення обміну між найближчими молекулами у порівнянні з чистим розчинником, зростає невпорядкованість молекул розчинника. У цьому разі відбувається негативна гідратація. Встановлено, що вона можлива тільки у певному інтервалі температур. При досягненні граничних температур негативна гідратація переходить у позитивну. Це пояснюється тим, що з підвищенням температури зростає тепловий рух молекул розчинника. Різноманітність взаємодій настільки велика, що досі немає єдиної теорії розчинів.
Однак сучасні уявлення про процес розчинення дозволяють на наукових засадах трактувати біофармацевтичні закономірності в зміні біологічної доступності і терапевтичної активності лікарських речовин у розчинах залежно від діелектричної проникності, наявності постійних та індукованих дипольних моментів, поляризованості іонів та молекул розчиненої речовини. У технології розчинів стає зрозумілою роль вибору середовища або додавання електролітів, високомолекулярних сполук, поверхово-активних речовин тощо.
При розчиненні руйнуються зв'язки між молекулами або іонами в розчинній речовині та розчиннику, що пов'язано із витрачанням енергії. Водночас починається процес комплексоутворення, тобто виникають нові зв'язки між молекулами та іонами, утворюються сольвати. Процес супроводжується виділенням енергії. Загальна енергетична зміна в системі може бути позитивною або негативною.
Так, при розчиненні спирту й води, багатьох лугів, кислот та інших речовин у воді виділяється
8-09-2015, 20:00
