Зміст
Вступ. 2
Розділ 1. Загальні відомості про Йод. 4
1.1.Опис елемента. 4
1.2. Електронно-графічна формула Йоду. 5
1.3. Фізичні властивості Йоду. 6
1.4. Хімічні властивості Йоду. 7
1.5. Біологічна роль Йоду в організмі людини. 10
Розділ 2. Препарати, що містять Йод. 13
2.1. Застосування Йоду в медицині 13
2.2. Класифікація препаратів, що містять Йод. 14
2.3. Йодомарин. 17
2.4. Йодбаланс. 20
2.5. Йодид. 24
Розділ 3. Аналіз препаратів, що містять Йод. 29
3.1. Контроль якості препаратів йоду згідно АНД.. 29
3.2. Методи аналізу, що були випробувані 31
3.3. Вибір методу аналізу індивідуальної хімічної речовини KI 35
3.4. Вибір оптимальних умов пробо підготовки. 41
3.5. Встановлення чутливості методики аналізу. 46
Висновок. 48
Список використаної літератури. 52
Вступ
Йод знають усі. Порізавши палець, ми тягнемося до склянки з Йодом, точніше з його спиртовим розчином. Йод є дуже сильним антисептичним препаратом. Однак Йод служить не тільки для змазування саден і подряпин.
Не всі знають наскільки важливий вміст Йоду в нашому організмі. Хоча Йоду в людському організмі всього 25 мг, він відіграє важливу роль. Велика частина «людського Йоду» знаходиться в щитовидній залозі: він входить до складу гормону, що регулює обмін речовин в організмі.
При нестачі Йоду затримується фізичний і розумовий розвиток і виникає хвороба, що називається ендемічний зоб. В результаті порушується обмін речовин, сповільнюється ріст. В окремих випадках ендемічний зоб може привести до глухоти, кретинізму... Це трапляється у високогірних районах і в місцях, сильно віддалених від моря, де природний вміст Йоду в повітрі, воді і їжі дуже низький.
Цікаво відзначити, що історія лікувального застосування Йоду іде в глиб століть. Цілющі властивості речовин, що містять Йод, були відомі за 3 тис. років до того, як був відкритий цей елемент. Китайський кодекс 1567 р. до н.е. рекомендує для лікування зоба морські водорості.
Завдяки включенню у свій раціон морської капусти жителі північно-східної провінції Китаю Мукден, незважаючи на нестачу Йоду в цій географічній зоні, не страждали ендемічним зобом. Про їхнє здоров'я у свій час подбав імператор Кансі. Він наказав місцевим жителям з'їдати по 2 кг морської капусти на рік. І вже майже 2 тис. років слухняні мукденці неухильно виконують мудрий імператорський указ.
Найбільш високий вміст Йоду у водоростях: у сухій ламінарії та у сухій морській капусті. Також джерелом Йоду для людини є: м'ясо, молоко, яйця, овочі, морська риба і продукти моря.
Дефіцитом Йоду страждають близько 1,5 мільярдів чоловік. У тому числі в у нас у країні від нестачі Йоду страждає близько 70% населення. Лихо, точніше катастрофа, бушує на планеті. Через постійну нестачу Йоду люди часом не блищать розумом, навіть дорослі. Такі люди, відрізняються вибуховим характером, а тому часто терплять невдачі на роботі й в особистому житті. Учені Всесвітньої організації охорони здоров'я вже однозначно прийшли до висновку, що коефіцієнт інтелекту IQ прямо залежить від вмісту Йоду в організмі. У нашому місті застосування, таких добавок дуже актуально тому що, у ґрунті, і відповідно в продуктах, дуже маленький вміст Йоду. Тому для збереження здоров'я й інтелектуального потенціалу населення, нестачу Йоду потрібно заповнювати.
У зв'язку з більшою чи меншою нестачею Йоду в їжі і воді застосовують йодовану поварену сіль. Застосування добрив, що містять Йод, може подвоїти і потроїти його вміст у сільськогосподарських культурах. Крім йодування солі в останні роки стали широко застосовувати йодування інших продуктів. Йод додають у деякі хлібобулочні вироби, молоко.
Все більше поширення одержують так називані БАДи «біологічно активні добавки», що містять Йод, такі як Йод–актив, Йодомарин, Йодбаланс, Йодид, і деякі інші.
У зв’язку з цим досить актуальним є контроль якості препаратів, що містять Йод. Згідно аналітичної нормативної документації, аналіз препаратів проводять методом потенціометрії з використанням срібного індикаторного електроду або з використанням рідинної хроматографії.
Оскільки вище зазначені методики є досить коштовними і потребують спеціального обладнання, була поставлена мета розробити більш дешеву та доступну методику контролю якості препаратів, що містять йод.Розділ 1. Загальні відомості про Йод
1.1. Опис елемента
 Рис. 1
Рис. 1
Йод – хімічний елемент VII групи періодичної системи Менделєєва. Атомний номер - 53. Відносна атомна маса 126,9045 (рис. 1). Галоген. З наявних у природі галогенів – найважчий, якщо, звичайно, не вважати радіоактивний короткоживучий астат. Практично весь природний Йод складається з атомів одного – єдиного ізотопу з масовим числом I127 , його вміст у земній корі 4 * 10-5 % по масі. Радіоактивний Йод I125 утвориться в ході природних радіоактивних перетворень. Зі штучних ізотопів Йоду найважливіші – Йод I131 і Йод I133 . їх в основному використовують у медицині.
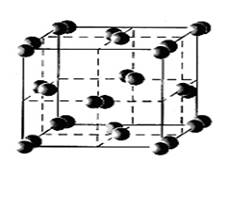 Рис. 2
Рис. 2
I2 – галоген. Темно-сірі кристали з металевим блиском. Летучий. Погано розчиняється у воді, добре – в органічних розчинниках (з фіолетовим чи коричневим фарбуванням розчину) чи у воді з добавкою солей – Йодидів. Слабкий окислювач і відновник. Реагує з концентрованими сірною й азотною кислотами, металами, неметалами, лугами, сірководнем. Утворює сполуки з іншими галогенами.
Молекула елементного Йоду, як і інших галогенів, складається з двох атомів. Йод – єдиний з галогенів – знаходиться у твердому стані при нормальних умовах. Красиві темно – сині кристали Йоду більше всього схожі на графіт. Чітко виражена кристалічна будівля (рис. 2), здатність проводити електричний струм – усі ці «металеві» властивості характерні для чистого Йоду.
1.2. Електронно-графічна формула Йоду
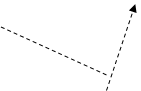
Конфігурація зовнішніх електронів атома Йоду 5s2 5p5. Відповідно до цього виявляє в сполуках перемінну валентність (ступінь окислювання): -1 (у HI, KI) (рис. 3); +1 (у HIO, KIO) (рис. 3); +3 (в IСl3 ) (рис. 4); +5 (у НIO3 , КIO3 ) (рис. 5); і +7 (у HIO4 , KIO4) (рис. 6).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
Рис.3
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
||
Рис.4
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
|||
Рис.5
![]()
![]()
![]()
![]()
![]()
|
|
|
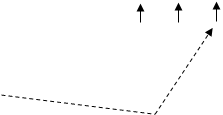 |
Рис.6
1.3. Фізичні властивості Йоду
Густина Йоду = 4,94 г/см3 , tпл = 113,5 °С, tкип = 184,35 °С. Молекула рідкого і газоподібного Йоду складається з двох атомів (I2 ). Помітна дисоціація I2 = 2I- спостерігається вище 700 °С, а також при дії світла. Уже при звичайній температурі Йод випаровується, утворюючи різко фіолетову пару з різким запахом. При слабкому нагріванні Йод возгоняється, осідаючи у виді блискучих тонких пластинок; цей процес служить для очищення Йоду в лабораторіях і в промисловості. Йод погано розчинний у воді (0,33 г/л при 25 °С), добре - у сірковуглеці й органічних розчинниках (бензолі, спирті), а також у водяних розчинах Йодидів.
1.4. Хімічні властивості Йоду
Хімічно Йод досить активний, хоча й у меншому ступені, ніж хлор і бром.
З металами Йод при легкому нагріванні енергійно взаємодіє, утворюючи Йодиди.
Hg + I2 = HgI2
З воднем Йод реагує тільки при нагріванні і не цілком, утворюючи йодистий водень.
I2 + H2 = 2НI
Елементний Йод - окислювач, менш сильний, ніж хлор і бром. Сірководень H2 S, тіосульфат натрію Na2 S2 O3 і інші відновлювачі відновлюють його до I- .
I2 + H2 S = S + 2НI
Хлор і інші сильні окислювачі у водяних розчинах переводять його в IO3 - .
При розчиненні у воді Йоду частково реагує з нею;
I2 + H2 O = HI + HIO
У гарячих водяних розчинах лугів утворяться Йодид і Йодат.
I2 + 2KOH = KI + KIO + H2 O
3KIO = 2KI + KIO3
При нагріванні йод взаємодіє з фосфором:
3I2 + 2P = 2PI3
А йодид фосфору у свою чергу взаємодіє з водою:
PI3 + 3H2 O = 3HI + H3 PO3
При взаємодії H2 SO4 і KI утвориться продукт, забарвлений в темно-бурий колір, і сульфатна кислота відновлюється до H2 S
8KI + 9H2 SO4 = 4I2 + 8KHSO4 + H2 S + 4H2 O
Йод легко реагує з алюмінієм, причому каталізатором у цій реакції є вода:
3I2 + 2AL = 2ALI3
Йод може також окисляти сірчисту кислоту і сірководень:
H2 SO3 + I2 + H2 O = H2 SO4 + 2HI
H2 S + I2 = 2HI + S
Йод взаємодіє з нітратною кислотою:
I2 + 10HNO3 = 2HIO3 + 10NO2 + 4H2 O
При взаємодії кислоти з лугом утворюється сіль:
HIO3 + KOH = KIO3 + H2 O
При окислюванні йодиду-іона йодат-ионом у кислому середовищі утворюється вільний йод:
5KI + KIO3 + 3H2 SO4 = 3I2 + 3K2 SO4 + 3H2 O
При нагріванні йодатна кислота розпадається, з утворенням найбільш стійкого оксиду галогенів:
2HIO3 = I2 O5 + H2 O
Оксид йоду (V) виявляє окисні властивості. Його використовують при аналізі CO:
5CO + I2 O5 = I2 + 5CO2
Перйодатна кислота H5 IO6 - пятиосновна. Її одержують у такий спосіб:
5Ba(IO3 )2 ---t --► Ba5 (IO6 )2 + 4I2 + 9O2
Ba5 (IO6 )2 + 5H2 SO4 = 5BaSO4 ↓ + 2H5 IO6
Це середня по силі кислота. Може утворювати солі в орто-формі (Ag5 IO6 ) і в мета-формі (NaIO4 ). Перйодатна кислота і її солі використовують в органічній і аналітичній хімії як сильні окислювачі.
Йод добре взаємодіє із тіосульфатом натрію:
2Na2 S2 O3 + I2 = Na2 S4 O6 + 2NaI
Ця його властивість використовується в аналітичній хімії.
Адсорбуючись на крохмалі, Йод забарвлює його в темно-синій колір; це використовується в Йодометрії і якісному та кількісному аналізі для виявлення Йоду.
Пари Йоду отрутні і дратують слизуваті оболонки. На шкірі Йод робить припікаючу і знезаражуючу дію. Плями від Йоду змивають розчинами соди чи тіосульфату натрію.
1.5. Бі ологічна роль Йоду в організмі людини
Йод – необхідний для тварин і людини мікроелемент. У ґрунтах і рослинах тайгово-лісовий нечорноземний, сухостепової, пустельної і гірських біогеохімічних зон Йод міститься в недостатній кількості або не збалансовано з деякими іншими мікроелементами (Са, Mn, Cu); з цим зв'язане поширення в цих зонах ендемічного зоба. У поверхневих питних водах Йоду мало.
У різних біогеохімічних провінціях вміст Йоду в добовому раціоні коливається (для людини від 20 до 240 мкг). Потреба в Йоді залежить від фізіологічного стану організму, пори року, температури, адаптації організму до вмісту Йоду в середовищі. Добова потреба в Йоді зростає при вагітності, посиленому росту, охолодженні. Введення в організм Йоду підвищує основний обмін, підсилює окисні процеси, тонізує м'яза.
Організм людини не тільки не має потребу у великих кількостях Йоду, але і з дивною сталістю зберігає в крові постійну концентрацію (10-5 – 10-6 %) Йоду, так називане Йодне дзеркало крові. З загальної кількості Йоду в організмі (близько 25 мг), більше половини знаходиться в щитовидній залозі. Майже весь Йод, що міститься в цій залозі, входить до складу різних похідних тирозину – гормону щитовидної залози, і тільки незначна частина його близько 1%, знаходиться у формі неорганічного Йоду I- .
Великі дози елементного Йоду небезпечні: доза 2–3 г смертельна. У той же час у формі Йодиду допускається прийом всередину у великих дозах.
Якщо ввести в організм із їжею значну кількість неорганічних солей Йоду, концентрація його в крові підвищиться в 1000 разів, але вже спустя 24 години Йодне дзеркало крові прийде в норму внутрішнього обміну і практично не залежить від умов експерименту.
У досвідах з радіоактивним йодом (I131 )установлено, що вже через 2 години після введення, його основна маса виявляється в щитовидній залозі. З усієї кількості йоду в організмі (50мг) 10-15 мг знаходяться в залозі, що дає підставу вважати щитовидну залозу депо йоду. Причому виявлена залежність між поглинанням йоду залозою і ступенем її активності. Якщо нагромадження йоду в залозі йде повільно, це свідчить про її знижену діяльність, а високий ступінь поглинання - про гіперфункцію залози. Проведення такого дослідження використовується в діагностику захворювань щитовидної залози.
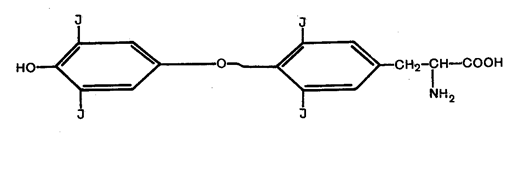
Рис. 7
Синтез гормонів відбувається шляхом йодувания тирозину і наступної конденсації (з'єднання) таких двох молекул з утворенням три- і тетрайодтироніна (тироксин), які і є власне гормонами (рис. 7).
Однак у клітках щитовидної залози вони зв'язані з білком глобуліном (йодтиреоглобуліном) і неактивні. В міру необхідності цей комплекс розпадається, гормони що звільнилися (вже активні), надходять у ток крові, розносяться до органів і тканин, де і виявляють свою дію. Вона в основному спрямована на посилення процесів біологічного окислювання, збільшення споживання кисню, регуляцію обміну жиру і води, диференціювання розвитку тканин.
З організму йод виводиться нирками і слинними залозами.
Гіпофункція щитовидної залози (гипотиреоз) чи її атрофія в молодому віці приводить до розвитку кретинізму, що виявляється затримкою росту, а потім і його зупинкою (карликовий ріст), порушенням пропорційного розвитку частин тіла, розумовою відсталістю. Аналогічний стан залози в дорослих виявляється набряком слизуватих оболонок – мікседемою. Для цього захворювання характерні набряклість, зв'язана з затримкою води в тканинах, зниження обміну речовин, ожиріння, загальна слабість, старечий вид навіть у молодих. При цьому захворюванні розміри щитовидної залози значно збільшені, вона виступає в області шиї у виді зоба. Для лікування застосовуються препарати йоду.
Гіперфункція щитовидної залози (гіпертиреоз) виявляється розвитком базедової хвороби. Її основні клінічні симптоми - загальне схуднення, тремтіння кінцівок, екзофтальм (витрішкуватість), порушення серцевої і психічної діяльності. У хворих різко підвищений основний обмін, із сечею виводиться багато азоту і креатину. Лікування базедової хвороби повинне бути спрямоване на зниження вироблення гормонів шляхом блокування надходження йоду в залозу, наприклад, застосовуючи похідні сечовини. В даний час широке використовують введення в організм у невеликих дозах радіоактивного ізотопу йоду I131 , що накопичується в клітках залози і, виділяючи Y-промені, викликає локальне (обмежене) опромінення залозистої тканини. У деяких випадках показане хірургічне видалення частини залози.
Розділ 2. Препарати, що містять Йод
2.1. Застосування Йоду в медицині
Антисептичні властивості Йоду в хірургії першим використовував лікар Буане. Як не дивно, найпростіші лікарські форми Йоду – водяні і спиртові розчини – дуже довго не знаходили застосування в хірургії, хоча ще в 1865 – 1866 р. великий російський хірург Н.И.Пирогов застосовував Йодну настойку при лікуванні раней.
Препарати, що містять Йод, мають антибактеріальні і протигрибкові властивості, вони мають також протизапальну і відволікаючу дію; їх застосовують зовнішньо для знезаражування ран, підготовки операційного поля. При прийомі всередину препарати Йоду впливають на обмін речовин, підсилюють функцію щитовидної залози. Малі дози Йоду (мікройод) гальмують функцію щитовидної залози, діючи на вироблення тиреотропного гормону передніх часток гіпофіза. Оскільки Йод впливає на білковий і жировий (ліпідний) обмін, він знайшов застосування при лікуванні атеросклерозу, тому що знижує вміст холестерину в крові; підвищує також фібринолітичну активність крові.
Для діагностичних цілей використовують рентгеноконтрастні речовини, що містять Йод. При тривалому застосуванні препаратів Йоду і при підвищеній чутливості до них можлива поява Йодизму – нежить, кропивниця, набряк Квінке, сльозотеча, вугревидний сип (Йододерма). Препарати Йоду не можна приймати при туберкульозі легень, вагітності, при захворюваннях нирок, хронічній йоддермії, геморрагічних діатезах, кропивниці.
2.2. Класифікація препаратів, що містять Йод
Йод - унікальна лікарська речовина. Він визначає високу біологічну активність
8-09-2015, 19:58
