Содержание
- Введение
- Химическая структура цефалоспоринов
- Механизм действия цефалоспоринов
- Механизмы формирования резистентности к цефалоспоринам
- Классификация цефалоспоринов
- Фармакология цефалоспоринов
- Цефалоспорины 1-го поколения
- Цефалоспорины 2-го поколения
- Цефалоспорины 3-го поколения
- Цефалоспорины 4-го поколения
- Побочные эффекты цефалоспоринов
- Список используемой литературы
Введение
Создание и внедрение в клиническую практику антибиотиков класса цефалоспоринов явилось, безусловно, одним из важнейших событием в истории химиотерапии бактериальных инфекции. В настоящее время, очевидно, что по ряду важнейших параметров: спектру антибактериального действия, фармакокинетике, безопасности и др., цефалоспорины превосходят антибиотики многих других классов, чем и объясняется их статус антибактериальных средств, наиболее широко применяемых во многих странах мира.
Рождение цефалоспоринов справедливо связывают с работами G.Brotzu, предположившего в начале 40-х годов, что периодическое самоочищение сточных вод в Сардинии обусловлено ингибирующей активностью особых микроорганизмов. В 1945 г. ему удалось выделить гриб Cephalosporium acremonium (в настоящее время именуемый Acremonium chrysogenum), обладавший выраженной антибактериальной активностью по отношению к грамположительным и грамотрицательным микроорганизмам. Следующим этапом (с 1955 по 1962 г.) явилось детальное изучение С.acremonium рабочими группами H.Florey и E.P.Abraham. Из продуктов обмена веществ этого гриба удалось выделить бактерицидную субстанцию - цефалоспорин С, ставшую исходным веществом для получения 7-аминоцефалоспорановой кислоты - структурной основы цефалоспоринов.
В 1962 г. в клиническую практику был введен первый антибиотик класса цефалоспоринов - цефалоридин, однако широкое клиническое применение цефалоспоринов началось только в конце 70-х годов. В настоящее время насчитывается более 50 цефалоспоринов (рис. 1), поэтому нет ничего удивительного в том, что врач испытывает немалые затруднения при выборе нужного препарата в соответствии с показаниями. В связи с этим целью настоящей лекции является объективная оценка возможностей цефалоспоринов в современной клинической практике.

Рис.1. "Древо" цефалоспоринов (по Periti, 1996)
Химическая структура цефалоспоринов
Цефалоспорины представляют собой бициклические соединения, состоящие из бета-лактамного и дигидротиазинового колец. Оба кольца и составляют 7-аминоцефалоспорановую кислоту (7-АЦК) - общее ядро молекулы цефалоспоринов. При этом модификация химической структуры 7-АЦК сопровождается существенными изменениями свойств (антибактериальной активности, параметров фармакокинетики и пр.) соответствующего соединения (рис. 2).
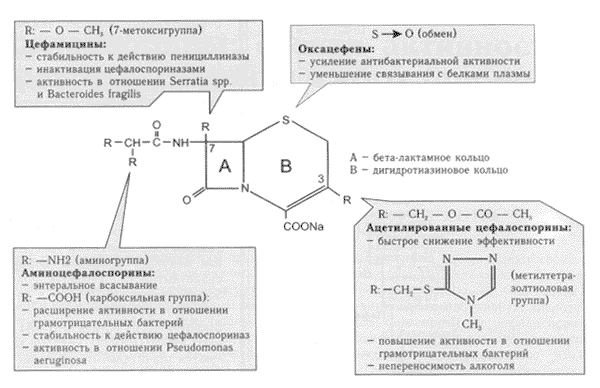 Рис.2. Цефалоспорины: связь между химической структурой и эффектом
Рис.2. Цефалоспорины: связь между химической структурой и эффектом
(по W.Graninger, 1994)
Механизм действия цефалоспоринов
Антибактериальная активность цефалоспоринов, как и других бета-лактамных антибиотиков, по крайней мере частично, обусловлена торможением синтеза пептидогликана - структурной основы микробной стенки. Пептидогликаны представляют собой длинные полисахаридные цепи со своеобразной сетчатой пространственной конформацией, в которых чередуются остатки N-ацетилглюкозамина (NAG) и N-ацетилмураминовой кислоты (NAM). NAG- и NAM-пентапептидные остатки пептидогликанов синтезируются в цитоплазме микробной клетки и транспортируются через цитоплазматическую мембрану. Далее эти остатки встраиваются в существующую пептидогликанную сеть (в процессе роста и деления клетки) с участием различных энзимов - транспептидаз, карбоксипептидаз, эндопептидаз. Собственно эти энзимы, находящиеся в цитоплазматической мембране, являются местом реализации антибактериальной активности (мишенями) бета-лактамных антибиотиков, в том числе цефалоспоринов; они получили название "пенициллинсвязывающие белки" (penicillin-binding proteins - РВР). В результате образования "длительной" ковалентной связи бета-лактамного антибиотика и РВР последние инактивируются. При этом эффект назначаемого бета-лактамного антибиотика зависит от того, какие РВР инактивируются и какую роль они играют в синтезе пептидогликана и выживании микробной клетки. Важно также подчеркнуть, что бактерицидный эффект цефалоспоринов реализуется только в процессе роста и размножения микроорганизмов, тогда как "покоящиеся" клетки неуязвимы для действия антибиотиков.
Механизмы формирования резистентности к цефалоспоринам
Устойчивость микроорганизмов к действию цефалоспоринов может быть связана с одним из следующих механизмов: а) видоизменением (модификация) РВР со снижением аффинности (сродства) к ним цефалоспоринов; б) гидролизной инактивацией антибиотика (бета-лактамазами); в) нарушением проницаемости внешних структур микробной клетки для антибиотика и затруднением его связывания с "мишенью" - РВР.
У грамположительных микроорганизмов цитоплазматическая мембрана относительно порозна и непосредственно прилежит к пептидогликанному матриксу, с связи с чем цефалоспорины достаточно легко достигают РВР. В противоположность этому, наружная мембрана грамотрицательных микроорганизмов имеет существенно боле% сложную "конструкцию": состоит из липидов, полисахаридов и белков, что является препятствием для проникновения цефалоспоринов в периплазматическое пространство микробной клетки (рис. 3). Цефалоспорины "проходят" сквозь наружную мембрану микробной клетки через так называемые пориновые каналы. В связи с этим, очевидно, уменьшение проницаемости пориновых каналов может привести к формированию антибиотикорезистентности.
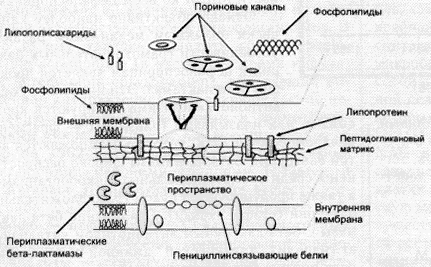
Рис.3. Схема строения бактериальной стенки грамотрицательных микроорганизмов
(по P.A.James, 1996)
Снижение сродства РВР к бета-лактамным антибиотикам рассматривают как ведущий механизм формирования резистентности Neisseria gonorrhea и Streptococcus pneumoniae к пенициллину. Метициллинрезистентные штаммы Staphylococcus aureus (MRSA) продуцируют РВР2 (РВР2а), которые характеризуются значительным снижением аффинности к пенициллиназарезистентным пенициллинам и цефалоспоринам. Способность этих "новых" РВР2а к замещению эссенциальных РВР (с более высоким сродством к бета-лактамам) в конце концов, приводит к формированию устойчивости MRSA ко всем цефалоспоринам.
Однако объективно наиболее клинически значимым механизмом развития устойчивости грамотрицательных бактерий к цефалоспоринам является продукция бета-лактамаз. Эти инактивирующие антибиотики энзимы кодируются хромосомами или плазмидами (плазмиды - фрагменты внехромосомной ДНК, которые размножаются внутри бактерий). Бета-лактамазы широко распространены среди грамотрицательных микроорганизмов, а также продуцируются рядом грамположительных бактерий (стафилококки). Связывание бета-лактамазы с бета-лактамным антибиотиком катализирует гидролиз "критической" аминной связи лактамного кольца, что и приводит к инактивации антибиотика.
Грамположительные микроорганизмы высвобождают бета-лактамазы непосредственно в окружающее их внеклеточное пространство. При этом известно, что большинство цефалоспоринов (за исключением, пожалуй, цефалоридина) достаточно устойчиво к гидролизующему действию стафилококковой бета-лактамазы. В связи с этим антистафилококковая активность цефалоспоринов зависит главным образом от их сродства к эссенциальным стафилококковым РВР. Так, например, цефамицины и цефтазидим, являясь достаточно бета-лактамазостабильными, демонстрируют низкую антистафилококковую активность вследствие низкого сродства к РВР S.aureus.
Бета-лактамазная резистентность грамотрицательных бактерий к цефалоспоринам имеет более сложный характер. У этих микроорганизмов бета-лактамазы "заключены" в периплазматическом пространстве. Важно подчеркнуть, что повышение продукции бета-лактамаз или новообразование энзимов с повышенным сродством к антибиотику является основной причиной распространения цефалоспоринрезистентных штаммов среди грамотрицательных микроорганизмов. При этом высокий уровень продукции TEM-I или SHV-I*(Чаще всего в названиях бета-лактамаз учитываются основные субстраты-антибиотики, фамилии исследователей или пациентов. Так, например, термин "ТЕМ" стали использовать для обозначения плазмидных энзимов, первоначально выделенных из микроорганизмов у больного Temorina, a SHV - англоязычная аббревиатура термина "сульфгидрильная вариабельность”), двух наиболее часто встречающихся плазмидассоцируемых бета-лактамаз бактерий семейства Enterobacteriaceae (Escherichia coli, Salmonella spp., Shigella spp., Klebsiella spp., Enterobacter spp. и др.), ассоциируется с формированием резистентности не только к пенициллинам - ингибиторам бета-лактамаз, но и к цефалотину, цефамандолу, цефоперазону.
Отдельные представители семейства Enterobacteriaceae (Enterobacter spp., Citrobacter freundii, Morganella morganii, Serratia marcescens, Providencia spp.), а также Pseudomonas aeruginosa демонстрируют способность к продукции "индуцибельных" хромосомных цефалоспориназ, характеризующихся высоким сродством к цефамицинам и цефалоспоринам 3-го поколения. Индукция или стабильное "дерепрессирование" этих хромосомных бета-лактамаз в период "давления" (применения) цефамицинов или цефалоспоринов 3-го поколения в итоге приведет к формированию резистентности ко всем доступным цефалоспоринам. Распространение данной формы резистентности увеличивается в случаях лечения инфекций, прежде всего вызываемых Enterobacter cloaceae и Pseudomonas aeruginosa, цефалоспоринами широкого спектра действия.
В последнее время были открыты и так называемые бета-лактамазы расширенного спектра действия, кодируемые плазмидами (extended-spectrum beta-lactamases - ESBL). ESBL происходят из ТЕМ-1, ТЕМ-2 или SHV-1 вследствие точечной мутации в активном центре энзимов и продуцируются преимущественно Klebsiella pneumoniae. Продукция ESBL ассоциируется с высоким уровнем резистентности к азтреонаму и цефалоспоринам 3-го поколения - цефтазидиму и др. (табл. 1).
Таблица 1. Чувствительность бетта-лактамных антибиотиков к плазмидным бетта-лактамазам (по K.Bush et al., 1995)
| Препарат |
Отношение к действию ферментов |
|
| широкого спектра (ТЕМ-1,2, SHV-1) |
расширенного спектра (TEM3-27, SHV2-5) |
|
| Пенициллины |
Разрушаются |
Разрушаются |
| Цефалоспорины |
Разрушаются |
Разрушаются |
| 1-го поколения |
Стабильны |
Разрушаются |
| 2-го поколения |
Стабильны |
Разрушаются |
| 3-го поколения |
Стабильны |
Разрушаются |
| Цефпиром |
Стабилен |
Частично стабилен |
| Карбапенемы |
Стабильны |
Стабильны |
Устойчивость цефалоспоринов 4-го поколения к действию бета-лактамаз еще предстоит оценить.
Таким образом, цефалоспорины, потенциально активные в отношении грамотрицательных микроорганизмов, должны первоначально пройти сквозь наружную стенку, избежать гидролизной деградации в периплазматическом пространстве под влиянием бета-лактамаз и далее связаться с РВР на внутренней мембране микробной клетки.
Классификация цефалоспоринов
Наиболее удачной является классификация цефалоспоринов, в которой учтен спектр антимикробной активности препаратов (табл. 2). При этом в каждом поколении (генерации) цефалоспоринов выделяют препарат-прототип, свойства которого используют при создании новых соединений: 1-е поколение - цефазолин, 2-е - цефуроксим, 3-е - цефотаксим, 4-е - цефепим.
Таблица 2. Сравнительная характеристика антимикробной активности цефалоспоринов (по P.Periti, 1996)
| Поколение антибиотика |
Чувствительность микроорганизмов |
|
| грамотрицательных |
грамположительных |
|
| 1-е |
++++ |
+ |
| 2-е |
+++ |
++ |
| 3-е |
+ |
+++ |
| 4-е |
++ |
++++ |
Цефалоспорины 1-го поколения характеризуются относительно узким спектром антимикробного действия, преимущественно в отношении грамположительных кокков. Цефалоспорины 2-го поколения демонстрируют вариабельную активность в отношении грамположительных кокков и более выраженное действие против грамотрицательных бактерий. Несмотря на относительно высокую активность цефамицинов в отношении грамотрицательных аэробных и анаэробных микроорганизмов, их также относят к цефалоспоринам 2-го поколения. Цефалоспорины, оказывающие выраженное бактерицидное действие на грамотрицательные микроорганизмы, объединены в рубрику цефалоспоринов 3-го поколения; часть из них характеризуется ограниченной активностью в отношении грамположительных кокков, особенно метициллинчувствительных штаммов S.aureus. К этому же поколению отнесен и цефсулазин, хотя клиническое значение этого препарата состоит в том, что он активен преимущественно против P.aeruginosa.
Цефепим и цефпиром (4-е поколение цефалоспоринов) демонстрируют наиболее широкий спектр антимикробной активности, включающий грамположительные кокки и грамотрицательные бактерии (большинство представителей семейства Enterobacteriaceae, P.aeruginosa).
Фармакология цефалоспоринов
Основные фармакологические свойства цефалоспоринов представлены в табл. 3. Ряд препаратов (цефалексин, цефуроксим и др.) способен абсорбироваться в желудочно-кишечном тракте. Цефалоспорины для парентального введения могут быть назначены как внутривенно, так и внутримышечно (цефалотин показан только для внутривенного введения). При этом необходимо отметить, что внутримышечное введение большинства цефалоспоринов очень болезненное, в связи с чем в качестве растворителя рекомендуют использовать лидокаин.
Таблица 3. Фармакинетика цефалоспоринов
| Препарат |
Средние терапевтические дозы |
Период полувыведения, ч |
Концентрация в цереброспинальной жидкости, мг/л |
Связывание с белками плазмы, % |
Путь выведения |
| 1-го поколения |
|
|
|
|
|
| цефазолин (кефзол) |
1 г каждые 8 ч |
1,8 |
80 |
Почки |
|
| цефалотин (кефлин) |
1-2 г каждые 4-6 ч |
0,6 |
71 |
Почки |
|
| цефалексин (палитрекс) |
0,5 -1г каждые 6 ч |
0,9 |
10 |
Почки |
|
| 2-го поколения |
|
|
|
|
|
| цефамандол |
1-2 г каждые 4-6 ч |
0,8 |
75 |
Почки |
|
| цефаклор (альфацет) |
0,25-0,5 г каждые 8 ч |
0,8 |
25 |
Почки |
|
| цефуроксим аксетил (зиннат) |
0,25-05 г каждые 12 ч |
1,3 |
35 |
Почки |
|
| 3-го поколения |
|
|
|
|
|
| цефотаксим (клафоран) |
2 г каждые 6-8 ч |
1,0 |
5,6-44 |
35 |
Почки |
| цефтазидим (фортум) |
2 г каждые 8 ч |
1,8 |
0,5-30 |
17 |
Почки |
| цефтриаксон (роцефин) |
1-2 г каждые 12 ч |
8,0 |
1,2-39 |
83-96 |
Почки-50% Желчь-40% |
Цефалоспорины легко проникают в различные ткани и среды организма, включая легкие, органы малого таза, перикард, брюшину, плевру, синовиальные оболочки. С терапевтических позиций большое значение имеет способность ряда цефалоспоринов (цефтриаксон, цефуроксим, цефтазидим, цефотаксим) проникать в цереброспинальную жидкость.
Большинство цефалоспоринов выводятся почками; при этом в моче создаются концентрации этих препаратов, во много раз превышающие минимально ингибирующие для большинства актуальных возбудителей инфекций мочевыводящих путей. Вследствие этого в лечении последних можно с успехом использовать среднетерапевтические дозы цефалоспоринов, но при снижении клубочковой фильтрации необходима соответствующая коррекция вводимой дозы антибиотика. Исключением из этого правила являются цефтриаксон и цефоперазон, экскретируемые преимущественно с желчью. Эти препараты не удаляются при гемодиализе, поэтому при проведении этой процедуры не требуется дополнительного увеличения дозы антибиотика.
При заболеваниях печени, даже в отсутствие асцита и его влияния на распределение антибиотика, существенно нарушается фармакокинетика большинства цефалоспоринов.
В отличие от фторхинолонов и аминогликозидов цефалоспорины не оказывают дозозависимого бактерицидного действия. При приеме препаратов быстро достигается максимальная концентрация их в сыворотке крови с последующим снижением ее ниже минимальной ингибирующей: период полужизни большинства цефалоспоринов составляет 0,5-2 ч, и лишь у цефтриаксона достигает 8 ч. В связи с этим, а также с непостоянным и непродолжительным постантибиотическим эффектом необходимо строго придерживаться рекомендаций относительно кратности введения цефалоспоринов.
Цефалоспорины 1-го поколения
Цефалоспорины 1-го поколения обладают высокой активностью против грамположительных кокков и умеренной в отношении M.catarrhalis, E.coli, P.mirabilis, K.pneumoniae. Штаммы Bacteroides fragilis резистентны к действию цефалоспоринов 1-го поколения. Препараты этой группы практически неактивны в отношении H.influenzae, метициллинрезистентных стафилококков, пенициллинрезистентных пневмококков и энтерококков. Антибактериальная активность цефалоспоринов 1-го поколения, вводимых внутрь и парентерально, практически одинакова (табл. 4).
Таблица 4. Антимикробная активность цефалоспоринов 1-го поколения
|
|
1 |
2 |
3 |
4 |
Грамположительные микроорганизмы |
||||
| St. aureus |
$$$ |
$$$ |
$$$ |
$$$ |
| Streptococci |
$$$ |
$$$ |
$$$ |
$$$ |
| Enterococci |
& |
& |
& |
& |
Грамотрицательные микроорганизмы |
||||
| Haemophilus influenzae |
& |
& |
& |
& |
| E.coli |
$$ |
$$$ |
$$ |
$$$ |
| Klebsiella ssp. |
$$ |
$$$ |
$$ |
$$$ |
| Serratia marcescens |
& |
& |
& |
& |
| Proteus mirabilis |
$$ |
$$ |
$$ |
$$$ |
| Pseudomonas aeruginosa |
& |
& |
& |
& |
Анаэробы |
||||
| Clostridii 8-09-2015, 21:17 Разделы сайта | ||||
