Энергетический обмен головного мозга
Введение
Изучение энергетического обмена в головном мозге привлекает особое внимание нейрохимиков и нейрофизиологов – При углубленном изучении деятельности мозга выяснено, что процессы, лежащие в основе таких специфических лишь для нервной ткани явлений, как проведение нервных импульсов, возбудимость, способность к хранению и переработке поступающей информации, а также многочисленные биохимические и биофизические процессы, связанные с поддержанием своеобразной пространственно-функциональной архитектоники мозга, с непрерывным образованием функциональных ансамблей нейронов, с обновлением и образованием синаптических структур и других, протекают с очень значительными энергетическими затратами.
Эти наблюдения, а также наличие теснейшей связи между окислительными процессами и функциональной активностью нервной ткани позволили сформулировать принципиально важное положение о том, что интенсивность энергетического обмена является одним из ведущих факторов, лимитирующих деятельность мозга. Большой вклад в обоснование данного положения внесен основоположниками функциональной нейрохимии – Е.С. Лондоном, А.В. Палладиным, Г.Е. Владимировым, МИ. Прохоровой, Г. Мак-Ильвейном, Г. Кребсом, Л. Соколовым, Б. Съёшио и др.
1. ПОТРЕБЛЕНИЕ ГОЛОВНЫМ МОЗГОМ КИСЛОРОДА
Одним из важнейших показателей, характеризующих интенсивность энергетического обмена, служит скорость дыхания. При определении артериовенозной разницы по кислороду, выполненном на интактных животных или людях, было установлено, что потребление кислорода мозгом человека составляет в среднем 1,5–1,7 мкмоль-г/мин», а мозгом крыс – 4,6–4,9 мкмоль-г/мин.
С помощью различных методических приемов показано, что по интенсивности дыхания головной мозг занимает ведущее место среди крупных органов и тканей. В качестве примера можно привести данные о среднем потреблении кислорода тканями взрослых крыс:
Головной мозг 5,43
Сердце: интенсивная работа 4,20 покой 3,06
Почки – 2,40
Печень 1,80
Головной мозг, составляющий не более 2% от массы тела, потребляет до 20–25% от всего поступающего в организм количества кислорода; более того, у новорожденных животных или человека на дыхание головного мозга может расходоваться до 50% от общего количества кислорода, потребляемого организмом.
Сопоставление дыхания разных отделов мозга животных показывает общую закономерность: снижение интенсивности дыхания по мере перехода от филогенетически более молодых передних отделов мозга к более старым задним отделам. Максимальная интенсивность дыхания установлена в коре больших полушарий; далее по скорости поглощения кислорода отделы мозга можно расположить в такой убывающей последовательности: мозжечок и промежуточный мозг > средний и продолговатый мозг > спинной мозг. Различия в интенсивности дыхания отдельных зон коры больших полушарий выражены слабо.
Высокая интенсивность окислительных реакций характерна не для всей нервной ткани; установлено, что периферические нервы используют лишь около 3% того кислорода, который потребляется эквивалентным по массе количеством ткани из центральных отделов нервной системы. В литературе имеются противоречивые данные о сравнительной интенсивности дыхания двух важнейших типов клеток нервной системы: нейрональных и нейроглиальных. Большинство исследователей указывают на значительно более интенсивные окислительные процессы в нейронах по сравнению с нейроглиальными клетками. Следует, однако, отметить, что сравнение интенсивности дыхания нейрональных и нейроглиальных клеток сопряжено с определенными методическими трудностями, поскольку практически отсутствуют надежные и быстрые методы получения интактных клеток мозга, не загрязненных миелином и другими примесями.
Учитывая парциальные объемы отдельных типов клеток и структур мозга, а также данные об интенсивности их дыхания, можно приблизительно оценить вклад нейронов и глии в общее потребление О. Для коры больших полушарий крыс установлено, что около/0% от общего поглощения кислорода приходится на нейроны, а примерно 30% – на глиальные клетки, причем перикарион нейронов, занимающий около 5% объема в коре больших полушарий, потребляет до 25% кислорода; синаптические окончания, занимающие около 15% объема, – примерно 10% кислорода.
2. ПОТРЕБЛЕНИЕ ГЛЮКОЗЫ ГОЛОВНЫМ МОЗГОМ
Наряду с высокой скоростью дыхания для мозга характерно интенсивное потребление глюкозы крови. Ни один орган не поглощает глюкозу крови с такой скоростью и в таких количествах, как мозг, и ни для одной ткани организма не отмечено такой острой потребности в этом субстрате окисления для поддержания нормального функционального состояния. Головным мозгом потребляется до 70% глюкозы, образующейся в печени и выделяющейся из нее в кровь. Потребление глюкозы мозгом взрослого человека, рассчитанное по артериовенозной разнице, составляет в среднем 0,25–0,30 мкмоль-г/мин. У мелких лабораторных животных этот показатель выше и в среднем равен 0,60–0,80 мкмоль-г/мин.
Эти данные позволяют считать, что глюкоза является основным субстратом окисления в головном мозге. Определение дыхательного коэффициента полностью подтверждает такое предположение. Действительно, по данным Г. Мак-Ильвейна, для головного мозга взрослого человека артериовенозная разница по кислороду равна 6,7±0,8 мл О2 /100 мл протекающей крови, а по диоксиду углерода – 6,6±0,8 мл СО2 /100 мл крови. Другими словами, количество потребляемого мозгом 02 практически эквивалентно количеству выделяемого им С02 ; дыхательный коэффициент близок к единице: по расчетам Г. Мак-Ильвейна, он составляет 0,99±0,03. Это говорит о том, что преимущественным путем метаболизма глюкозы в головном мозге является ее окисление в реакциях аэробного гликолиза, сопряженных с реакциями цикла трикарбоновых кислот.
Расчеты, проведенные на основании многочисленных экспериментов с глюкозой, содержащей С в различных положениях углеродной цепи, показывают, что около 85–90% глюкозы, потребляемой мозгом взрослого животного, полностью окисляется до С02 и Н2 0; около 5% расходуется в реакциях гликолиза с образованием молочной кислоты и лишь 5–7% используется в других реакциях. В некоторых случаях, например в экспериментах на мелких лабораторных животных с использованием введенной интрацистернально глюкозы С, показана возможность полного 100% окисления этого субстрата до С02 и Н2 0.
Необычайная зависимость функционирования головного мозга от постоянного притока глюкозы из крови объясняется прежде всего тем, что собственные запасы данного углевода в мозговой ткани чрезвычайно малы по сравнению с высокой интенсивностью его окисления. По данным многих исследователей, содержание глюкозы в мозге животных и человека составляет в среднем 1,5–4,5 мкмоль-г. Даже при условии использования глюкозы только для окисления ее запасы в мозге могут быть полностью исчерпаны за 3–6 мин.
При уменьшении уровня глюкозы в крови печень, почки, скелетные и сердечная мышцы для – поддержания энергетического баланса и сохранения функциональной активности способны окислять целый ряд других субстратов. Головной же мозг в этих условиях продолжает потреблять по-прежнему высокие количества глюкозы и кислорода. И лишь при снижении концентрации глюкозы крови ниже критических величин значительно падает потребление мозговой тканью, как глюкозы, так и кислорода и развивается коматозное состояние с потерей сознания.
Попытки компенсировать развитие комы и поддерживать энергетический баланс головного мозга путем введения животным различных метаболитов глюкозы даже в весьма значительных количествах были неудачными; при гипогликемической коме лишь внутривенные инъекции глюкозы могут нормализовать энергетический метаболизм мозга и вывести животное из коматозного состояния. Эти наблюдения указывают на весьма ограниченную способность головного мозга компенсировать уменьшенное поступление глюкозы за счет окисления других энергетических субстратов. Основной причиной этого является низкая проницаемость гематоэнцефалического барьера в мозге взрослых животных для других субстратов окисления.
Транспорт глюкозы в мозг осуществляется преимущественно с помощью специальной системы переносчиков, активно функционирующей в широких пределах концентраций глюкозы в крови – от 2,75 до 16,50 мкмоль/мл». На долю пассивной диффузии приходится не более 5% от общего потока глюкозы.
Исследования активного переноса глюкозы через ГЭБ, выполненные invitroна препаратах капилляров мозга, которые рассматривают как анатомический локус ГЭБ, работы на культуре клеток мозга, а также эксперименты invivo с С-глюкозой или ее дериватами, позволили установить основные характеристики этого процесса. В табл. 1 приведены некоторые кинетические параметры транспорта глюкозы и ряда других соединений через ГЭБ. Сравнение значений Км и позволяет убедиться, насколько активнее переносится через ТЭБ глюкоза по сравнению с другими веществами.
Если сопоставить приведенные в табл. 1 Км и со средними значениями потребления этого субстрата мозгом крыс, то становится очевидно, что в нормальных физиологических условиях поступление глюкозы через ГЭБ не лимитирует ее метаболизм. Однако при гипогликемии или усиленном использовании глюкозы, например нри интенсификации гликолиза в условиях дефицита кислорода или при судорогах, скорость переноса глюкозы через ГЭБ может ограничивать начальные этапы ее метаболизма.
Таблица 1. Характеристика транспортных систем гематоэнцефалического барьера
| Транспортируемые соединения | Преимущественный субстрат | мМ | V МКМОЛЬМИН Т |
| Гексозы | Глюкоза | 9 | 1600 |
| Монокарбоновые кислоты | Лактат | 1,9 | 120 |
| Нейтральные аминокислоты | Фенилаланин | 0,12 | 30 |
| Основные аминокислоты | Лизин | 0,1 | 6 |
| Амины | Холин | 0,22 | 6 |
| Пурины | Аденин | 0,027 | 1 |
| Нуклеозиды | Аденозин | 0,018 | 0,7 |
Потребность мозга в кислороде и глюкозе заметно изменяется в ходе онтогенеза, значительно повышаясь с его ростом и дифференцировкой, а также формированием отдельных структурно-функциональных ансамблей нейронов. По мере развития головного мозга скорость окисления глюкозы в нем возрастает и одновременно увеличивается зависимость функциональной активности нейронов от интенсивности окислительных процессов как источника энергии.
3. ГЛИКОГЕН КАК ВОЗМОЖНЫЙ ЭНЕРГЕТИЧЕСКИЙ ИСТОЧНИК В ГОЛОВНОМ МОЗГЕ
Сопоставление данных содержания глюкозы в мозге разных животных и скорости ее потребления мозговой тканью показывает, сколь незначительны собственные ресурсы этого метаболита в мозге, и объясняет отмеченную зависимость функциональной активности головного мозга от поступления углеводов с кровью. Возникает вопрос, в какой мере уровень глюкозы в мозге может поддерживаться за счет гликогена.
Уровень этого полисахарида в мозговой ткани разных животных составляет в среднем 2,5–4,5 мкмоль/г. Общее содержание гликогена в мозге эмбрионов и новорожденных животных значительно выше, чем в мозге взрослых. Например, в мозге у новорожденных мышей гликогена в 3 раза больше, чем в мозге взрослых животных. По мере роста и дифференцировки мозга, а также возрастания зависимости функционального состояния мозга от скорости дыхания концентрация гликогена быстро снижается и далее в мозге взрослого животного поддерживается относительно постоянной. Эти изменения связывают с быстрой активацией фосфорилазной системы в первые дни постнатального развития и с повышением ее чувствительности к различным регуляторным воздействиям, в частности к гормональной регуляции.
Гликоген в качестве субстрата участвует в энергетическом обмене. В экспериментах, выполненных на кошках, к перфузионной жидкости добавляли глюкозу 1–6С. Анализ С02 в оттекающей от мозга крови показал разбавление С02 , образующегося из меченой глюкозы, нерадиоактивной углекислотой, источником которой служил окисляющийся гликоген мозга. Расчеты показывают, что лишь до 7–10% энергетических потребностей головного мозга могут покрываться за счет расщепления гликогена.
В качестве энергетического источника используется свободная фракция гликогена, на долю которой приходится около 20–25% от общего содержания углевода в мозге. Остальная часть гликогена находится в связанном состоянии – это наиболее интенсивно обновляющаяся фракция гликогена. Именно за счет связанного гликогена происходит пополнение фонда расщепляющейся свободной фракции. Особенно важное значение этот субстрат имеет в головном мозге при экстремальных состояниях, когда уменьшается поступление в мозг глюкозы крови. Однако из-за небольших размеров пула гликогена в мозге полное расщепление его до глюкозы с последующим окислением может произойти в течение 5–7 мин.
Таким образом, собственные углеводные запасы в нервной ткани относительно невелики и не могут обеспечить энергетические потребности нормально функционирующего головного мозга в течение длительного времени. Это обстоятельство наряду с отмеченной ограниченной способностью мозга использовать другие субстраты окисления лежит в основе характерной для нервной ткани зависимости от постоянного поступления глюкозы из крови-
Для того чтобы понять, каким образом в головном мозге обеспечивается высокий уровень энергетического обмена, за счет чего глюкоза используется почти полностью именно в реакциях окисления и для обеспечения энергетических потребностей ткани, а не в других метаболических процессах, необходимо более детально рассмотреть вопросы регуляции скоростей основных путей окисления – гликолиза и цикла трикарбоновых кислот.
4. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ В ГОЛОВНОМ МОЗГЕ И МЕХАНИЗМЫ ЕГО РЕГУЛЯЦИИ
В последние годы в литературе появились сведения о специфичности регуляторных механизмов, контролирующих метаболизм глюкозы в функционально различных органах и тканях в условиях интактного организма. Особое внимание исследователей сосредоточено на изучении соотношения активностей и механизмов контроля над теми ферментами, которые конкурируют за использование субстратов, стоящих в точках перекреста нескольких метаболических путей. Имеются лишь единичные публикации, посвященные исследованию механизмов, обеспечивающих высокую интенсивность энергетического обмена мозга invivo, а также регуляции метаболизма мозга. Это объясняется сложной и гетерогенной структурой, наличием ГЭБ и рядом других причин, затрудняющих интерпретацию экспериментальных данных и экстраполяцию результатов, полученных invitro, на мозг интактного животного. Многие аспекты этой важной и сложной проблемы требуют дальнейших углубленных нейрохимических исследований.
Пути утилизации глюкозы в мозге; гликолиз и механизмы, контролирующие его скорость
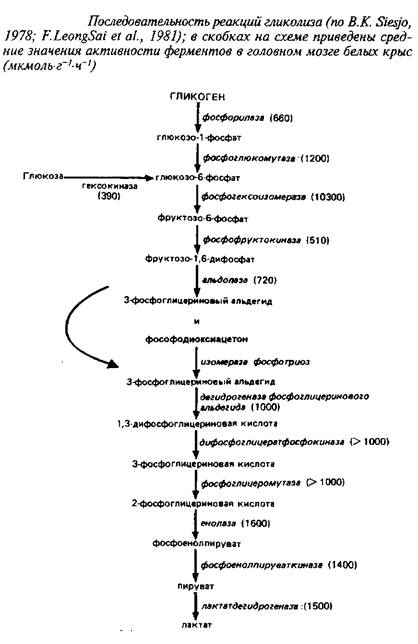
Последовательность реакций аэробного гликолиза, а также средние значения активностей ферментов, катализирующих отдельные стадии, приведены на схеме 1.
Из сопоставления активностей ферментов видно, что наиболее медленными реакциями, которые могут лимитировать скорость потока метаболитов по гликолитической цепи, являются гексокиназная и фосфофруктокиназная реакции.
Представление о количественном соотношении промежуточных компонентов гликолиза дают следующие средние результаты определения уровня метаболитов в головном мозге крыс:
| Гликоген | 1,9 – | 3,8 |
| УДФ-глюкоза | 0,08 – | 0,17 |
| Глюкоза | 1,52 – | 3,70 |
| Глюкозо-6-фосфат | 0,039- | 0,049 |
| Фруктозо-б-фосфат | 0,017- | 0,023 |
| Фруктозо – 1,6 – дифосфат | 0,010- | 0,017 |
| Дигидроацетонфосфат | 0,024 | |
| 2-Глицероальдегидфосфат | 0,021- | 0,046 |
| З-Фосфоглицерат | 0,100- | 0,085 |
| 2-Фосфоглицерат | 0,010- | 0,016 |
| Фосфоенол п ируват | 0,035- | 0,097 |
| Пируват | 0,120- | 0,190 |
| Лактат | 1,26 – | 1,70 |
Гексокиназная реакция. Первым этапом на пути вовлечения свободной D-глюкозы, поступающей в мозг из крови, в разнообразные метаболические превращения служит реакция фосфорилирования, катализируемая гексокиназой. Для регуляции энергетического метаболизма в головном мозге гексокиназная реакция имеет особое значение, так как она является основным поставщиком глюкозо-6-фосфата, необходимого для дальнейших превращений. В других тканях, таких как печень, сердечная и скелетная мышцы и др., источником большей части глюкозо-6- фосфата служит реакция расщепления гликогена или реакции глюконеогенеза.
Гексокиназная реакция является доминирующим путем пополнения пула метаболитов гликолиза в мозге, поскольку, как уже упоминалось, глюкоза представляет собой основной энергетический субстрат в этой ткани. Окисление иных энергетических субстратов и ввод компонентов в гликолитическую цепь через другие реакции в нервной ткани не имеет существенного значения.
Все это позволяет рассматривать гексокиназную реакцию как первый пункт контроля над скоростью энергетического обмена в головном мозге. Лишь в экстремальных ситуациях – при резкой гипогликемии или в условиях чрезвычайно интенсивного гликолиза при кислородной недостаточности – лимитирующим этапом может стать транспорт глюкозы через ГЭБ.
Активность гексокиназьг мозга относительно невелика, особенно по сравнению с активностью других ферментов гликолиза; в среднем она составляет 350–450 мкмоль субстратаг-ч~. Эта величина в 5–10 раз превышает среднюю скорость поступления глюкозы в мозг. Более того, при сопоставлении активности фермента в различных тканях максимальные величины получены рядом авторов именно в экспериментах с головным мозгом.
Распределение фермента в нервных клетках неравномерно; с помощью гистохимических, иммунохимических методов, а также при исследовании обогащенных препаратов установлена более высокая активность гексокиназы в нейронах, особенно в си-наптических окончаниях, по сравнению с олигодендроглией.
Интересная особенность отмечена при изучении распределения фермента между компартментами клетки: в отличие от ряда других тканей в мозге основная часть гексокиназы сосредоточена не в цитоплазме, а в митохондриях. В связывании фермента с внешней митохондриальной мембраной участвует специфический белок, детальные исследования свойств которого указывают на идентичность его с белком, формирующим поры. На прочность взаимодействия гексокиназы с мембранным белком оказывает влияние фосфолипидный компонент мембраны. Причины такого своеобразного внутриклеточного распределения гексокиназы в мозге пока не совсем ясны, но имеются предположения, что такая локализация обеспечивает более быстрое и эффективное фосфорилирование глюкозы за счет АТФ, синтезированного в митохондриях.
Необходимо отметить, что из четырех известных изофеоментов гексокиназы – ГКГ , ГКП , ГКШ , ГК1У в мозге встречается лишь первые два, причем на долю ГКТ приходится около 90% суммарной активности. Именно для этих двух изоферментов наиболее выражена способность связываться с внешней митохондриальной мембраной.
Связывание гексокиназы – обратимый процесс; на соотношение между связанной и солюбилизированной формами фермента влияет рад факторов, в первую очередь – отношение АТФ/АДФ, концентрация неорганического фосфата и глкжо-зо-6-фосфата, а также уровень свободных: жирных кислот. Действие указанных факторов проявляется в пределах их физиологических концентраций; это дало Вильсону основание предположить, что изменение субклеточного распределения гексокиназы служит важным механизмом регуляции активности фермента invivo.
Такое предположение очень интересно, поскольку мембранно-связанная гексокиназа более активна, чем цитоплазматическая форма: значение Км для АТФ митохондриального фермента в 3 раза ниже, чем у солюбилизированного. Кроме того, связанная форма гексокиназы в меньшей степени ингибируется глюкозо-6-фосфатом. Установлено, что значение Kj солибилизированной формы гексокиназы равна в среднем 10~М, а митохондриальной – 10~*М; для сравнения можно привести средние значения концентрации глю-козо-6-фосфата в цитоплазме, где в основном сосредоточен этот метаболит – -10~М.
Накопление в клетках аденозинтрифосфата и возрастание отношения АТФ/АДФ приводит к усилению солюбилизации гексокиназы, что вызывает замедление скорости фосфорилирования глюкозы и, следовательно, торможение гликолиза. Напротив, при уменьшении уровня АТФ в клетке происходит новое связывание фермента с ионами магния в митохондриальной мембране, которое вследствие указанной разницы значений ведет к освобождению фермента от ингибирования глюкозо-6-фосфатом и повышению скорости реакции фосфорилирования субстрата.
В мозге интактных животных гексокиназа находится преимущественно в ингибированном состоянии. Исследования, выполненные invivo, показали резкое повышение количества связанного фермента при усилении гликолиза и, напротив, возрастание доли солюбилизированной гексокиназы при снижении скорости гликолиза в условиях анестезии.
Таким образом, быстрые взаимопереходы солюбилизированной и связанной с митохондриями гексокиназы обеспечивают значительный «запас мощности» фермента, позволяя быстро менять скорость фосфорилирования глюкозы при сдвигах в энергетическом балансе мозга без изменения скорости синтеза фермента. Этот механизм контроля активности гексокиназы, чутко реагирующий на сдвиги таких балансовых показателей энергетического обмена, как отношение АТФ/АДФ, уровень неорганического фосфата, несомненно, играет большую роль в регуляции энергетического метаболизма мозга.
Соотношение путей метаболизма глюкозо-б-фосфата в мозге. Как известно, глюкозо-6-фосфат, образующийся в гексокиназной реакции, может быть использован в качестве исходного субстрата в нескольких метаболических путях: гликолиз, пентозофосфатный путь, синтез гликогена и др. Интенсивность использования его в той или иной последовательности реакций определяется соотношением активностей ферментов, конкурирующих за глюкозо-6-фосфат.

8-09-2015, 23:20
