В табл. 2 приведены данные об интенсивности основных путей метаболизма глюкозо-6-фосфата в мозге и печени крыс, рассчитанные на основании экспериментов с С-глюкозой и анализа активностей ферментов. Несмотря на то, что эти расчеты весьма приблизительны, они все же дают наглядное представление о значительных отличиях в метаболизме глюкозо-6-фосфата в головном мозге и печени. Исследования альтернативных путей метаболизма глюкозо-б-фосфата/я vivoс помощью препаратов меченой глюкозы, содержащей С в разных положениях, а также результаты математического моделирования подтвердили, что вовлечение глюкозо-6-фосфата в реакции гликолиза с последующим окислением в ЦТК доминирует над другими путями использования этого субстрата в мозге взрослых животных.
Таблица 2. Интенсивность отдельных путей метаболизма глюкозо-6-фосфата в головном мозге и печени крыс
| Метаболический путь | Доля глюкозо-6-фосфата, вовлекаемого в реакции, % | |
| мозг | печень | |
| 1. Окисление до С (Х и Н2 0 в ходе аэробного гликолиза и ЦТк | 80–90 | Около 20 |
| 2. Синтез гликогена | 5–7 | 20–25 |
| 3. Расщепление в глюкозо-6-фосфатазной реакции до свободной глюкозы | Следы | До 50 |
| 4. Пентозофосфатный путь | 5–15 | |
| 5. Другие реакции | Менее 5 | 5–10 |
Преимущественное использование глюкозо-6-фосфата в реакциях гликолиза является характерной чертой энергетического метаболизма; оно обусловлено значительным превышением активности фосфогексоизомеразы и фосфофруктокиназы над активностью других ферментов, конкурирующих за общий субстрат. Относительная роль минорных путей метаболизма глюкозо-6-фосфата заметно меняется в мозге х возрастом животного, прежде всего это относится к пентозофосфатному пути.
Как известно, интенсивность использованиятлюкозо-6-фосфата в реакциях пентозофосфатного пути в-значительной степени определяется активностями ферментов, катализирующих начальные, наиболее медленные стадии: глюкозо-6-фосфатде-гидрогеназы и 6-фосфоглюконатдегадрогеназы.
Установлено, что активности этих ферментов в головном мозге молодых животных в 1,5–2 раза выше, чем у взрослых. Максимальные значения активностей отмечаются исследователями в период наиболее интенсивной миелинизации; у крыс этот период соответствует 20–30 дням постнатального развития. Более высокая активность найдена в головном мозге растущих животных и для ферментов неокислительной части пентозофосфатного пути: трансальдолазы, тракскетолазы, фосфопентоизомеразы и др. Все эти данные свидетельствуют о том, что такой путь метаболизма глюкозо-6-фосфата играет в развивающейся нервной ткани большую роль, чем в окончательно сформировавшемся мозге взрослых животных.
Определение скорости ПФП в экспериментах с глюкозой, содержащей С в положении «1» или «6», позволило рассчитать, что в мозге растущих животных в ПФП используется до 10–15% поступающей в мозг глюкозы, в то время как в мозге взрослых животных – лишь 2–3%.
В ходе окончательной дифференцировки и созревания структур головного мозга у новорожденных и молодых животных особенно интенсивно протекают процессы синтеза специфических липидов, в частности липидов миелиновых оболочек. Заканчивается деление и пролиферация различных типов нервных клеток. Такие морфологические изменения в ходе созревания мозга требуют повышенного образования восстановительных эквивалентов для реакций биосинтеза липидов, а также фосфопентоз как предшественников нуклеиновых кислот. Именно эти потребности покрываются за счет реакций ПФП. После окончания процессов миелинизации и пролиферации нервной ткани интенсивность этого пути метаболизма глюкозо-6-фосфата в головном мозге заметно снижается. Напротив, в ряде других тканей, где у взрослых животных идут интенсивные процессы липогенеза, относительная доля ПФП среди реакций метаболизма глюкозо-6-фосфата постепенно возрастает.
Сопоставление активности ферментов пентозофосфатного пути в различных типах клеток взрослого мозга позволило сделать вывод о разной его интенсивности в нейронах и нейроглии. Гистохимическими методами, а также при прямом определении в нейроглии в отличие от нейронов найдены более высокие значения активности глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, транскетолазы и других энзимов ПФП. Таким образом, в нейроглии пентозофосфатный путь является существенным путем метаболизма глюкозо-6-фосфата, в то время как в нейронах доминирует аэробный гликолиз, сопряженный с последующими реакциями цикла трикарбоновых кислот.
Фосфофруктокиназная реакция. Как уже упоминалось, основная масса глюкозо-6-фосфата в головном мозге используется в реакциях аэробного гликолиза. Важнейшим этапом гликолитической цепи, с точки зрения возможности контроля над скоростью гликолиза, является фосфофруктокиназная реакция. Активность фосфофруктокиназы в головном мозге и многих других тканях заметно ниже активности остальных ферментов гликолиза, в силу чего эта реакция может лимитировать общую скорость потока метаболитов по гликолитической цепи.
В отличие от гексокиназы запас каталитической мощности фосфофруктокиназы относительно невелик; увеличение активности этого фермента под действием кинетических регуляторных механизмов происходит в ограниченных пределах. Поэтому при ряде экстремальных воздействий скорость потока метаболитов по гликолитической цепи ограничивается именно на реакции фосфорилирования фруктозо-6-фосфата.
Фосфофруктокиназа имеет тетрамерную субъединичную структуру и состоит из комбинаций протомеров: мышечной, печеночной и мозговой или тромбоцитарной форм.
В головном мозге, как и в других тканях, в регуляции скорости фосфорилирования фруктозо-6-фосфата принимают участие одновременно несколько механизмов, однако их относительная роль в том, или ином органе различна. Фосфофруктокиназа представляет собой поливалентный аллостерический фермент активность которого подавляется АТФ и цитратом и стимулируется АДФ. Действие этих основных регуляторных факторов дополняется другими. В частности, АМФ и неорганический фосфат снимают ингибирующее действие АТФ; аналогичным образом влияет продукт реакции – фруктозодифосфат.
Изоферменты фосфофруктокиназы отличаются по чувствительности к регуляторным факторам: B-форма наиболее, а М-форма наименее чувствительна к ингибированию АТФ; В-форма сильно активируется фруктозодифосфатном, в то время как М-форма почти не активируется. Определенную роль в регуляции активности фермента в мозге играет кальмодулинзависимое фосфор илирование; в последние годы установлено участие в этом процессе нейроспецифического белка S-100.
Таким образом, рост отношения АТФ/АДФ как аллостерических эффекторов и компонентов цикла фосфорилирования – дефосфорилирования фермента приводит к снижению фосфофруктокиназной активности, а уменьшение отношения АТФ/ АДФ, напротив, повышает скорость реакции. По-видимому, этот механизм регуляции является ведущим в системе множественного контроля над активностью фосфофруктокиназы в головном мозге.
Необходимо подчеркнуть, что отношение АТФ/АДФ одновременно с фосфофруктокиназой контролирует и активность гексокиназы, причем направленность изменений – стимуляция или ингибирование – одинакова для обеих киназ. Это дало основание У. Лоури и соавторам рассматривать гексокиназу и фосфофруктокиназу в мозге как единый функциональный комплекс.
Двойной контроль над активностью важнейших энзимов гликолиза со стороны компонентов энергетического обмена является характерной особенностью головного мозга. Наличие синхронной регуляции одним и тем же фактором активности двух ведущих ферментов гликолитической цепи позволяет быстро и эффективно изменять скорость окисления глюкозы в клетках головного мозга в зависимости от изменений энергетического баланса.
Еще один механизм контроля над активностью фосфофруктокиназы, а именно – ингибирование фермента цитратом, в головном мозге играет, по всей вероятности, значительно меньшую роль, чем в других тканях. Это может быть обусловлено особенностями метаболизма лимонной кислоты в мозге.
Как известно, основным источником цитрата в мозге служит ацетилКоА, образующийся при окислительном декарбоксилировании пирувата. В то же время в других тканях значительные количества ацетилКоА для синтеза цитрата образуются при окислении жирных кислот, т.е. имеет место конкуренция между гликолизом и липолизом. Кроме того, в головном мозге взрослых животных лимонная кислота быстро окисляется в том же компартменте, где синтезируется, – в митохондриях, в силу чего концентрация этого метаболита в цитоплазме обычно не достигает значений, близких к К фосфофруктокиназы.
Конечные этапы гликолиза в головном мозге. Реакции, следующие за образованием фрустозо – 1,6 – дифосфата, в головном мозге катализируются ферментами, активность которых достаточно высока и в 5–10 раз превышает активность гексокиназы и фосфофруктокиназы. Поэтому ни скорость расщеплення фруктозо– 1,6–дифосфата, ни последующие этапы превращения фосфотриоз обычно не лимитируют общую скорость аэробного гликолиза в мозговой ткани.
Рассматривая ферментативные превращения фосфотриоз, необходимо отметить характерную для нервной ткани локализацию изоферментов енолазы. В глиальных клетках обнаружен гомодимер аос, идентичный енолазе печени, в то время как изоформа встречается только в нейронах. Установлена идентичность нейрональной формы енолазы и нейроспецифического кислого белка 14–3–2, описанного Б. Муром.
Как уже указывалось, в отличие от многих органов с интенсивным липолизом или интенсивно протекающим пентозофосфатным циклом в мозге взрослых животных дополнительный поток в пул метаболитов гликолиза трехуглеродных фрагментов имеет весьма ограниченное значение. Результаты экспериментов с различными предшественниками показывают, что на долю промежуточных компонентов гликолиза, образовавшихся из С-глицерата, в мозге приходится не более 2–5%. Это еще раз показывает важность для метаболизма головного мозга гексокиназной реакции, которая служит основным путем ввода углеродных компонентов в гликолитическую цепь.
Конечным продуктом аэробного гликолиза является пировиноградная кислота, основные пути метаболизма которой приведены на схеме 3. Рассматривая их, необходимо учитывать, что цитоплазматический пируват с помощью протонзависимой переносящей системы легко проникает через митохондриальные мембраны и включается в метаболические превращения в обоих клеточных компартментах.
Что касается реакций образования пирувата из аминокислот серина, глицина, треонина, цистина и цистеина, протекающих в цитоплазме, то они наиболее интенсивно осуществляются в печени и почках. В головном мозге они играют весьма малую роль в пополнении пула пирувата из-за низкой активности ферментов и очень плохой проницаемости ГЭБ для этих аминокислот.
Три реакции связывают пируват с ЦТК: пируеатдегидрогеназная, пируваткарбоксилазная и НАДФ-малатдегидрогеназная; если две первые протекают исключительно в митохондриях, то реакция, катализируемая НАДФ-малатдегидрогеназой, так называемым «маликэнзимом», протекает как в митохондриях, так и в цитоплазме. Основным путем включения углеродного скелета пировиноградной кислоты в ЦТК в мозге служит пируватдегидрогеназная реакция, тогда как в других тканях – печени, сердечной и скелетных мышцах, почках и др. – большее значение имеют реакции карбоксилирования пирувата, в первую очередь пируваткарбоксилазная реакция.
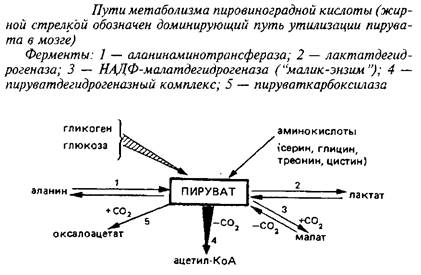
Легко обратимая аланинаминотрансферазная реакция протекает в митохондриальном и цитоплазматическом компартментах; в связи с тем, что активность соответствующего фермента невелика, эта реакция играет относительно небольшую роль в метаболизме пирувата в мозге. Эксперименты с С-предшественниками позволили рассчитать, что лишь около 2% пирувата превращается в аланин в физиологических условиях.
Однако участие в трансаминировании двух важнейших метаболитов нервной ткани – глутамата и а-кетоглутарата – заставило исследователей более внимательно изучить этот минорный путь метаболизма пирувата. Высказано предположение, что иитоплазматическая АлАТ может участвовать в регуляции конечных этапов гликолиза и утилизации глутамата.
Среди конечных этапов гликолиза и реакций, в которых участвует пировиноградная кислота, определенный интерес представляет лакташдегидрогеназная реакция. Подавляющая доля лактатдегидрогеназы в большинстве тканей связана с цитоплазмой. Однако в головном мозге до 10% от общей лактатдегидрогеназной активности клеток обнаруживается в митохондриях. В других тканях митохондриальной лактатдегидрогеназы значительно меньше; в печени, например, менее 1%. Предполагается, что это способствует более полному использованию конечных продуктов гликолиза в митохондриях.
ЛДГ и ее изозимы неравномерно распределяются между основными типами клеток мозга. Общая активность ЛДГ при расчете на 1 мг белка в глиальных клетках выше, чем в нейронах. На обогащенных фракциях и на культурах клеток показано преобладание «анаэробного» изофермента ДДГ5 в глиальных клетках, в то время как для нейронов характерен «аэробный» изофермент ЯДГу Эти наблюдения, а также данные о меньшей скорости поглощения кислорода глиальными клетками по сравнению с нейронами хорошо согласуются со сделанным Х. Хиденом заключением о том, что нейронам свойственен аэробный обмен, тогда как метаболизм нейроглии адаптирован и к анаэробным условиям.
ЛДГ-реакция служит практически единственным путем метаболизма молочной кислоты в тканях животных, и лактат поэтому можно рассматривать как резервный фонд пирувата. Высокая активность ЛДГ, легкая обратимость этой окислительно-восстановительной реакции определяют ее важную роль в поддержании red-oxсостояния пиридиновых нуклеотидов в клетке, в обеспечении динамического равновесия в системе пируватлактат.
Пировиноградная кислота, образующаяся в мозге в ходе реакций гликолиза, интенсивно используется для дальнейших метаболических превращений. Наглядно свидетельствует об этом сопоставление данных о скорости утилизации мозгом глюкозы и пирувата. Так, в экспериментах на белых крысах установлено, что скорость утилизации глюкозы составляет 0,65–0,70 мкмоль/мин», а пирувата – 1,30–1,40 мкмоль/мин» в расчете на 1 г ткани. Для сравнения можно указать, что скорость утилизации пирувата в печени заметно ниже и равна в среднем 0,35–0,40 мкмоль/мин» на 1 г ткани.
Представление о соотношении активностей ферментов, катализирующих основные пути метаболизма пирувата в митохондриях тканей крыс, дают результаты, приведенные в табл. 3.
Оценивая относительное значение каждого из основных метаболических превращений, в которых участвует пировиноградная кислота, необходимо подчеркнуть важную роль именно пируватдегидрогеназной реакции. Активность остальных ферментов, конкурирующих за пируват в митохондриях и вовлекающих этот субстрат в дальнейшие метаболические превращения, значительно ниже.
Таблица 3. Активность ферментов, участвующих в метаболизме пировиноградной кислоты в митохондриях головного мозга, печени и сердце крыс
| Ферменты | Кора больших полушарий головного мозга | Печень | Сердце |
| Пируватдегвдрогеназа | 752±40 | 405±56 | 544±43 |
| Пируваткарбоксил аза | 160+21 | 530±45 | 485±37 |
| Лактатдегидрогеназа | 480±35 | 170±9 | 104±19 |
| Аланинаминотрансфераза | 71±5 | 383±29 | 784±31 |
| НАДФ-малатдегидрогеназа | 85±7 | 78±4 | 9Ш1 |
Суммируя приведенные сведения, необходимо еще раз подчеркнуть следующие специфические для мозга особенности реакций гликолиза и их регуляции invivo:
1. особую важность для энергетического метаболизма мозга гексокиназной реакции как основного пути ввода окисляемых субстратов в гликолитическую цепь;
2. однонаправленную и синхронную регуляцию адениновыми нуклеотидами скорости наиболее медленных этапов гликолиза – гексокиназной и фосфофруктокиназной реакций, что позволяет объединить эти два фермента в единый функциональный комплекс;
3. специфическую для мозга внутриклеточную локализацию лактатдегидрогеназы не только в цитоплазме, но и в митохондриях, что дает возможность более полно использовать лактат и пируват в дальнейших превращениях в митохондриях.
5. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ И МЕХАНИЗМЫ, КОНТРОЛИРУЮЩИЕ ЕГО СКОРОСТЬ В МОЗГЕ
Цикл трикарбоновых кислот является универсальным окислительным механизмом клетки. Он представляет собой сложную амфиболическую систему, имеет несколько возможных путей ввода окисляемых метаболитов и оттока отдельных продуктов реакций, основные из которых представлены на схеме 4.
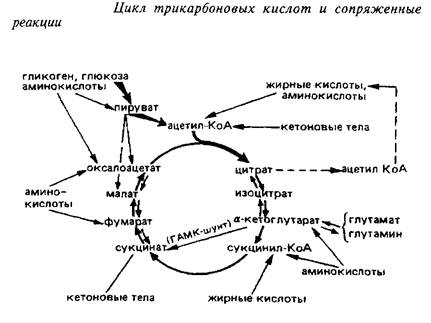
Пути пополнения пула метаболитов ЦТК в мозге
Источники образования ацетил-КоА. Важнейшим соединением, за счет которого постоянно пополняется пул компонентов ЦТК в большинстве тканей, служит ацетил-КоА – один из субстратов цитратсинтазной реакции. Это вещество может образовываться в целом ряде метаболических превращений. В митохондриях головного мозга основным поставщиком ацетилКоА для окисления его в ЦТК служит реакция окислительного декарбоксилирования пировиноградной кислоты под действием пируватдегидрогеназного комплекса.
В головном мозге взрослых животных до 80–90% пирувата подвергается окислительному декарбоксилированию с последующим окислением образующегося ацетил-КоА в ЦТК. В печени в этой реакции используется не более 15–20% субстрата, но активно функционирует другой механизм ввода пировиноградной кислоты в ЦТК – карбоксилирование ее под действием пируваткарбоксилазы до щавелевоуксусной кислоты.
Важным является и то, что в митохондриях головного мозга при самых разнообразных воздействиях сохраняется доминирование пируватдегидрогеназной реакции над остальными путями метаболизма пирувата, несмотря на то, что скорость отдельных реакций обмена субстрата может меняться. Например, было показано явное преобладание окислительного декарбоксилирования пировиноградной кислоты при таких экстремальных состояниях, резко нарушающих энергетический баланс, как гипоксия, разобщение окислительного фосфорилирования, тяжелая форма гипертиреоза.
Напротив, в митохондриях печени, сердечной и скелетных мышц, почках и других органах при изменении функционального состояния, при метаболических сдвигах разной природы преобладающим может стать любой из основных путей метаболизма пирувата. Например, в митохондриях печени в условиях интенсивного глюконеогенеза или при голодании скорость реакции карбоксилирования пирувата в 5–10 раз и более превышает скорость ПДГ-реакции.
Таким образом, окислительное декарбоксилирование пировиноградной кислоты, осуществляющее ввод этого метаболита в ЦТК, играет в головном мозге особо важную роль.
Большое значение ПДГ-реакции для метаболизма нервной ткани подтверждается также более высокой по сравнению с другими тканями чувствительностью ее к недостатку тиамина. Нарушение образования тиаминпирофосфата при В у-авитаминозе вызывает значительное угнетение окислительного декарбоксилирования пирувата, особенно резко проявляющееся в головном мозге и приводящее к нарушениям его функциональной активности.
Регуляция активности сложного мультиэнзимного пируватдегидрогеназного комплекса осуществляется несколькими путями. В настоящее время наиболее детально исследован механизм ковалентной химической модификации фермента. Этот механизм включает АТФ-зависимое фосфорилирование с помощью ПДГ-киназы, приводящее к образованию неактивного комплекса, и дефосфорилирование, катализируемое специфической фосфатазой, которое приводит, напротив, к образованию активной формы комплекса. Реакциям фосфорилирования-дефосфорилирования подвергается лишь один из компонентов ПДГкомплекса, а именно пируватдекарбоксилаза.
Фосфатазная реакция, т.е. активирование ПДГ-комплекса, стимулируется высокими концентрациями ионов Mg+ , низкими – Са». Реакция фосфорилирования, т.е. инактинация ПДГ-комплекса, усиливается в присутствии высоких концентраций АТФ и ионов магния, но тормозится при возрастании уровня АДФ, который конкурирует в реакции с АТФ, т.е. важным фактором в регуляции взаимопревращений активной инеактивной форм ЦДХ-комплекса является внутримитохондриальное отношение АТФ/АДФ.
Во многих тканях это отношение сильно зависит от функционального состояния и прежде всего от типа преимущественного субстрата окисления. Например, в печени, почках, сердечной мышце при усилении окисления свободных жирных кислот резко возрастает уровень длинноцепочечных ацил КоА. Эти соединения нарушают перенос АТФ и АДФ через митохондриалъные мембраны с помощью адениннуклеотидтранслоказы, что приводит к повышению интрамитохондриального отношения АТФ/АДФ. В свою очередь, это способствует образованию неактивной фосфорилированной формы ПДГ-комплекса. Так, по данным П. Виланда и соавторов, после 24-часового голодания доля активной формы ПДГ в 2,5–5 раз снижалась во всех тканях крыс, кроме головного мозга, где она оставалась практически неизменной.
Большое значение ПДГ-реакции в обеспечении энергетического обмена в мозге, а также то, что максимальная активность ПДГ-комплекса лишь немногим выше средней скорости потока пирувата в мозге взрослого интактного животного, указывает на существование в нервной ткани тонкой и эффективной системы регуляции ПДГ-комплекса. Установлено, что доля активной дефосфорилированной формы ПДГ в мозге значительно выше, чем во многих других тканях: в мозге активная форма составляет около 70% от общей активности фермента в ткани; в сердие – 40–60, в печени, жировой ткани – около 20%.
Недавно высказана гипотеза о том, что регуляция фосфорилирования ПДГ-комплекса играет существенную роль в модуляции пластичности синапсов, поскольку обнаружена тесная корреляция между степенью фосфорилирования ПДГ и процессами тренировки и обучения.
Значительный вклад в регуляцию скорости окислительного декарбоксилирования пирувата вносят изменения концентрации конечных продуктов реакции – ацетил-КоА и НАДН, накопление которых в митохондриях ведет к торможению ПДГ-реакции Следует отметить, что действие этих факторов
8-09-2015, 23:20
