АцетилКоА и НАДН являются конкурентными ингибиторами фермента по отношению к свободному КоА или НАД+ соответственно. Наряду с этим оба метаболита служат положительными эффекторами ПДГ-киназы, катализирующей переход фермента в неактивную фосфорилированную форму.
Относительная роль этих факторов в регуляции ПДГ-реак-ции в мозге неодинакова. Концентрация НАДН, а точнее – отношение НАД+ /НАДН является весьма лабильной величиной, особенно в митохондриях тканей с высокой интенсивностью окислительно-восстановительных процессов. Поэтому этот фактор участвует в контролировании скорости ПДГ-реакции как в головном мозге, так и в других тканях. Напротив, регуляторная роль другого продукта реакции – ацетилКоА – в головном мозге меньше, чем в других тканях, которые способны к окислению больших количеств свободных жирных кислот и, следовательно, к значительным изменениям в концентрации ацетилКоА.
Таким образом, в митохондриях головного мозга доминирующий путь метаболизма пировиноградной кислоты – окислительное декарбоксилирование – контролируются главным образом изменением отношения АТФ/АДФ и НАД+ /НАДН в митохондриях. Опыты с 2С-пируватом показали, что скорость использования образующегося в ПДГ-реакции ацетилКоА для синтеза цитрата в головном мозге в 3,0–4,5 раза выше, чем в печени, почках и сердце.
Свободные жирные кислоты и кетоновые тела как источники ацетилКоА в мозге. Образование ацетилКоА для цитратсинтазной реакции может происходить также в реакциях окисления свободных жирных кислот или кетоновых тел, а также в ходе метаболических превращений ряда аминокислот. Однако оба эти пути пополнения фондов ацетилКоА, имеющие большое значение для многих тканей, в мозге взрослых животных играют весьма скромную роль.
Например, в экспериментах с С глюкозой и, С пальмитиновой кислотой, выполненных на срезах мозга кролика, установлено, что до С02 и Н2 0 окисляется 385±15 нмоль глюкозы и лишь 0,02–0.04 нмоль жирной кислоты в расчете на I г ткани за 1 ч. Такая колоссальная разница в скорости утилизации двух энергетических субстратов объясняется низкой активностью ферментов, лимитирующих окисление свободные жирных кислот в мозге взрослых животных, в первую очередь – низкой активностью апилКоА-синтазы.
Напротив, в головном мозге растущих животных свободные жирные кислоты и особенно кетоновые тела окисляются гораздо интенсивнее, чем у взрослых. Это обусловлено несколькими факторами. Во-первых, более высокой концентрацией кетоновых тел в крови в неонатальный период, когда животное получает в основном молочную пищу. Во-вторых, с возрастом, по мере формирования гематоэнцефалического барьера, уменьшается скорость поглощения мозгом кетоновых тел из крови. Так, при одинаковой концентрации кетоновых тел в крови артериовенозная разница для мозга 16–20-дневных крысят в 3–4 раза выше, чем у взрослых.
Еще одним важным обстоятельством, обусловливающим более интенсивное использование кетоновых тел мозгом растущих животных, является высокая активность ферментов, лимитирующих скорость этого процесса: 3-р-окси-бутиратдегидрогеназы, КоА-трансферазы р-кислот и ацетоадетил – КоА-тиолазы Активность первых двух энзимов обнаруживается в мозте уже при рождении, достигает максимума к 20–25-му дню, а затем резко снижается. У 20–25-дневных крыс активность этих ферментов в 2–3 раза выше, чем у взрослых животных. Аналогичный характер имеют возрастные изменения активности митохондриальной формы ацетоацетил-КоА-тиолазы. Однако общая активность фермента в нервных клетках наиболее высока у новорожденных животных, а затем постепенно снижается. Ранняя постнатальная индукция «ключевых» ферментов метаболизма кетоновых тел контрастирует со значительно более медленным возрастанием активности лимитирующих ферментов гликолиза, ЦТК, а также пируватдегидрогеназного комплекса. Из-за значительного преобладания активности ацетилКоА-тиолазы над активностью ПДГ в мозге растущих животных ацетилирование свободного TCoA-SH происходит главным образом в тиолазной реакции а у взрослых – в пируватдегидрогеназ-ной.
В головном мозге растущих животных ацетилКоА, образующийся в ходе метаболизма кетоновых тел, расходуется не только на окисление в ЦТК, но в значительной мере идет на процессы биосинтеза специфических липидов мозга. Интенсивное окисление кетоновых тел характерно именно для периода миелинизации, роста аксонов и дендритов и образования функциональных синаптических комплексов.
Использование кетоновых тел в качестве источника ацетилКоА, но уже не для биосинтетических реакций, а для окисления в ЦТК, т.е. в виде энергетических субстратов, возможно и в мозге взрослых животных при ряде экстремальных состояний; в частности, это имеет место при длительном голодании, когда на фоне исчерпания углеводных ресурсов организма резко возрастает концентрация кетоновых тел в крови за счет распада и окисления липидов из жировых депо. Аналогичные ситуации наблюдаются также при тяжелых формах диабета или гипертиреоза. Но даже в этих условиях за счет окисления свободных жирных кислот и кетоновых тел покрывается не более 20% энергетических потребностей мозга.
Аминокислоты как источники ацетилКоА. Реакции превращения свободных аминокислот, ведущие к образованию ацетилКоА, у взрослых животных наиболее интенсивно протекают в печени и почках, где они могут эффективно пополнять пул этого метаболита. В головном мозге роль такого пути образования ацетилКоА весьма незначительна.
Превращения этих аминокислот, а также кетоновых тел в мозге взрослых животных сосредоточены главным образом в «малом» компартменте, где особенно ярко проявляется анаболическая функция ЦТК. Морфологически этот компартмент приурочен к глиальным клеткам. Напротив, катаболическая, энергетическая функция ЦТК наиболее четко проявляется в «большом» компартменте мозга, где интенсивно протекают реакции аэробного окисления глюкозы.
Скорости метаболических потоков для мозга мышей составляют: 1,25 мкмоль субстрата или 0,30 мкмоль субстрата за 1 мин в расчете на 1 г сырой массы ткани для «большого» и «малого» компартментов соответственно. Обмен метаболитов между компартментами осуществляется относительно медленно; скорость потока в данном случае составляет в среднем 0,14 мкмоль субстрата/ мин в расчете на 1 г ткани.
Использование аминокислот в качестве предшественников компонентов ЦТК Свободные аминокислоты, а также аминокислоты, образующиеся при расщеплении белков, могут претерпевать окисление и превращения их в различные компоненты ЦТК Как известно, существует несколько путей вхождения аминокислот в ЦТК, причем относительная роль их в пополнении пула метаболитов UTK различна в разных тканях.
Наиболее интенсивно метаболизм аминокислот протекает в печени, где эти соединения играют значительную роль в энергетическом обмене. В мозге взрослых животных свободные аминокислоты, плохо проникающие через ГЭБ, не могут рассматриваться как важные энергетические источники. Исключение в этом отношении составляют аминокислоты глутаминовой группы. Для головного мозга характерны высокое содержание аминокислот этой группы и значительная активность ферментов их обмена в митохондриях.
Активность аспартатаминотрансферазы в митохондриях мозга взрослых крыс составляет в среднем 30–35 мкмоль субстра-тамин- в расчете на 1 г ткани, что в 7–10 раз превышает активность фермента в мозге новорожденных животных и значительно выше, чем в митохондриях печени. Высокая активность трансамисназ и глутаматдегидрогеназы в митохондриях головного мозга, а также результаты опытов с С-аминокислотами указывают на возможность использования аминокислот этой группы в качестве дополнительного энергетического источника, что особенно важно при различных экстремальных состояниях, когда повышаются энергетические потребности мозга или замедляется поступление в мозг глюкозы.
Таблица 4. Средние данные о содержании аминокислот глутаминовой группы в головном мозге и печени крыс
| Аминокислоты | Содержание в целой ткани» мкмоль/г | Содержание в обогащенных фракциях коры больших полушарий мозга, нмоль/г белка | ||
| мозг | печень | нейроны | нейроглия | |
| Глутаминовая кислота | 7,3–9,5 | 1,5–1,7 | 14,2±2Д | 23,0±2,9 |
| Глутамин | 3,8–4,7 | 1,8–2,3 | 6,9±1,4 | 4,8±0,6 |
| Аспарагиновая кислота + аспарагин | 4,8–5,8 | 0,4–0,7 | 6,0±1,5 | 6,3±0,8 |
| ГАМ К | 1,9–2,4 | Следы | 3,1 + 1,1 | 4,1±0,4 |
Из других путей метаболизма аминокислот, которые играют относительно небольшую роль в энергетическом метаболизме головного мозга, можно упомянуть превращение аспартата и аспарагина в оксалоацетат, а также аланина и серина – в пируват. Очень невелико и значение аминокислот как предшественников компонентов ЦТК – суклинил-KoA и фумарата.
Итак, основным путем ввода окисляемых субстратов в ЦТК в головном мозге служит образование ацетилКоА в пируватдегидрогеназной реакции. Дополнительным источником для пополнения пула метаболитов ЦТК могут быть аминокислоты глутаминовой группы, в то время как кетоновые тела и свободные жирные кислоты интенсивно окисляются лишь в мозге растущих животных.
Промежуточные компоненты ЦТК для разнообразных синтетических реакций в мозге в отличие от других тканей используются в незначительных количествах. Именно этим объясняется, что интенсивность потока метаболитов через ЦТК в головном мозге прямо пропорциональна потреблению кислорода тканью.
При рассмотрении особенностей регуляции ЦТК в головном мозге прежде всего следует остановить внимание на тех его неравновесных стадиях, которые являются лимитирующими. В табл. 5,5 приведены значения активностей ферментов ЦТК
Таблица 5. Содержание основных компонентов и активность ферментов ЦТК в головном мозге и печени крыс
| Компоненты ЦТК | Содержание, мкмоль/г ткани | Ферменты ЦТК | Активность ферментов в митохондриях, мкмоль субстрата • мг белка за 1 мин | ||
| мозг | печень | мозг | печень | ||
| Ацетил-КоА* | 11,0±0,9 | 4,0–5,0 | Цитратсинтаза | 8,210,3 | 6,410,3 |
| Оксалоацетат | 7,4910,35 | 9,01±0,40 | |||
| Цитрат | 320±12 | 228±9 | Аконитаза** | 46,013,1 | – |
| Изоцитрат | 27,313,5 | 24,013,0 | НАД- изоцитратдегидрогеназа | 28,312,2 | 5,610,4 |
| НАДФ-изоцитратдегидрогеназа | 19,611,5 | 32,012,4 | |||
| а – Кетоглутарат | 125±10 | 114±9 | а – Кетоглутаратдегидрогенеза |
58,913,7 | 64,514,9 |
| Сукцинат | 791±26 | 804±24 | Сукцинатдегидрогеназа | 106,0115,7 | 145,2120,1 |
| Фумарат | – | – | Фумараза | – | – |
| Малат | 356121 | 420128 | НАД-малатдегидрогеназа | 407,0135,5 | 385,0140,2 |
содержание основных компонентов ЦТК в головном мозге печени крыс. Видно, что к наиболее медленным этапам, которые могут лимитировать скорость потока субстратов через цикл в мозге, как и в других тканях, относятся реакции синтеза и окисления цитрата.
5.2 Цитратсинтазная реакция и регуляция ее скорости в мозге
Скорость необратимой в физиологических условиях реакции биосинтеза лимонной кислоты находится под контролем нескольких одновременно действующих факторов. В опытах с очищенными ферментативными препаратами найдено, что АТФ является отрицательным аллостерическим модулятором цитратсин-тазы. Эффект нуклеотида обусловлен повышением константы Миха-элиса фермента для ацетилКоА.
Субстраты реакции – ацетилКоА и оксалоацетат также участвуют в регуляции активности цитратсинтазы. На основании сопоставления значений констант Михаэлиса, установленных в опытах на очищенных препаратах ферментов и реально существующих в тканях животных концентраций этих метаболитов, Кребс пришел к выводу, что invivoосновным из этих двух регуляторных факторов является концентрация щавелевоуксусной кислоты.
Таким образом, invivoскорость цитратсинтазной реакции контролируется главным образом двумя факторами: концентрацией отрицательного аллостерического фактора фермента – АТФ и концентрацией щавелевоуксусной кислоты.
Цитратсинтазная реакция является не только важнейшим этапом ЦТК, но и компонентом системы образования ацетилхолина в холинергических нейронах. Вместе с ПДГ и цитратлиазой она обеспечивает поставку ацетил-КоА для биосинтеза нейротранс-миттера. О большом значении этой функции цитратсинтазы в мозге говорят наблюдения о том, что даже незначительные изменения активности фермента, еще не вызывающие сдвигов в энергетическом обмене, приводят к существенным нарушениям в синтезе ацетилхолина и блокируют холинергическую передачу.
5.3 Изоцитратдегидрогеназные реакции и их регуляция в мозге
Основным путем метаболизма лимонной кислоты является окисление ее в изоцитратдегидрогеназных реакциях после превращения ее под действием аконитазы в изолимонную кислоту. Активность аконитазы значительно превышает активность как цитратсинтазы, так и изоцитратдегидрогеназ и не лимитирует скорость взаимопревращения трикарбоновых кислот. В головном мозге взрослых животных до 98% нитрата подвергается дальнейшему окислению и лишь около 2% расщепляется в цитратлиазной реакции до ацетилКоА и щавелевоуксусной кислоты. В других тканях доля лимонной кислоты, подвергающаяся расшеплению цитратлиазой, может быть в несколько раз выше.
Окисление изолимонной кислоты осуществляется двумя типами изоцитратдегидрогеназ:
1. НАД-зависимым ферментом, который катализирует необратимую реакцию, протекающую исключительно в митохондриях;
2. НАДФ-специфичным ферментом, катализирующим обратимую реакцию как в митохондриях, так и в цитоплазме.
Роль НАД- и НАДФ-зависимых изоцитратдегидрогеназ в окислении изолимонной кислоты далеко не одинаково. В головном мозге основная часть субстрата окисляется по НАД-зависимому пути, поставляющему НАДН непосредственно в дыхательную цепь митохондрий и таким образом тесно связанному с поддержанием энергетического баланса клеток. Напротив, в печени, сердце и других тканях с помощью НАД-зависимой ИЦЦГ окисляется менее 10% изоцитрата, а основная масса субстрата используется в НАДФ-ИЦЦГ реакциях, особенно интенсивно протекающих в цитоплазме, где образующийся НАДФН может быть использован для разнообразных восстановительных биосинтезов.
Интересно, что явное преобладание НАД-зависимого пути окисления изолимонной кислоты в митохондриях характерно лишь для мозга взрослых животных. В то же время у растущих животных в период интенсивного липогенеза, связанного с процессами миелинизации, значительная часть изоцитрата окисляется в НАДФ-ИЦДГ-реакции и может служить источником НАДФН для биосинтеза специфических липидов мозга.
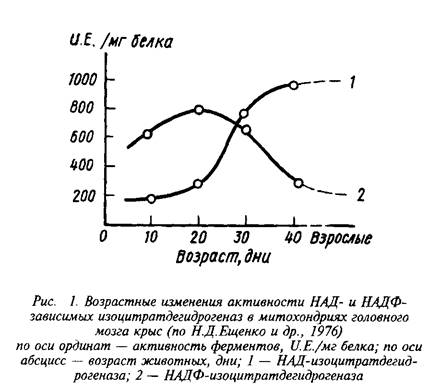
Регуляция скорости окисления изолимонной кислоты осуществляется главным образом за счет изменения активности НАД-специфичной дегидрогеназы.
В отличие от НАДФ-ИЦДГ НАД-зависимый фермент относится к числу регулируемых; положительным аллостерическим фактором служит АДФ, а АТФ, напротив, ингибирует фермент. Эффект АДФ обусловлен конформационными изменениями фермента, в результате чего возрастает в 3–10 раз его сродство к субстрату. Одновременно происходит сдвиг оптимума рН в щелочную сторону, т.е. эффектор стабилизирует НАД-ИЦДГ, обеспечивая высокую каталитическую активность в достаточно широком диапазоне рН. Установлено также, что АДФ вызывает агрегацию молекул фермента с образованием надмолекулярных форм.
Необходимо подчеркнуть, что эффективность адениннуклеотидного контроля активности НАД-ИЦДГ определяется не столько абсолютными концентрациями АТФ, АДФ и АМФ, сколько соотношением высоко- и низкоэнергетических компонентов адениннуклеотидной системы. В значительной степени эффективность адениннуклеотидного контроля НАД-ИЦДГ-реакции зависит от интрамитохондриальной концентрации ионов Са+ , которые изменяют Км фермента для изоцитрата. Установлено, что низкие концентрации Са+ , фумаразы, малатдегидрогеназы в мозге, как и в других тканях, превышает активность ферментов начальных стадий цикла и, следовательно, не ограничивает общую скорость цикла. Расчеты, выполненные на аналоговых вычислительных машинах, показывают, например, что на поддержание средней скорости потока метаболитов через ЦТК расходуется лишь 2–5% максимальной активности малатдегидрогеназы и около 15–20% активности сукцинатдегидрогеназы. Напротив, скорость потока метаболитов через ЦТК требует почти максимальной активности цитратсинтазы и НАД-изоцитратдегидрогеназы.
Заканчивая рассмотрение реакций ЦТК и особенностей их регуляции в головном мозге, следует кратко остановиться на значении сукцинатдегидрогеназной реакции. В отличие от других дегидрогеназ ЦТК сукцинатдегидрогеназа относится к флавин-зависимым ферментам. Она играет особую роль в энергетическом метаболизме при экстремальных состояниях, прежде всего таких, которые сопровождаются нарушениями на пиридин-нуклеотидном участке дыхательной цепи, например при облучении. При гипоксии, когда нарушается отношение между окисленными и восстановленными формами пиридиннуклеотидов, и в силу накопления НАДН возможно обращение конечных этапов ЦТК, окисление янтарной кислоты под действием сукцинатдегидрогеназы также приобретает большое значение для поддержания энергетического баланса ткани.
Из приведенных данных можно сделать вывод о следующих характерных для головного мозга особенностях в функционировании и регуляции ЦТК:
1) активность ферментов, катализирующих наиболее медленные этапы ЦТК – цитратсинтазы и НАД-изоцитратдегидроге-назы, в мозге значительно выше, чем во многих других тканях;
2) в головном мозге доминирующим механизмом регуляции скорости окисления изоцитрата является адениннуклеотидный контроль, что связано с преобладанием в митохондриях мозга НАД-зависимого пути окисления этого субстрата;
3) в головном мозге существует единый функциональный комплекс из двух ферментов – цитратсинтазы и НАД-изоцитратдегидрогеназы, обеспечивающий однонаправленное и синхронное изменение скорости наиболее медленных реакций ЦТК в зависимости от энергетических потребностей ткани, в первую очередь – от соотношения компонентов адениннуклеотидной системы;
4) на участке а-кетоглутарат–сукцинат наряду с универсальной для всех тканей последовательностью реакций в мозге возможно шунтирование с образованием в качестве промежуточного продукта биологически активной у-аминомасляной кислоты.
6. КОМПОНЕНТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ МИТОХОНДРИЙ И ИХ СООТНОШЕНИЕ В ГОЛОВНОМ МОЗГЕ
Созревание и окончательная дифференцировка головного мозга животных сопровождается значительной интенсификацией окислительных реакций, при этом происходят интенсивные процессы образования митохондрий. Число митохондрий в расчете на клетку у взрослых крыс вдвое больше, чем у новорожденных. Подсчитано, что нейроны мозга взрослых крыс могут воспроизводить до 2000 митохондрий в день в расчете на клетку, что свидетельствует о быстром обновлении этих важных субклеточных структур.
С возрастом меняется не только общее количество митохондрий, но и локализация их в нервных клетках; больше митохондрий сосредоточивается в областях синоптических окончаний. Анализ ультраструктуры митохондрий с помощью электронного микроскопа показывает, что в зрелом мозге присутствует большее число относительно небольших по диаметру, но удлиненных митохондрий, чем в мозге новорожденных животных. Появление таких митохондрий приурочено к развитию дендритных сплетений.
Наряду с увеличением количества митохондрий в головном мозге с возрастом примерно вдвое повышается содержание основных компонентов дыхательной цепи митохондрий: цитохромов и флавопротеидов.
Накопление компонентов дыхательной цепи митохондрий мозга идет неравномерно: показано медленное нарастание уровня цитохромов в первые 15 дней постнатального развития и более интенсивное в интервале между 15-м и 30-м днями; к концу последнего периода содержание основных переносчиков дыхательной цепи митохондрий близко к уровню, характерному для взрослых животных. Именно период 2-й – 4-й недели развития для крыс связан с интенсивной миелинизацией, завершением развития нейронов, появлением электрической активности коры больших полушарий и двигательных реакций при электростимуляции мозга.
Одним из наиболее важных этапов в функционировании дыхательной цепи митохондрий является передача электронов от цитохрома а3 на кислород. Как известно, это наиболее медленная реакция среди окислительно-восстановительных реакций цитохромов. Активность цитохромоксидазы, как и количество компонентов дыхательной цепи, в головном мозге с возрастом увеличивается примерно вдвое. Активность цитохромоксидазы несколько большая в нейроглиальных клетках, чем в нейронах.
Таблица 6. Содержание основных компонентов дыхательной цепи митохондрий в головном мозге взрослых и растущих кроликов
| Возраст животных, дни | Митохондрии коры больших полушарий | Митохондрии ствола мозга | ||||||||
| флаво-гтро-теиды | цитохромы | флаво-про-теиды | цитохромы | |||||||
| b | а | а3 | с+с 1 | b | а | а з | ||||
| 1 | 0,60 | 0,20 | 0,21 | 0,24 | 0,07 | 1,23 | 0,42 | 0,41 | 0,49 | 0,13 |
| 15 | 0,76 | 0,20 | 0,22 | 0,4:1 | 0,06 | 0,85 | 0,48 | 0,31 | 0,54 | 0,09 |
| 30 | 1,47 | 0,45 | 0,45 | 0,51 | 0,15 | 2,64 | 0,72 | 0,67 | 0,99 | 0,27 |
| Половозрелые | 1,81 | 0,67 | 0,64 | 0,78 | 0,20 | 2,48 | 0,90 | 0,90 | 1,23 | 0,27 |
Последовательность компонентов дыхательной цепи митохондрий и характер их взаимодействия в митохондриях мозга не отличаются от такового в митохондриях любой другой ткани. Как известно, скорость окислительно-восстановительных превращений компонентов дыхательной цепи значительно превышает скорость реакций дегидрирования субстратов, поэтому именно дегидрогеназные реакции определяют в конечном счете интенсивность окисления энергетических субстратов тканью. Этим же объясняется и значение для интенсивности окислительных процессов в ткани отношения активности дегидрогеназ к содержанию основных компонентов дыхательной цепи. Установлено, что в тканях с высокой скоростью окисления соотношение активности ферментов, лимитирующих ЦТК, к содержанию цитохромов а+а3 или цитохрома с обычно превышает такое соотношение для тканей с более низкой интенсивностью окислительных процессов.
Следовательно, существование подобного соотношения в митохондриях головного мозга можно рассматривать как структурную основу, обеспечивающую высокую интенсивность окислительного и энергетического обмена.
7. ФОНД МАКРОЭРГИЧЕСКИХ СОЕДИНЕНИЙ В МОЗГЕ; ИНТЕНСИВНОСТЬ ИХ ОБРАЗОВАНИЯ И ИСПОЛЬЗОВАНИЯ
Высокая скорость
8-09-2015, 23:20
