В целом соотношение адениновых нуклеотидов в тканях мозга и печени примерно одинаково', основной составляющей адениннуклеотидного пула является в обоих тканях АТФ. Однако уровень АДФ и особенно АМФ в мозге значительно ниже, чем в печени. Распределение основных макроэргических соединений примерно одинаково во всех отделах мозга.
Особого внимания заслуживают накопленные в последние десятилетия данные о минорном компоненте адениннуклеотидной системы – циклическом 35'-АМФ. Установлено, что содержание этого биологически важного соединения в головном мозге значительно выше, чем во многих других тканях, уровень цАМФ в мозге составляет в среднем 1–2 нмоль/г, а цГМФ – до 0,2 нмоль/г. Для мозга характерна также и высокая активность ферментов метаболизма циклических нуклеотидов. Очень высокая активность аденилатциклазы и гуанилатциклазы в синаптосомальных мембранах указывает на специфическую роль циклических нуклеотидов в мозге – они участвуют в синоптической передаче.
Важную роль в энергетическом метаболизме мозга играет система креатин-креатинфосфат. Высокое содержание креатина и его фосфорилированного производного, более чем в 2 раза превышающее сумму адениновых нуклеотидов, а также значительная активность креатинкнназы позволяют рассматривать креатин-креатинфосфат как мощную систему стабилизации уровня макроэргичеасих компонентов адениннуклеотидного пула.
В головном мозге до 25–30% активности креатинкиназы связано с митохондриями. Фермент локализован на внешней митохондриальной мембране. Равновесие катализируемой им реакции сдвинуто в сторону образования креатинфосфата в отличие от цитоПлазматической реакции. Вместе с АТФ-АДФ-транс-локазой, находящейся на внутренней мембране. митохондрий, креатинкиназа принимает участие в трансформациях макроэр-гических соединений, а также в переносе их из одного клеточного компартмента в другой.
Таблица 7. Содержание некоторых нуклеотидов, креатина и кратинфосфата в головном мозге и печени крыс, мкмоль/г
| Головной мозг | ||||
| Соединение | средние данные | кора больших полушарий | мозжечок | Печень |
| АТФ | 2,30–2,90 | 2,08 | 2,60 | 2,40–2,80 |
| АДФ | 0,30–0,50 | 0,12 | 0,16 | 0,80–1,00 |
| АМФ | 0,03–0,05 | 0,02 | 0,04 | 0,15–0,30 |
| Значение «энергетического заряда» | 0,850–0,930 | - | - | 0,810–0,870 |
| ГТФ | 0,20–0,30 | 0,29 | 0,39 | 0,19–0,26 |
| ГДФ | 0,15–0,20 | 0,10 | 0,07 | 0,18–0,25 |
| УТФ | 0,17–0,25 | 0,22 | 0,19 | 0,19–0,25 |
| Креатин | 5,50–5,95 | 5,68 | 5,47 | Следы |
| Креатинфосфат | 3,50–4,75 | 3,90 | 4,21 | Следы |
8. ЭНЕРГООБЕСПЕЧЕНИЕ СПЕЦИФИЧЕСКИХ ФУНКЦИЙ НЕРВНОЙ ТКАНИ
Изучение суммарных процессов окисления и образования энергопродукции в мозге представляет собой одну сторону проблемы; другая сторона – выявление специфических процессов в нервной ткани, требующих энергетических затрат. Характеристика этих процессов остается до настоящего времени во многом загадочной.
Еще в ранних работах, выполненных П. Мак-Ильвейном и другими исследователями на изолированных нервах, ганглиях или срезах мозга, установлено, что электростимуляция препаратов сопровождалась усилением потребления кислорода и глюкозы, причем обнаружена прямая зависимость между частотой электрической импульсации и степенью интенсификации окислительных процессов. Электрическое раздражение вызывает резкое и быстрое снижение уровня АТФ, вслед за которым уменьшается содержание креатинфосфата и накапливается неорганический фосфат; после прекращения электростимуляции препаратов в первую очередь восстанавливается уровень АТФ.
Впоследствии аналогичные данные об изменении уровня основных макроэргических соединений при изменении функционального состояния нервной системы были получены invivoв экспериментах с мозгом целостных животных. Показано заметное ускорение расходования АТФ и креатинфосфата при возбуждении – условно-рефлекторном или вызванном фармакологическими препаратами; и, напротив, замедление использования этих соединений при торможении или наркозе. В этих экспериментах на интактных животных установлено, что при усилении энергозатрат в мозге сначала уменьшается уровень запасных энергетических субстратов – креатинфосфата и гликогена и лишь после исчерпания этих источников начинает быстро снижаться уровень АТФ; в период восстановления уровень АТФ первым возвращается к исходным значениям, а затем нормализуется содержание креатинфосфата и гликогена.
В последние годы для исследования интенсивности энергетического метаболизма различных структур мозга широко применяется радиоактивный дериват глюкозы – 2-дезоксиглюкоза; теоретическое обоснование использования этого соединения сделано в лаборатории американского нейрохимика Л. Соколова. Метод основан на том, что дезоксиглюкоза поглощается мозгом и вступает в гексокиназную реакцию со скоростью, прямо пропорциональной скорости использования глюкозы. Однако дальнейшие метаболические превращения дезок-сиглюкозо-6-фосфата в мозге практически не происходят.
Использование С- или дезоксиглюкозы с последующей авторадиографией срезов мозга позволило получить более детальное представление о поглощении глюкозы и интенсивности энергетического метаболизма в самых разных структурах мозга. Была установлена тесная корреляция между интенсивностью энергетического обмена и функциональной активностью определенных структур мозга в экспериментах, где контролем служили аналогичные структуры контрлатерального полушария того же самого животного. Например, обнаружено снижение на 35–60% потребления глюкозы структурами слуховой системы или зрительной системы после соответствующей депривации.
Подобные исследования дают представление лишь об итоговых, балансовых изменениях важнейших компонентов энергетического обмена, оставляя неясными количественные характеристики энергозатрат на специфические процессы, присущие только нервной ткани, интенсивность которых меняется при изменении функционального состояния. К сожалению, в настоящее время нет еще исчерпывающего ответа на один из кардинальных вопросов нейрохимии и нейрофизиологии: какие конкретные биохимические реакции лежат в основе целого ряда функций нервной ткани. Многие стороны этой важной проблемы нуждаются в уточнениях и дальнейших углубленных исследованиях. Некоторые специфические энергозависимые функции нервной ткани и биохимические процессы, лежащие в их основе, в общих чертах суммированы в табл. 8.
Одной из основных функций нервной ткани является передача импульсов от одного нейрона к другому. Толчком к расшифровке взаимосвязи между энергетическим метаболизмом и этой функцией послужили работы А. Ходжкина, установившего, что необходимым условием для прохождения импульсов по нервному волокну служит неравномерное распределение ионов натрия и калия по разным сторонам клеточной мембраны. Поддержание ионной асимметрии, восстановление ее после прохождения нервного импульса связано со значительными энергетическими затратами; прежде всего это относится к транспорту ионов натрия против градиента концентрации в момент перехода потенциала действия в потенштал покоя. Особое значение в этом процессе принадлежит К+ , Na^-стимулируемой АТФазе.
Таблица 8. Основные энергозависимые процессы, лежащие в основе специфических функций нервной ткани
| Функции | Биохимические реакции |
| 1. Проведение нервных импульсов с последующим восстановлением ионной асимметрии | К+ , №+ -АТФазная реакция |
| 2. Поддержание определенной пространственной ориентации и конформа-ции структурных единиц нейрона | Фосфорилирование специфических белков нейрофиламентов и другие реакции |
| 3. Образование синаггтичес-ких структур; функционирование синапсов | Синтез специфических белков, липо- и гликопротеидных комплексов; синтез и метаболизм нейромедиаторов, транспорт, выделение, обратный захват нейромедиаторов |
| 4. Хранение и переработка информации | Синтез специфических белков, нейропеп-тидов, нуклеиновых кислот, липо- и гликопротеидных комплексов |
| 5. Трансмембранный перенос субстратов, нейромедиаторов | Реакции, катализируемые АТФазными системами, транслоказные реакции |
| 6. Аксональный и ретроградный ток | Фосфорилирование специфических белков |
Детально изучены свойства этого важнейшего фермента, определена роль липидов мембран в его активации. Установлено, что активность К+ , фазы в головном мозге заметно выше, чем во многих других тканях, причем максимальная активность фермента обнаружена в коре больших полушарий, меньшая – в коре мозжечка и таламусе, затем – в экстрапирамидальных ядрах; минимальная активность найдена в белом веществе. Активность фермента значительно возрастает в ходе формирования и окончательного созревания мозга; например, у крыс в интервале между 5-м днем до рождения и 60-м днем постнатального развития она увеличивается в 10 раз.
Таким образом, обнаруживается четкий – параллелизм между повышением энергетических потребностей в ходе созревания мозга и увеличением активности фермента, обеспечивающего энергетику усиливающейся импульсавди. Следует добавить, что энергия, требующаяся на прохождение одного нервного импульса в мозге взрослых животных, гораздо выше, чем у новорожденных.
Сопоставление средней частоты прохождения нервных импульсов и объема, требующегося для обеспечения импульсации трансмембранного переноса ионов натрия и калия, со скоростью синтеза макроэргических соединений дает возможность приблизительно оценить затраты энергии на осуществление этой важнейшей функции нервной ткани. По расчетам М.И. Прохоровой, при стационарном состоянии эти затраты составляют около 10–15% от общего количества АТФ, образующегося в мозге за единицу времени; при изменении функционального состояния, особенно при возбуждении, расход АТФ возрастает. В работах других исследователей приводятся более высокие цифры; например, для коры больших полушарий мозга крыс общие затраты на трансмембранный перенос ионов натрия составляют около 40, для гиппокампа – 55%.
Детальные прижизненные исследования структурной организации механорецепторного нейрона рака методом «электронного зонда», а также параллельное определение ряда метаболических и электрофизиологических параметров показали, что основные структурные и метаболические перестройки и значительное усиление энергозатрат связаны с изменением функциональной активности, т.е. режима работы нейрона – переход от относительного покоя к возбуждению, смена возбуждения торможением и др. Причем установлено, что торможение нейрона характеризуется более быстрой и интенсивной активацией энергетического обмена по сравнению с возбуждением. Эти наблюдения отражают, таким образом, энергетическое обеспечение еще одной стороны специфической деятельности нервной клетки – ее интегративной функции.
К специфическим функциям нервной ткани – относятся также процессы хранения и переработки информации, поступающей в головной мозг. Синтез специфических белков и нейро-пептидов, компонентов липо- и гликопротеидных комплексов, участвующих в реализации отдельных этапов хранения и переработки информации, в процессе консолидации временных связей требует значительных энергетических затрат. Интенсивность синтеза ряда белков и пептидов мозга существенно превышает скорость биосинтеза белков в других тканях и заметно изменяется при нарушении энергетического обмена, вызванного недостатком кислорода.
Процессы, связанные с возникновением долговременного следа памяти, наиболее выражены в областях синаптических контактов; именно в синаптических окончаниях зарегистрирована интенсификация синтеза специфических белков при обучении.
Следовательно, чем интенсивнее протекают в том или ином образовании мозга процессы переработкой запоминания поступающей информации, тем выше потребность в богатых энергией соединениях и субстратах для синтетических реакций.
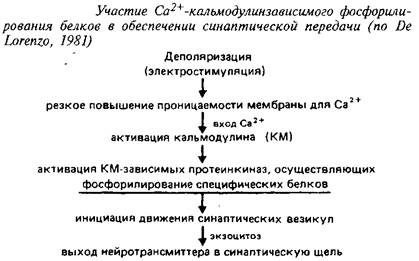
Кроме того, огромную роль в обеспечении функционирования синапсов играют процессы фосфорилирования белков, также связанные с потреблением АТФ или ГТФ. Циклы фосфорилирования – дефосфорилирования белков служат важным регуляторным механизмом, обеспечивающим пластичность на уровне нейронов. Процесс фосфорилирования является Са+ -кальмодулинзависимым или циклонуклеотидзависимым; последнее обстоятельство делает понятным высокую tконцентрацию циклических нуклеотидов и высокую активность ферментов их метаболизма в синаптических окончаниях. В синапсах процесс фосфофилирования специфических белков включается разнообразными нейромедиаторами. Изменение степени фосфорилирования белков, участвующих в функционировании синаптических окончаний, рецепторов, ферментов синтеза и метаболизма нейромедиаторов может существенно менять проводимость синапса; это доказано на примере фосфорилирования тирозингидроксилазы и ряда других белков.
Фосфорилирование специфических белков служит необходимым этапом синоптической передачи, обеспечивая выход некоторых нейромедиаторов в синаптическую щель. Энергозависимость процесса высвобождения нейромедиаторов в синаптическую щель, участие в нем АТФазных системна также энергозависимость процесса обратного захвата нейротрансмиттера из синаптической щели подтверждена результатами многих исследований. Последовательность протекающих; при этом процессов отражает схема 5.
Таким образом, осуществление такой важной и специфической функции нервной ткани, как синоптическая передача, требует значительных энергетических затрат. – В настоящее время трудно оценить количественно эти затраты, однако их большой объем не вызывает сомнений, поскольку число синоптических контактов на поверхности нейронов необычайно велико.
Еще одним важным обстоятельством, накладывающим определенный отпечаток на энергетический обмен и многие другие стороны метаболизма нервной ткани, является необычное для большинства других типов клеток соотношение между поверхностью клетки и объемом ее центральной части. Так, для мотонейронов коры кошки средние размеры тела клетки составляют около 50 мк, в то время как длина аксона – до 10 – 10 мк; общая поверхность клетки – до 10 мк. Поверхность дендритов клеток Пуркинье мозжечка в 80–100 раз превышает поверхность сомы.
Подобные особенности структуры клеток нервной системы объясняют причины значительных энергетических затрат на транспортные нужды клетки. В первую очередь необходимо упомянуть трансмембранный перенос субстратов, медиаторов, различных предшественников с помощью специфических транслоказ или в результате конформационных перестроек мембран, большинство из которых сопровождаются фосфорилированием-дефосфорилированием мембранах белков. Например, установлено, что не более 5% важнейшего энергетического субстрата – глюкозы – поступает в мозг за счет пассивной диффузии; подавляющее количество глюкозы переносится через ГЭБ с энергетическими затратами и при участии К+ , Na – АТФазы. По мнению ряда нейрохимиков, на эти процессы расходуется в нейроне достигает 15 000–20 000, занимая до 38–40% поверхности нейрона.
В последние годы внимание нейрохимиков привлекает изучение аксонального и ретроградного транспорта. Показано, что по аксону переносятся различные белки, синтезированные в перикарионе, ряд аминокислот, некоторые углеводы – глюкозамины, сиаловые кислоты и др. Транспорт последних обусловливает специфические перестройки и функциональные модификации белков синаптических окончаний за счет включения в них углеводных компонентов. Представление о соединениях, транспортируемых по аксону с различной скоростью, дают сведения, приведенные в табл. 9.
Таблица 9. Характеристика аксонального транспорта
| Тип аксонального транспорта | Скорость, мм/день | Транспортируемый материал | |
| Прямой: | |||
| – быстрый I | 200–400 | Гликопротеиды, гликолипиды, белки, медиаторы, ферменты, ионы Са+ | |
| – промежуточный II | 50 | Митохондриальные белки | |
| III | 15 | Миозиноподобные белки | |
| IV | 2–4 | Актин, клатрин окаймленных пузырьков, калъмодулин, ферменты | |
| – медленный | V | 0,2–1,0 | Белки нейрофиламентов, тубулин, т – белки аксоплазмы |
| Обратный | |||
| – быстрый | 100–200 | Нейроростовые факторы, лизосомальные ферменты, трофические вещества, катаболиты | |
Несмотря на то, что механизмы, обеспечивающие аксоплазматический ток, не вполне ясны, его зависимость от уровня макроэргических соединений доказана в экспериментах, где этот процесс ингибировался в присутствии 2,4– ДНФ, цианида или при ишемии. В возникновении перистальтических волн вдоль аксона определенную роль играют нейротубулярные структуры. Обязательным условием функционирования специфических сократительных белков нейротубул – тубуяина, кинезина и других являются конформационные перестройки после присоединения ГТФ, а также фосфорилирование с затратой АТФ или ГТФ под действием Са+ -зависимых протеинкиназных систем. Учитывая весьма значительные размеры и протяженность аксонов, а также скорость аксонального транспорта, составляющую для «медленного» тока 1–5 мм, а для «быстрого» – от 40 до 500 мм в день, можно сделать вывод, что осуществление этой специфической функции нервной ткани требует определенных затрат богатых энергией соединений.
Поддержание определенного конформационного состояния белков важных структурных образований нейрональных отростков – нейрофиламентов – также требует энергетических затрат, поскольку конформационные переходы белков нейрофиламентов осуществляются за счет реакций фосфорилирования-дефосфорилирования. Преимущественная локализация нейрофиламентов в осевом цилиндре аксонов и дендритов обеспечивает определенную пространственную ориентацию нейрональных отростков. Это обстоятельство имеет необычайную важность для осуществления нейрональных контактов, для организации функциональных ансамблей нейронов, т.е. для осуществления интегративной деятельности мозга.
Рассмотренные данные позволяют в некоторой степени конкретизировать общее положение об исключительно высоких энергетических потребностях нервной ткани и понять причину тесной зависимости между функциональной активностью мозга и интенсивностью энергетического обмена.
Выводы
1. Для мозга характерна высокая интенсивность энергетического метаболизма; мозг взрослого животного или человека потребляет до 20–25% кислорода, поступающего в организм, и до 70% свободной глюкозы, выделяемой из печени в артериальную кровь.
2. Наиболее интенсивно потребление кислорода и глюкозы осуществляется в филогенетически более молодых отделах мозга; максимальная скорость дыхания обнаружена в коре больших полушарий, минимальная – в спинном мозге и периферических нервах. Интенсивность дыхания нейронов, как правило, выше, чем нейроглиальных клеток.
8-09-2015, 23:20
