реферат на тему:
ГЕРПЕС И ЕГО ЛЕЧЕНИЕ.
Терапия герпетической инфекции с проявлениями в полости рта
Стратегия лечения ОГС и ХРГС
Лечение герпетического стоматита, как и любого другого инфекционного заболевания, должно иметь этиотропное, патогенетическое и симптоматическое направления (табл. 4, 5).
Поскольку речь идет о системной инфекции с проявлениями в полости рта, при лечении герпетического стоматита используют как общие, так и местные (для полости рта) средства и методы лечения.
Таблица 4
Стратегия лечения острого герпетического стоматита
| Стадия стоматита |
Направленность лечения |
Объект воздействия |
Группа препаратов и/или методов |
Применение препаратов и методов |
|
| местное |
системное |
||||
| Стадия разгара |
Этиотропное |
ВПГ-1, ВПГ-2 |
Противовирусные |
+ |
+ |
| Патогенетическое |
Иммунодефицит |
Иммунотропные |
+ |
+ |
|
| Обезвоживание |
Обильное питье, в/в регидратация |
+ |
|||
| Интоксикация |
Обильное питье, в/в дезинтоксикация |
+ |
|||
| Лихорадка |
Жаропонижающие |
+ |
|||
| Воспаление СОПР (альтерация, экссудация) |
Противовоспалительные |
+ |
|||
| Симптоматическое |
Болезненность при приеме пищи |
Рациональная диета, анестетики |
+ |
+ |
|
| Кровоточивость десны |
Дубящие антисептики, гемостатики |
+ + |
|||
| Патогенетическое |
Воспаление СОПР (пролиферация) |
Эпителизирующие средства |
+ |
||
| Стадия угасания |
Симптоматическое |
Болезненность при приеме пищи |
Рациональная диета, анестетики |
+ |
+ |
| Кровоточивость десны |
Дубящие антисептики, гемостатики |
+ + |
|||
Общее лечение должно обеспечить:
· прекращение размножения ВПГ в тканях и средах организма (полное освобождение организма от вируса в настоящее время не представляется возможным);
· ослабление интоксикации и ее симптомов;
· нормализацию обменных процессов.
При среднетяжелом и, особенно, тяжелом течении болезни общее лечение необходимо проводить вместе с врачом-педиатром.
Местное лечение преследует следующие цели:
· устранить или ослабить болезненные симптомы в полости рта;
· предупредить повторные высыпания элементов поражения;
· оказать воздействие на патогенную ассоциативную микрофлору;
· ускорить эпителизацию элементов поражения.
Выбор конкретных препаратов и их дозировка определяется степенью тяжести стоматита, стадией его развития, вероятностью генерализации инфекции.
Таблица 5
Стратегии лечения хронического рецидивирующего стоматита
| Стадия стоматита |
Направленность лечения |
Объект воздействия |
Группа препаратов и/или методов |
Применение препаратов и методов |
|
| в стратегии профилактического лечения |
в стратегии эпизодического лечения |
||||
| Этиотропное |
ВПГ-1, ВПГ-2 |
Противовирусные |
+ |
||
| Межрецидивный период |
Патогенетическое |
Иммунодефицит |
Иммунотропные |
+ |
|
| Местная травма |
Санация полости рта, устранение вредных оральных привычек, фотозащитная губная помада |
+ |
|||
| Продромальный период рецидива |
Продромальный период рецидива |
ВПГ-1, ВПГ-2 |
Противовирусные |
+ |
+ |
| Стадия разгара рецидива |
См. в соответствующих строках таблицы «Лечение ОГС» |
||||
| Стадия разгара рецидива |
См. в соответствующих строках таблицы «Лечение ОГС» |
||||
Основные группы препаратов и методы лечения ОГС и ХРГС
Противовирусные препараты
Как и всякое противоинфекционное лечение, антивирусная терапия имеет целью приостановить или ликвидировать активность вируса с минимальными негативными последствиями для функций организма хозяина. Современные антивирусные препараты, предназначенные для системного применения, могут вмешиваться в репродуктивный цикл вируса на разных его стадиях (на стадии адгезии к клеточной мембране, на стадии проникновения в клетку, в ходе транскрипции и трансляции вирусных белков, в процессе накопления вирусных частиц), но не влияют на состояние покоящегося, латентного вируса.
Разрабатываются препараты, способные помешать прикреплению вирусов к эпителиоцитам: такие свойства проявляют бактерицидные средства, а также гепарин и препараты, содержащие полисульфитные группы. Перенос вируса по нервным тканям к месту латенции и обратно, к месту рецидивирующих повреждений СОПР, может быть блокирован препаратами на основе капсаицина (вещества, присутствующего в перечной мяте), обратимо блокирующего внутриневральный транспорт.
 |
Принцип действия клинически эффективных антивирусных препаратов заключается в прекращении синтеза ДНК-вируса. Молекулярными
мишенями противовирусных препаратов являются специфические, связанные с вирусом (вирусные или вирусиндуцированные) ферменты, участвующие в синтезе вирусной ДНК.
Так, в клетках, инфицированных ВПГ, появляются вирусиндуцированные ферменты тимидинкиназа, ДНК-полимераза, дезоксирибонуклеаза,урацил-ДНК-гликозилаза, дезоксиуридинтрифосфатаза, рибонуклеотидредуктаза.
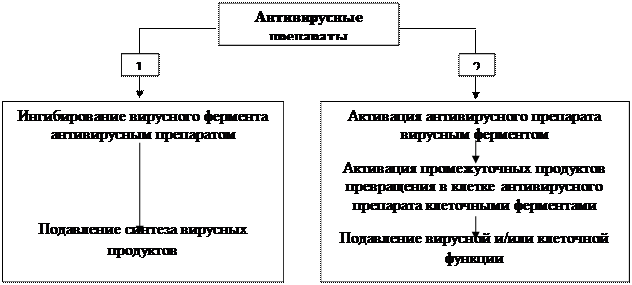
Эти ферменты по биохимическим и иммунологическим свойствам, а также по особенностям отношения к субстратам отличаются от соответствующих клеточных ферментов. Современные антивирусные препараты работают по схемам, представленным ниже.
Для реализации первой схемы нужны соединения, которые избирательно ингибируют только вирусиндуцированный фермент, участвующий в репродукции ВПГ, но не соответствующий ферменту клетки-хозяина (см. Цидофовир, Фоскарнет) .
Препараты второй группы изначально не являются активными, но, проникая в ВПГ-инфицированную клетку, обрабатываются (активируются и/или метаболизируются) вирусными ферментами и приобретают способность вмешиваться в синтез вирусной ДНК. Поскольку противовирусные препараты, в идеале, являются субстратом только для вирусных и вирусиндуцированных, но не для аналогичных клеточных ферментов, то препараты являются селективными, т. е. проявляют избирательное вирусстатическое действие и не оказывают никакого влияния на функции клетки.
На практике селективность препарата во многом определяется различием уровней сродства лекарственного соединения к вирусным и к клеточным ферментам. Для современных противогерпетических препаратов, относящихся ко второй группе (см. Ацикловир, Валацикловир, Пенцикловир, Фамцикловир) , ферментными мишенями являются тимидинкиназа ВПГ-1, ВПГ-2, ВПГ-3 и ДНК-полимераза всех герпесвирусов. Поэтому мишенями этих препаратов оказываются только те штаммы вирусов, которые используют в своем репродуктивном цикле названные ферменты (например, штаммы ВПГ, дефектные по тимидинкиназе, оказываются устойчивыми к препаратам второй группы). Как следует из механизма действия, препараты не оказывают вируцидного действия. Понятно, что описанные препараты не могут повлиять на вирусы, находящиеся в латентном состоянии, и не могут предотвратить начало их активации, т. е. предотвратить рецидив инфекции.
Ацикловир — синтетический ациклический аналог 2-дезоксигуанозида (пролекарство). Для превращения в активную форму он должен быть захвачен клеткой, инфицированной вирусом простого герпеса или вирусом ветряной оспы. В клетке ацикловир воспринимается вирусоспецифической тимидинкиназой как нечто, очень похожее на нормальный клеточный нуклеозид — сырье, необходимое для синтеза вирусной ДНК, поэтому тимидинкиназа фосфорилирует его и превращает в ацикловир-монофосфат. Затем, уже с помощью клеточных ферментов, препарат превращается в ацикловир-трифосфат. Ацикловир-трифосфат ингибирует вирусную ДНК-полимеразу и, конкурируя с нормальным компонентом вирусной ДНК 2-дезоксигуанозин-трифосфатом, встраивается вместо него в растущую цепь ДНК. Так как при этом блокируется 3΄-гидроксильная группа, необходимая для присоединения следующего нуклеотида, то ацикловир-трифосфат становится терминатором цепи ДНК ВПГ.
Ацикловир выпускается в 3-х основных лекарственных формах: крем для местного применения, таблетки и суспензия для парентерального введения. Применение кремов и мазей эффективно примерно в 50 % случаев. Наиболее эффективно применение ацикловира внутрь (около 95 % успеха в общей популяции и 80 % — для иммунодепресивных больных), поэтому препарат чаще всего назначается в таблетках. Базовым режимом считается назначение 5 мг/кг массы тела каждые 8 ч; при иммуносупрессии и/или генерализации инфекционного процесса доза увеличивается в 2–4 раза. Курс обычно продолжают в течение 5–7 дней.
Наиболее успешным является назначение ацикловира в самые ранние сроки развития первичной инфекции или рецидива: таким образом можно добиться абортивного течения эпизода (схема 3).
Побочные явления (обратимое нарушение функции почек, нарушения деятельности ЦНС) могут возникнуть у 1–5 % пациентов, получающих высокие дозы препарата внутривенно.
Эффективность лечения герпетической инфекции ацикловиром в некоторых случаях может быть снижена по нескольким причинам: а) из-за патологии ЖКТ и нарушения всасывания ацикловира (в таких случаях рекомендуют внутривенное введение препарата); б) из-за дефектности данного штамма вируса герпеса по тимидинкиназе (рекомендуют препараты, ориентированные на другие вирусные ферменты — например, фоскарнет).
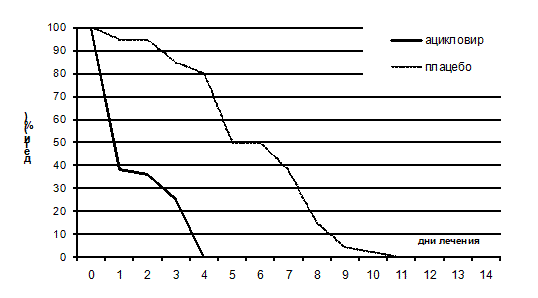 |
Схема 3. Выделение ВПГ у детей с ОГС при лечении ацикловиром или плацебо
Валацикловир — это L-валиновый эфир ацикловира. Он быстро превращается в ацикловир после приема внутрь и далее работает по вышеописанной схеме. Биодоступность и стабильность валацикловира значительно выше, чем ацикловира, что позволяет принимать валацикловир реже. Это очень важно, особенно при проведении супрессивной терапии хронической инфекции, в ходе которой значительно сокращается частота периодов выделения герпеса и клинически манифестных рецидивов. Имеются сведения о том, что при профилактическом применении препарата, начатом до заражения вирусом, возможно предотвращение колонизации нервных ганглиев герпесвирусом и, следовательно, предотвращение установления латентной инфекции.
Валацикловир впускается только в капсулах для приема внутрь. Побочными эффектами могут быть головная боль и тошнота.
Пенцикловир — ацикличный аналог гуанина, химически близкий ацикловиру, однако, сродство препарата к вирусной ДНК-полимеразе на два порядка выше, чем у ацикловира, что делает препарат в ряде случаев более эффективным (например, в некоторых случаях резистентности ВПГ к ацикловиру). Даже при относительно позднем начале лечения пенцикловир, в отличие от ацикловира, успешно справляется с генерализованной ВПГ-инфекцией. Спектр противовирусной активности пенцикловира тот же, что и у ацикловира, токсичность выражена меньше.
Пенцикловир выпускается в виде крема для местного лечения при хронической герпетической инфекции и в виде препарата для внутривенного введения при лечении герпетической инфекции иммунодефицитных больных.
Фамцикловир — пролекарственная форма пенцикловира. Препарат легко всасывается и превращается в пенцикловир в кишечнике и в печени. Фамцикловир выпускается в таблетках, предназначен только для орального применения. Спектр активности и механизм действия аналогичен таковым пенцикловира и, соответственно, ацикловира. Благодаря высокой биодоступности фамцикловир эффективен при невысоких дозах и двукратном применении в течение суток, что позволяет применять его для супрессивной терапии хронической инфекции и значительно снижать частоту клинических рецидивов. Сообщают о возможности предотвращения установления латентной герпетической инфекции при профилактическом назначении фамцикловира.
Цидофовир является ацикличным фосфатным производным нуклеозидов. Препарат не нуждается в вирусных ферментах, так как фосфорилируется клеточными ферментами. Активный метаболит цидофовира селективно ингибирует вирусную ДНК-полимеразу, прекращая синтез ДНК вируса. Цидофовир активен в отношении большинства герпесвирусов (ВПГ-1, ВПГ-2, ВПГ-3, а также вирусов Эпштейн–Барра, цитомегаловируса), аденовирусов и папилломавирусов.
Длительный период полувыведения активного метаболита цидофовира позволяет применять препарат 1 раз в неделю и только внутривенно (так как цидофовир имеет низкую биодоступность). Его большой недостаток — это высокая нефротоксичность. К другим побочным эффектам, возникающим при применении цидофовира, можно отнести цитопению, падение внутриглазного давления и метаболический ацидоз. Поэтому для лечения герпетической инфекции цидофовир применяется только в случаях устойчивости герпеса к ацикловиру и его аналогам, и чаще используется для борьбы с цитомегаловирусом.
Фоскарнет — неорганический пирофосфат, ингибирует вирусную ДНК-полимеразу всех герпесвирусов (а также вирусов гриппа А и В, вируса гепатита В и ВИЧ) без предварительной активации. Препарат высоко токсичен, что ограничивает его применение в лечении герпетической инфекции только случаями резистентности герпеса к ацикловиру и его аналогам.
Другие препараты, указанные в таблице 6, имеют меньшую клиническую эффективность, поэтому их применение возможно при недоступности современных антивирусных средств.
Таблица 6
Антивирусные препараты
| Название |
Молекулярные механизмы действия |
Назначения |
Недостатки |
| Ацикловир (зовиракс, виролекс, медовир, герпевир) |
Фосфорилируется вирусной тимидинкиназой, а затем клеточными ферментами до трифосфата. Вместо циклического гуанозинтрифосфата становится субстратом вирусной ДНК-полимера-зы, встраивается в синтезируемую вирусную ДНК и блокирует продолжение ее синтеза |
Местно, 3–5 аппликаций в день. В таблетках или в/в по 5–15 мг/кг массы тела каждые 8 ч в течение |
Тошнота, рвота, галлюцинации, почечная недостаточность. Относительно невысокая биодоступность |
| Валацикловир (валтрекс) |
Легко абсорбируется в ЖКТ, затем превращается в ацикловир и работает соответственно (см. выше) |
В таблетках (10 мг/кг 2–3 раза в день в течение 5 дней) |
Тошнота, рвота, почечная недостаточность. Устойчивость некоторых штаммов ВПГ |
|
|
См. ацикловир |
Местно (аппликации крема 1 %-ного каждые 2 ч в/в 5 мг/кг два раза в сутки) |
Тошнота, рвота |
| Фамцикловир (фамвир) |
Быстро и полно всасывается, в кишечнике и в печени превращается в пенцикловир (далее см. ацикловир) |
Внутрь (в таблетках по 2 мг/кг 2 раза в сутки) |
Тошнота, рвота |
| Цидофовир |
Метаболизируется клеточными ферментами, блокирует вирусную ДНК-полимеразу |
Внутривенно (5 мг/кг 1 раз в неделю) |
Высокая нефротоксичность, цитопения, падение внутриглазного давления, метаболический ацидоз |
| Фоскарнет |
Ингибирует вирусную ДНК-полимеразу без предварительной активации |
Внутривенно (5 мг/кг 2–3 раза в день) |
Высокая нефротоксичность; лихорадка, цитопения, метаболический ацидоз |
| Идоксуридин (ИДУ, герпедин, герплекс, стоксил Офтан-ИДУ) |
Фосфорилируется вирусной тимидинкиназой, а затем клеточными ферментами до ИДУ-три-фосфата. Вместо тимидин-дифосфата становится субстратом вирусной ДНК-полимеразы, встраивается в синтезируемую вирусную ДНК, что приводит к формированию неполноценного вириона |
Местно (инстилляции 0,1 %-ного раствора, аппликации 0,5% мази) |
Высокая токсичность при длительном применении, низкая стабильность растворов, быстрое развитие устойчивости ВПГ |
| Название |
Молекулярные механизмы действия |
Назначения |
Недостатки |
| А ra С (цитозин-арабино-зид, цитарабин) |
Фосфорилируется вирусиндуцированной дезоксицитидинкиназой, а затем клеточными ферментами до трифосфат-AraC. Ингибирует вирусную РНК-зависимую ДНК-полимеразу — нарушает сборку вирусной ДНК и полноценных вирионов |
Внутривенно (1–4 мг/кг в течение 5–6 дней) |
Токсичен (угнетает лейко- и тромбопоэз) |
|
(Аra А, аденинарабинозид) |
Претерпевает последовательную обработку клеточными, вирусиндуцированными (дезокситимидинкиназой) и снова клеточными ферментами; блокирует вирусную ДНК-полимеразу |
Местно (3 %-ная мазь — 5 аппликаций в течение суток) |
В высоких концентрациях блокирует клеточную ДНК-поли-меразу, токсичен, вызывает цитопению, судороги, галлюцинации; не эффективен при глубоких поражениях |
| Алпизарин |
Механизм не изучен |
Местно (2 %-ная и 5 %-ная мазь, таблетки 0,1 3–4 раза в день в течение 10–20 дней) |
Невысокая клиническая эффективность |
| Бонафтон |
Подавляет синтез белков капсида ВПГ |
Местно (0,5 %-ная и 1 %-ная мазь, таблетки 0,1 3–4 раза в день в течение 10–20 дней) |
Вызывает жжение, имеет невысокую клиническую эффективность, не проникает через гематоэнцефалический барьер |
| Оксолин |
Вируцидная активность при местном применении |
0,25–3 %-ная мазь |
Вызывает жжение |
| Риодоксол |
Механизм действия не известен |
0,25–0,5 %-ная мазь |
– |
| Теброфен |
Вируцидная активность при местном применении |
0,25–1–2-5 %-ная мазь |
– |
| Хелепин |
Вируцидная активность при местном применении |
1–5 %-ная мазь |
– |
![]()
9-09-2015, 00:22
