5.1.3 Реакция торможения гемагглютинации
1. Для тестирования одного образца сыворотки вносят по одному объему DGV в один ряд лунок.
2. В первую и последнюю лунки добавляют по одному объему сыворотки, разведенной в четыре раза.
3. С помощью микротитратора готовят последовательные двукратные разведения сыворотки.
4. В лунки 1—10 вносят по одному объему ГА-антигена краснухи, содержащего 4 ГАЕ. В лунку 12 ГА-антиген краснухи не добавляют.
5. В лунки 1—8 другого планшета вносят по одному объему рабочего разведения ГА-антигена краснухи, и затем в восьми лунках готовят последовательные двукратные разведения ГА-антигена. В эти 16 лунок добавляют по одному объему DGV. Это титрование является проверочным для ГА-антигена краснухи. Для контроля в лунки 12 первого и второго рядов вносят по два объема DGV.
6. Закрытые планшеты оставляют на 1 ч при комнатной температуре или на ночь при 4 °С.
7. Во все заполненные лунки вносят по два объема 0,03%-ной суспензии эритроцитов цыплят и планшеты оставляют на 1 — 1,5 ч при 4 °С.
8. Просматривая планшеты, определяют титр ГА-антигена краснухи. В контрольных лунках агглютинация не должна произойти.
9. Если же сыворотка агглютинировала эритроциты в отсутствие ГА-антигена краснухи, необходимо провести повторное тестирование исходного разведения сыворотки. Перед этим сыворотку адсорбируют одной каплей 30%-ной суспензии эритроцитов цыплят 1 ч при комнатной температуре, а затем эритроциты осаждают центрифугированием.
10. Титром специфических антител в исследуемой сыворотке считают обратную величину разведения, при котором полностью подавляется гемагглютинация.
5.1.4 Интерпретация результатов
При невысоком титре интерпретировать результаты сложно, так как при небольшом разведении возможно остаточное присутствие неспецифических ингибиторов. Наличие вирусоспецифических антител считается доказанным при титре 16 или выше.
5.2 Реакция связывания комплемента
Принцип реакции связывания комплемента основан на том, что взаимодействие антител с вирусными антигенами приводит к активации, а следовательно, к связыванию комплемента. Остающийся комплемент можно обнаружить, используя эритроциты барана, сенсибилизированные антиэритроцитарными антителами. Эти антитела обычно называют гемолизинами и получают из сыворотки кролика, иммунизированного эритроцитами барана. Несвязавшийся комплемент вызывает лизис эритроцитов. В случае связывания комплемента в первой реакции лизиса эритроцитов барана не происходит.
Таким образом, количество специфических антител в сыворотке можно определить при тестировании ее последовательных разведений с известным микробиологическим антигеном в присутствии комплемента и с последующим добавлением сенсибилизированных эритроцитов барана.
Для получения достоверных воспроизводимых результатов необходимо строго соблюдать пропорции используемых реагентов. Поэтому перед постановкой реакции необходимо определить соответствующие концентрации комплемента, гемолитической сыворотки и антигена. Ниже мы приводим пример определения специфических антител к вирусу краснухи в РСК-
5.2.1 Титрование комплемента и гемолитической сыворотки
Здесь так же, как и в РТГА, используют полистироловые 96-луночные планшеты с U-образным дном и микротитратор
Постановка реакции
1. Растворяют в требуемом по инструкции объеме дистиллированной воды лиофилизированный препарат комплемента.
2. Нумеруют восемь стеклянных пробирок.
3. Готовят 60-кратное разведение комплемента в первой пробирке. Для этого 0,1 мл комплемента разводят 0,7 мл дистиллированной воды и 4,0 мл вероналового буферного раствора. Лиофилизированный комплемент содержит криопротектор, поэтому добавление 0,7 мл дистиллированной воды к 0,1 мл растворенного комплемента дает 10-кратное разведение.
4. В оставшиеся семь пробирок вносят по 0,4 мл VBS.
5. 1,6 мл содержимого первой пробирки переносят во вторую, перемешивают, затем из второй переносят 1,6 мл в третью и т.д. до восьмой пробирки. Перед каждым переносом пипетку промывают в VBS. Таким образом получают последовательные разведения комплемента с 20%-ной разницей между ними, т.е. 1:60, 1:75, 1:94, 1:118, 1:148, 1:184, 1:230, 1:288.
6. Размечают 96-луночный планшет, как указано на рис. 5.
7. В лунки 1—8 рядов 1—7 вносят по два объема VBS.
8. В лунки 9 рядов 1—6 вносят по три объема VBS.
9. В лунки 1—8 рядов 1—7 добавляют по одному объему приготовленных разведений комплемента.
10. Планшет закрывают и оставляют на ночь при 4°С.

На следующее утро готовят последовательные двукратные разведения гемолитической сыворотки от 1:25 до 1: 800; в особую пробирку вносят 1 мл VBS. В пробирку 1 вносят 2,4 мл VBS и 0,1 мл гемолитической сыворотки. По 1 мл VBS добавляют в пробирки 2—6. Из первой пробирки переносят 1 мл во вторую пробирку и т.д. до шестой пробирки, промывая пипетку после каждого переноса. Удаляют 0,5 мл из первой пробирки и 1 мл из шестой пробирки для того, чтобы объем жидкости в каждой пробирке составил 1 мл.
12. Эритроциты барана трижды промывают в VBS.
13. Затем супернатант сливают и эритроциты суспендируют б оставшемся объеме жидкости.
14. Определяют объем полученной суспензии эритроцитов и разводят ее VBS до получения 4%-ной суспензии.
15. По 1 мл суспензии эритроцитов добавляют в семь соответственно помеченных пробирок, следуемых за рядом пробирок с разведенной гемолитической сывороткой, а также в контрольную пробирку.
16. Суспензии эритроцитов смешивают с соответствующими разведениями гемолизина, закрывают пробирки и инкубируют 20 мин на водяной бане при 37 °С.
17. В то же время в термостате или термальной комнате разогревают приготовленный накануне планшет для микротитрования.
18. Содержимое пробирок перемешивают встряхиванием и по одному объему каждого разведения вносят в соответствующий ряд лунок.
19. Ресуспендируют содержимое лунок, постукивая по планшету, и оставляют его на 30 мин при 37 °С. Через 15 мин инкубирования необходимо повторно суспендировать клетки встряхиванием планшета.
20. Для получения окончательного результата планшет выдерживают примерно 90 мин при 4°С.
Интерпретация полученных результатов. На рис. 5 показан типичный результат тестирования. Отсутствие гемолиза в контрольных лунках с комплементом и гемолизирующей сывороткой свидетельствует об отсутствии неспецифического лизиса.
Оптимальной сенсибилизирующей концентрацией гемолитической сыворотки считают ее разведение, обеспечивающее наибольший лизис при максимальном разведении комплемента. На рис. 5 ОСК составляет 1: 100. В описанных ниже опытах гемолитическую сыворотку используют именно в этом разведении.
Разведение комплемента, обеспечивающее 50%-ный лизис при ОСК гемолитической сыворотки содержит одну единицу комплемента - На рис. 5 EKsoсодержится в разведении 1:184, поэтому для тестирования следует использовать комплемент в разведении 1: 60.
5.2.2 Титрование связывающего комплемент антигена вируса краснухи с положительной контрольной сывороткой
Постановка титрования. 1. Разводят лиофилизированный СК-ан-тиген вируса краснухи дистиллированной водой до указанной в инструкции концентрации.
2. Нумеруют шесть пробирок.
3. В пробирку 1 вносят 0,2 мл антигена вируса краснухи и 0,8 мл VBS.
4. В пробирки 2—6 добавляют по 0,5 мл VBS.
5. Из первой пробирки во вторую переносят 0,5 мл и т.д. до шестой пробирки, получая таким образом последовательные разведения антигена 1:5, 1: 10, 1:20, 1:40, 1:80, 1: 160.
6. Разводят лиофилизированный препарат заведомо положительной антисыворотки дистиллированной водой.
7. К 0,1 мл сыворотки добавляют 3,9 мл VBS.
8. Готовят последовательные двукратные разведения антисыворотки на VBS.
9. Размечают полистироловый 96-луночный планшет, как показано на рис. 6.
10. В каждую лунку, содержащую контрольную антисыворотку, и в каждую лунку, содержащую контрольный антиген, вносят по одному объему VBS.
В лунки 1—6 рядов 1—5 добавляют по одному объему соответствующего разведения сыворотки.
12. В лунки 1—6 рядов 1—5 добавляют по одному объему соответствующего разведения антигена.
13. В каждую лунку вносят по одному объему разведения, содержащего ЗЕКбо-
14. Для проверки правильности выбора концентрации комплемента в четыре контрольные лунки вносят 6, 3, 1,5 и 0,75 ЕК.50 соответственно. Далее проводят следующие операции:
а) в лунки рядов 1, 3, 4 добавляют по одному объему VBS; в лунки ряда 2 — два объема VBS;
б) в лунки ряда 1 добавляют два объема комплемента, а в лунки рядов 2 и 3 — по одному объему комплемента;
в) с помощью микротитратора переносят 0,025 мл из лунок ряда 3 в лунку ряда 4;
г) из лунок ряда 4 микротитратором удаляют 0,025 мл;
д) в лунки рядов 3 и 4 вносят по два объема VBS. 14. Планшет оставляют на ночь при 4°С.
16. Утром планшет выдерживают 30 мин при 37°С.
17. Готовят 4%-ную суспензию эритроцитов барана; 2,5 мл этой суспензии смешивают с равным объемом гемолизина, разведенного в VBS до ОСК. Гемолизин добавляют при постоянном перемешивании, переворачивая пробирки 10—12 раз. Сенсибилизированные эритроциты инкубируют в водяной бане 30 мин при 37 °С.
18. В каждую использованную лунку планшета добавляют по одному объему сенсибилизированных эритроцитов.
19. Для перемешивания планшет покачивают, затем накрывают крышкой и инкубируют 15 мин при 37°С. Затем содержимое лунок еще раз перемешивают, покачивая планшет, и продолжают инкубацию еще 15 мин.
20. Для получения окончательного результата планшет выдерживают около 90 мин при 4 °С.
Интерпретация полученных результатов. На рис. 6 показан типичный результат тестирования. Контроль комплемента свидетельствует о правильности выбора концентрации комплемента. Контроль антигена и антисыворотки свидетельствует о том, что для связывания комплемента необходимо образование комплекса антигел — антитело.
Оптимальным разведением СК-антигена вируса краснухи считают разведение, обеспечивающее максимальное связывание комплемента при наибольшем разведении сыворотки. В нашем примере таким разведением является разведение
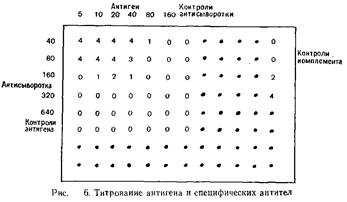
1:20. Его и следует использовать при тестировании неизвестной сыворотки.
В рассматриваемом случае титр положительной сыворотки равен 160, т. е. обратной величине разведения, позволяющего различить два произвольных разведения СК-антигена вируса краснухи.
5.2.3 Тестирование неизвестной сыворотки
Титрование сыворотки. 1. В стеклянных пробирках готовят четырехкратные разведения исследуемой, контрольной положительной и контрольной отрицательной сывороток, смешивая 0,1 мл каждой сыворотки с 0,3 мл VBS.
2. Для инактивации присутствующего в сыворотке комплемента пробирки инкубируют на водяной бане 30 мин при 56 °С.
3. 96-луночный планшет для микротитрования размечают, как указано на рис. 7.
4. В лунки 1—8 и 10 вносят по одному объему VBS. Количество заполненных рядов должно соответствовать числу тестируемых сывороток.
5. В лунки 1 и 10 добавляют по одному объему разведенной в четыре раза сыворотки.
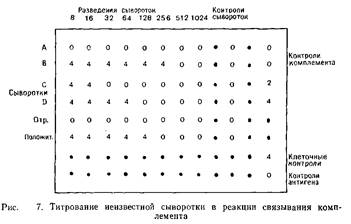
6. С помощью микротитратора готовят последовательные двукратные разведения сыворотки в первых восьми лунках. Таким образом получают последовательные двукратные разведения от 1:8 до 1: 1024. Из лунок 8 микротитратором удаляют по 0,025 мл.
7. В лунку с контролем антигена добавляют один объем VBS, а в лунку с контролем клеток — три объема VBS.
8. По одному объему КС-антигена вируса краснухи добав* ляют в каждую лунку, за исключением тех, где содержатся контроли сывороток, клеток и комплемента.
9. Один объем разведения, содержащего ЗЕК50, добавляют во все лунки, кроме лунок с контролем комплемента и контролем клеток.
10. Контроль комплемента готовят, как описано выше.
Планшет закрывают и оставляют на ночь при 4°С.
12. Планшет выдерживают 30 мин при 37 °С, а затем в каждую лунку добавляют сенсибилизированные эритроциты, как описано выше.
13. Планшет инкубируют при 37 °С, как описано выше. Перед учетом результатов планшет выдерживают 90 мин при 4° для осаждения клеток.
Учет полученных результатов. На рис. 7 показан результат тестирования четырех неизвестных сывороток. Контроль комплемента подтверждает, что разведение комплемента действительно содержит ЗЕКбо Контроль клеток свидетельствует об отсутствии спонтанного лизиса сенсибилизированных эритроцитов. Полный лизис в лунках, содержащих контроли антигена и сывороток, свидетельствует о том, что для связывания комплемента необходимо образование комплекса антиген — антитело. Поэтому, если сыворотки содержат иммунные комплексы и инфицированы бактериями, результат реакции может быть искажен. Контроль с заведомо отрицательной сывороткой свидетельствует об отсутствии иммунных антител. Контроль заведомо положительной сыворотки показывает, что она содержит антитела в разведении 1: 128. В 256-кратном разведении антитела обнаружить не удалось. Таким образом, титр контрольной положительной сыворотки равен 128. Титры тестируемых сывороток от А до D составляют соответственно 8, 256, 16 и 64.
5.3 Радиальный гемолиз
Радиальный гемолиз — прекрасный метод для обнаружения IgG к вирусу краснухи, поскольку этим чувствительным и специфичным методом можно одновременно тестировать большое число сывороток.
IgG, специфичные к вирусу краснухи, обнаруживают по лизису эритроцитов, связанных с антигеном вируса краснухи и суспендированных в агарозном геле в присутствии комплемента.
Содержащиеся в сыворотке IgG к антигену вируса краснухи, связанному с эритроцитами, выявляют при одновременном тестировании контрольных гелей, содержащих комплемент и эритроциты, свободные от антигенов краснухи.
5.3.1 Приготовление гелей для радиального гемолиза
1. Расплавляют обычным образом два объема 1%-ной агарозы на буфере для постановки РСК и охлаждают до 43°С в водяной бане.
2. Эритроциты барана трижды промывают центрифугированием и ресуспендированием в том же буфере.
3. Трижды промытые клетки опять ресуспендируют в том же буфере, получая 15%-ную суспензию. В две пробирки, обозначенные «опыт» и «контроль», вносят по 0,3 мл полученной суспензии.
4. Растворяют ГА-антиген вируса краснухи и смешивают с 0,3 мл суспензии эритроцитов в пробирке, обозначенной «опыт».
5. Смесь инкубируют 30 мин при комнатной температуре.
6. Обе пробирки заполняют буфером для постановки РСК и центрифугируют для осаждения эритроцитов.
7. Супернатанты удаляют, а эритроциты ресуспендируют в 0,5 мл того же буфера с канамицином.
8. Растворяют лиофилизированный препарат комплемента. В опытную пробирку добавляют 0,5 мл неразведенного комплемента.
9. Пробирку выдерживают 10 с в водяной бане при 43 °С, затем ее содержимое смешивают с 15 мл расплавленной агарозой. Пробирку быстро закрывают пробкой и перемешивают содержимое для равномерного распределения эритроцитов, несколько раз переворачивая пробирку.
10. Сразу же после перемешивания смесь агарозы с эритроцитами выливают в горизонтально установленную квадратную пластиковую чашку Петри. Чашку обозначают «опыт».
Осторожным покачиванием равномерно распределяют агарозу по чашке Петри.
12. Для контрольной суспензии повторяют этапы 7—9. На соответствующей чашке делают надпись «контроль».
13. Чашки оставляют на 20 мин для затвердения агарозы. Результат учитывают сразу же, либо сохраняют чашки в течение четырех дней при 4°С.
5.3.2 Тестирование сывороток
1. Тестируемые сыворотки прогревают 20 мин на водяной бане для инактивации комплемента.
2. В залитых гелях «опыта» и «контроля» по матрице с помощью узкой стальной трубки, присоединенной к водоструйному насосу, проделывают лунки диаметром 3 мм.
3. Соответствующие лунки опытного и контрольного гелей заполняют сыворотками. В каждую постановку следует включить как заведомо отрицательную, так и слабо положительную сыворотку.
4. Гели помещают на ночь во влажную камеру при 37 °С.
5.3.3 Интерпретация полученных результатов
На пластинах с гелем против темного фона выявляют зоны гемолиза вокруг лунок. Сыворотки, вызывающие образование больших по сравнению с контролем зон гемолиза, содержат специфические антитела к вирусу краснухи. Сыворотки, не вызывающие гемолиза вообще или вызывающие образование зон гемолиза такого же диаметра, как и контрольных, не содержат специфических антител. Донор такой сыворотки восприимчив к первичной инфекции.
5.4 Обнаружение специфических IgMк вирусу краснухи методом «захвата» антител
Обнаружение специфических IgM к вирусу краснухи имеет важное значение при постановке диагноза первичной и врожденной инфекций. Существует множество методов определения и идентификации таких антител. В основе ранее применяемых методов лежит разделение сывороточных IgG и IgM гель-фильтрацией или центрифугированием в градиенте плотности сахарозы. Полученные фракции тестируют в РТГА на присутствие специфических иммуноглобулинов. В последнее время эти методы заменены чисто иммунологическими методами, которые не требуют фракционирования сыворотки. Существуют два основных варианта этих методов. Первый предполагает идентификацию иммобилизованного антигена. При этом антиген вируса краснухи связывают с поверхностью пластика, инкубируют его с сывороткой пациентов, а затем с меченными антителами против IgM человека, содержащихся в исследуемой сыворотке. Если после каждой стадии проводить тщательную отмывку, то оставшаяся метка укажет на присутствие специфических IgM.
Альтернативным методом является метод «захвата» антител, при котором твердую фазу вначале связывают с антителами к IgM человека. Промывают и инкубируют с тестируемой сывороткой, что приводит к «захвату» содержащихся в ней IgM. Последующая инкубация с антигеном краснухи позволяет отобрать все специфические IgM. После очередной промывки связавшийся с твердой фазой антиген вируса краснухи выявляют в реакции с меченными антителами к вирусу краснухи.
Последние антитела — антитела-детекторы — могут быть помечены радиоактивным 125 1 или связаны с ферментом, расщепляющим субстрат с изменением окраски. Ниже мы опишем метод, основанный на использовании радиоактивных изотопов, поскольку он хорошо разработан и применяется в большинстве лабораторий. В качестве меченых антител в настоящее время широко используют мышиные моноклональные антитела, однако, к сожалению, они не всегда доступны. При необходимости мы советуем связаться с местной вирусологической лабораторией, которая смогла бы обеспечить вас моноспецифической сывороткой высокого титра. В противном случае сыворотка может быть получена стандартными методами или с помощью гибридомной технологии. Полученные антитела легко пометить иодом, как описано ранее {6]. Однако в последнее время все более популярным становится иммуноферментный метод. В частности, фирмой Rubenz-M производится коммерческий набор реагентов для метода «захвата» IgM, специфичных к вирусу краснухи. Кроме того, можно отдельно заказать моноклональные антитела к вирусу краснухи, конъюгированные с ферментом.
5.4.1 Подготовка полистироловых гранул
1. В контейнер помещают полистироловые гранулы, которые заливают кроличьей антисывороткой к, разведенной в 500 раз в 1 н. НС1.
2. Гранулы встряхивают в течение 1 ч при комнатной температуре. Перед употреблением гранулы должны быть выдержаны на холоду не менее 48 ч.
3. Для мелкомасштабных экспериментов гранулы разливают по 12-мм пробиркам из полистирола. Гранулы промывают в специальном сосуде, удаляя жидкость пастеровской пипеткой, присоединенной с помощью вакуумного шланга к водоструйному насосу. Описанные выше процедуры могут быть значительно упрощены при использовании специальных систем фирмы AbbottDiagnosticsLtd.
5.4.2 Тестирование
1. Отбирают требуемое количество гранул, отсасывают НС1 и покрывают гранулы PBSA с 1% БСА. Суспензию инкубируют 3 ч при комнатной температуре.
2. В лунки или пробирки, используемые для тестирования, разливают по
8-09-2015, 19:41
