Гемоглобин Гемоглобин – белок эритроцитов, красных кровяных клеток, переносящий молекулярный кислород от легких к тканям в организмах позвоночных животных. Гемоглобин можно считать своего рода модельным белком, структура, свойства и функции которого наиболее полно изучены по сравнению с другими белками на протяжении последних 50 лет. Американский физик Хопфилд назвал его атомом водорода современной биохимии, имея в виду, что изучение гемоглобина сыграло в биохимии ту же роль, что и изучение атома водорода в физике. Гемоглобин называют также почетным ферментом, поскольку исследования его структуры в статике и динамике позволили значительно продвинуться в понимании механизмов функционирования ферментов. Структура этого глобулярного белка известна в деталях главным образом благодаря работам английского биофизика Макса Перутца, который получил первые рентгеноструктурные данные еще в конце 40-х годов нашего века. За эти исследования он был удостоен Нобелевской премии.
Структура гемоглобина Молекула гемоглобина состоит из четырех субъединиц: двух a и двух b - и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая a-цепочка содержит 141, а b-цепочка – 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности a- и b-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте – глобину. Каждая субъединица гемоглобина содержит одну небелковую (так назваемую простетическую) группу – гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гема представлена на рис.1, а . [2]
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи –
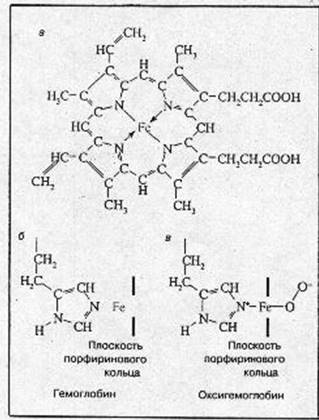
Рис.1. Структура гема (а), структура активного центра дезоксигемоглобина (б), структура активного центра оксигемоглобина (в).
перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна (рис.1, б ). Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток — дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гема [Fe(II) ÞFе(III); гем Þ гемин]. В дезоксигемоглобине глобин предохраняет железо гема от окисления.
Реакция оксигенации Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+ ), а от имидазольного кольца проксимального гистидина. Это схематически изображено на рис.1, б. Вместо молекулярного кислорода железо гема может присоединить окись углерода СО (угарный газ). Даже небольшие концентрации СО приводят к нарушению кислородпереносящей функции гемоглобина и отравлению угарным газом.
Выше было сказано, что одна молекула гемоглобина содержит четыре субъединицы и, следовательно четыре гема, каждый из которых может обратимо присоединить одну молекулу кислорода. Поэтому реакцию оксигенации можно разделить на четыре стадии:
Hb+O2 Û HbO2 (1a)
НbO2 +O2 Û Hb(O2 )2 (1б)
Hb(O2 )2 +O2 Û Hb(O2 )3 (1в)
Hb(O2 )3 +O2 Û Hb(O2 )4 (1г)
Прежде чем рассмотреть эту главную функциональную реакцию гемоглобина более детально, необходимо сказать несколько слов о мышечном гемоглобине — миоглобине. Этот красящий белок поперечнополосатых мышц представляет собой комплекс гема с "четвертушкой" глобина. Он содержит одну молекулу гема и одну полипептидную цепочку, состав и структура которой подобны составу и структуре b-субъединицы гемоглобина. Как и для гемоглобина, важнейшей функцией миоглобина является обратимое присоединение молекулярного кислорода. Эту функцию характеризует так называемая кривая оксигенации, связывающая степень насыщения гемоглобина кислородом (в процентах) с парциальным давлением последнего, рО2 (мм Hg). Типичные кривые оксигенации гемоглобина и миоглобина (при условии достижения химического равновесия) приведены на рис.2, а , б. Для миоглобина кривая является гиперболой, как и должно быть в случае одностадийной химической реакции при условии достижения химического равновесия:
Mb+O2 ÛMbO2 (2)
где Mb - миоглобин.
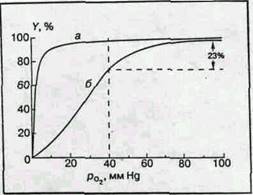
Рис. 2 Кривые оксигенации
миоглобина (а) и гемоглобина (б)
Совершенно другая картина возникает в случае гемоглобина. Кривая диссоциации имеет S-образную форму. Без кислорода молекулы гемоглобина обладают низким сродством к кислороду и равновесие реакции (1а) сдвинуто влево. Затем кривая становится круче и при высоких значениях рО2 практически сливается с кривой диссоциации миоглобина. [2]
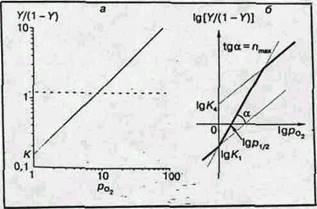
Рис. 3. Логарифмические анаморфозы кривых оксигенации миоглобина (a) и гемоглобина (б)
М.Перутц пишет, что распределение молекул кислорода по молекулам гемоглобина следует библейской притче: "Каждому, у кого есть, дай еще, и унего будет избыток; у того же, у кого нет, забери то немногое, что у него осталось". Это заставляет предположить, что между гемами одной молекулы гемоглобина существует некоторая связь, благодаря которой присоединение кислорода к одному гему влияет на присоединение кислорода к другому гему той же молекулы. Это явление было известно задолго до работ Перутца и установления структуры гемоглобина и механизма его реакции с кислородом. Оно получило название гем-гем взаимодействия. Физиологический смысл гем-гем взаимодействия очевиден. Сигмоидная форма кривой диссоциации создает условия максимальной отдачи кислорода при переносе гемоглобина от легких с высоким значением pO2 к тканям с низким значением pO2 . Для человека значения pO2 артериальной и венозной крови в нормальных условиях (Т 37°С, pH 7,4) равны соответственно 100 и 40 ммHg. При этом (рис.2, б ) гемоглобин отдает тканям 23% связанного кислорода (степень оксигенации меняется от 98 до 75%). При отсутствии гем-гем взаимодействия для одногемового миоглобина (рис.2, а ) эта величина не превышает 5%. Миоглобин поэтому служит не переносчиком, а депо кислорода и отдает его мышечной ткани лишь при резкой гипоксии, когда насыщение ткани кислородом падает до недопустимо низкого значения. [2]
Логарифмическая анаморфоза кривой диссоциации гемоглобина человека представлена на рис.3, б . В этом случае начало кривой представляет собой прямую под углом 45° к координатным осям, как и для миоглобина: первые молекулы кислорода соединяются в основном с молекулами гемоглобина, еще не содержащими кислорода, и гемы таким образом оксигенируются независимо. Это свидетельствуют о том, что гем-гем взаимодействие обусловлено не просто наличием нескольких гемов в молекуле, а тем, что после оксигенации одного гема меняются условия оксигенации других гемов той же молекулы. Затем наклон кривой увеличивается. Тангенс угла максимального наклона получил название коэффициента Хилла (n), который отражает степень кооперативности процесса. Для миоглобина n=1, а для гемоглобина человека (в норме) n~3. Вблизи области полного насыщения гемоглобина кислородом наклон кривой снова становится равным 45° (большинство молекул гемоглобина либо не содержат свободных гемов, либо имеют лишь один гем, способный присоединить кислород).
Механизм кооперативности В 1963 году Моно, Шанже и Джекоб обнаружили, что активность некоторых ферментов меняется скачком между двумя значениями при воздействии на белок некоторых низкомолекулярных агентов, не принимающих участия непосредственно в каталитическом акте. Такие ферменты получили название аллостерических, а само явление – аллостерии. Предполагается, что эти ферменты могут находиться в разных состояниях, переключение между которыми осуществляется при присоединении специфического низкомолекулярного лиганда (необязательно вблизи активного центра). В 1965 году Моно, Уайман и Шанже поняли, что гемоглобин, не являясь ферментом, принадлежит к тому же классу белков. К тому времени уже было известно, что структуры глобул оксигемоглобина и гемоглобина различны, и авторы предположили, что состояния с разными значениями констант оксигенации соответствуют различным пространственным структурам белка. Для гемоглобина постулируется наличие двух таких состояний: R (от англ. relaxed) и Т (от англ. tense). Состояние R характеризуется высоким, а Т – низким сродством к О2 (сильнее и слабее связывают молекулярный кислород соответственно). В рамках этой концепции считается, что как в R-, так и в Т-состоянии сродство к кислороду субъединиц одной глобулы (т.е. есть всех четырех гемов одной глобулы) одинаково. Этот постулат позволяет построить сравнительно простую математическую модель кооперативных свойств гемоглобина: КR , КТ и L (константы равновесия реакций ассоциации в состояниях R, Т и отношение числа молекул гемоглобина в состояниях Т и R соответственно). На рис.2, б ясно, что КТ <КR . Очевидно, увеличение константы ассоциации при переходе из состояния Т в состояние R соответствует в расчете на один гем изменению свободной энергии системы
DG= 2,3 RTlg(KR /KT ) кДж/моль. (7)
Для гемоглобина человека при 37°С эта "свободная энергия кооперативности" равна 5,61 кДж/моль. В физиологических условиях при отсутствии кислорода лишь ~ 3·10-5 % молекул гемоглобина находятся в R-форме, а в условиях полного насыщения кислородом лишь ~ 7-10-3 % — в Т-форме. [2]
Изменения электронной и пространственной структуры гемоглобина в процессе оксигенации На рис.4 схематически показаны электронная структура железа гема, положение атома железа относительно плоскости порфиринового кольца гема, спектральные и магнитные характеристики молекул в различных состояниях молекулы гемоглобина: дезоксигемоглобин, оксигемоглобин и ферригемоглобин. Следует подчеркнуть, что во всех случаях речь идет о равновесных состояниях молекул белка. Мы увидим далее, что переход из одного состояния в другое требует значительного (в молекулярных масштабах) времени, в течение которого система проходит через несколько неравновесных состояний, заметно отличающихся по своим физическим и химическим свойствам от равновесных. [2]
В молекуле дезоксигемоглобина железо отстоит от плоскости порфиринового кольца примерно на 0,5-0,6 А° (есть небольшие отличия между a- и b-субъединицами). Из шести 3d электронов железа Fe(II) два электрона спарены на одной из низших d -орбиталей ( dxy , dyz , dxs ), а четыре электрона занимают оставшиеся d -орбитали, их спиновые моменты, согласно правилу Хунда, параллельны и суммарный спин S -2. Магнитный момент гема в этом состоянии равен ~ 5,5 боровского магнетона (БМ), а спектр поглощения в зеленой области имеет характерную полосу с lmax ~ 556 нм. Присоединение кислорода ведет к значительным изменениям. Атом железа в оксигемоглобине лежит практически в плоскости порфиринового кольца (расстояние до плоскости составляет 0,16 А° в α- и 0,00 А° в β- субъединицах). Все шесть d -электронов спарены на трех низших d -орбиталях, S= 0, оксигемоглобин диамагнитен. В зеленой области спектра имеются две характерные полосы поглощения: а (lmax 576 А°) и b (542 А°).
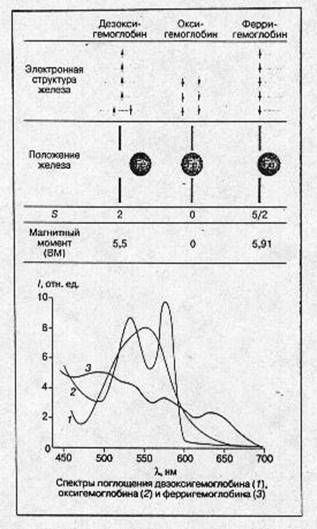
Рис.4. Основные характеристики молекулы гемоглобина в различных состояниях.
В ферригемоглобине (метгемоглобин) при нейтральных значениях рН место кислорода занимает молекула воды (при щелочных значениях рН-ОН), железо находится значительно ближе к плоскости гема, чем в дезоксигемоглобине, все пять d -электронов неспарены и занимают пять d- орбиталей. S = 5/2 и магнитный момент равен 5,91 БМ.
Структурные изменения в активном центре (вблизи гема) приводят и к значительным изменениям пространственной структуры всего белка. При оксигенации (переход от Т- к R-форме) смещение отдельных аминокислотных остатков достигает 7 А°. Как уже было сказано выше, четвертичная структура гемоглобина характеризуется наличием четырех полипептидных цепей, образующих две (a- и две b-субъединицы). Более детальные исследования показали, что субъединицы образуют ab-димеры. ТÞR – переход сопровождается поворотом одного димера относительно другого на 12-15° и в конечном счете приводит к увеличению карманов, в которых находятся гемы. Эти структурные изменения инициируются присоединением первой молекулы О2 к одному из свободных гемов и распространяются на всю глобулу. Именно поэтому в равновесной смеси всегда присутствуют только Т- и R-формы. Эти димеры в Т-форме стягиваются 14 дополнительными (по сравнению с R-формой) солевыми мостиками (водородные связи между ионными или нейтральными группами аминоксилот, ван-дер-ваальсовы контакты). Кроме того, между b-субъединицами в Т-форме присоединяется молекула дифосфоглицерата, что также приводит к сужению карманов. Эти изменения схематически представлены на рис.5.
Триггером для всех описанных выше структурных перестроек при переходах между Т- и R-формами и обратно служит присоединение или отщепление кислорода. После локального элементарного химического акта: присоединение или отщепление низкомолекулярного лиганда, окисление железа при образовании ферригемоглобина (иначе говоря, после появлении лишнего положительного заряда на железе) – возникает существенно неравновесное конформационное состояние – изменения вблизи активного центра уже произошли, а вся огромная молекула белка осталась в прежнем, еще не отрелаксировавшем состоянии. Последующая релаксация может занимать микросекунды и даже секунды. В ходе этой релаксации меняются не только физические, но и химические свойства белка, в частности скорости последующих химических актов, если они успевают произойти до полного завершения релаксации. Таким образом, описанная выше картина процессов, сопровождающих обратимое связывание кислорода гемоглобином, является лишь первым, хотя и очень важным приближением к истине. Так, например, быстрое восстановление железа в ферригемоглобине коротким (микро- или наносекунды) импульсом электронов приводит к возникновению неравновесного состояния, в котором железо уже восстановлено, но не отошло от плоскости порфиринового кольца. По спектральным и магнитным характеристикам это состояние соответствует равновесному оксигемоглобину. Релаксация гема и его ближайшего окружения с удалением железа от плоскости порфиринового кольца занимает при комнатной температуре десятки микросекунд, а полная релаксация всей белковой глобулы к равновесной Т-форме дезоксигемоглобина — сотни миллисекунд.
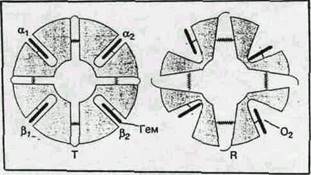
Рис. 5. Структурная схема перехода гемоглобина от Т- к R-форме
Другие реакции и функции гемоглобина При взаимодействии молекулярного кислорода с гемоглобином существует небольшая, но конечная вероятность окисления последнего: молекула О2 не присоединится, но окислит железо: Fe2+ + O2 ÞFe3+ O2 - . Поэтому при дыхании в эритроцитах непрерывно образуется метгемоглобин. Для его восстановления в эритроците существует специальная ферментативная система, восстанавливающая метгемоглобин и превращающая его в нормальный дезоксигемоглобин. При нарушении этой системы возникает тяжелое заболевание — метгемоглобинемия, при котором гемоглобин перестает быть переносчиком кислорода.
Гены, ответственные за синтез гемоглобина, могут подвергаться мутациям, меняющим структуру и функции белка. Наиболее изучена мутация, приводящая к замене только одной аминокислоты в полпептидных цепочках b-субъединиц гемоглобина. Замена глутамина на валин ведет к тяжелой болезни – серповидноклеточной анемии: эритроциты принимают форму серпа и теряют способность переносить кислород.
Присоединение кислорода меняет кислотно-основные свойства гемоглобина. Оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Поэтому в тканях, где значительная часть гемоглобина теряет кислород и становится более сильным основанием, гемоглобин связывает образующуюся в ходе метаболических внутриклеточных процессов углекислоту. В альвеолах легких дезоксигемоглобин снова превращается в оксигемоглобин, становится более сильной кислотой и способствует отщеплению СО2 . Это слегка упрощенное описание важного процесса транспорта углекислоты эритроцитами. Углекислота, освобождаемая тканями, недостаточно хорошо растворима для эффективного переноса. С помощью фермента карбоангидразы, ускоряющего прямую и обратную реакцию
СО2 +Н2 ОÛНСО3 - +Н+ (8)
двуокись углерода превращается в хорошо растворимый бикарбонат-анион. В капиллярах тканей отщепление кислорода повышает содержание дезоксигемоглобина, связывающего протоны и смещающего, таким образом, равновесие реакции (8) вправо. Легко растворимый ион бикарбоната переносится кровью. В альвеолах легких гемоглобин оксигенируется, протоны освобождаются и равновесие (8) смещается влево. Образуется плохо растворимая двуокись углерода СО2 , которая удаляется из водной фазы и выдыхается. Таким образом, гемоглобин работает как буфер с переменным значением pK. Функция гемоглобина как переносчика углекислоты не менее важна, чем его функция переносчика кислорода.
Гемоглобин – одно из наиболее хорошо изученных белков. Десятки лет исследований гемоглобина в описании и понимании физических, химических и биологических аспектов его функционирования. Огромный вклад внесли работы Макса Перутца и его сотрудников в Кавендишской лаборатории (Кембридж, Великобритания). Однако важность этих работ касается не только гемоглобина. Они послужили основой развития современных представлений о механизмах ферментативного катализа, связав непосредственно кинетику и термодинамику биохимических реакций с динамикой конформационных изменений макромолекул белка. Если отвлечься от непосредственной практической пользы полученных результатов для медицины, фармакологии, то фундаментальное значение работ по изучению механизма функционирования гемоглобина заключается в стимулировании прогресса в установлении законов протекания важнейших процессов: ферментативного катализа и внутриклеточной трансформации энергии в биологических системах. [2]
Об участии гемоглобина в мембранной организации эритроцитов свидетельствует феномен образования серповидной и других форм эритроцитов при различных гемоглобинопатиях, первооснову которого и составляет аномальное взаимодействие эритроцитарной мембраны с мутантными гемоглобинами. Не исключено, что изменение упруго-механических свойств эритроцитарных мемран при повышении отрицательного заряда их внешней поверхности происходит вследствие улучшения условий для создания и структурирования белкового слоя, формируемого с участием гемоглобина на внутренней поверхности эритроцитарных мембран. [13]
Показано, что при получении безгемоглобиновых теней эритроцитов в препаратах электронно-микроскопически обнаруживается большое количество везикул диаметром примерно 100 нм, что свидетельствует о частичной фрагментации плазматической мембраны эритроцитов. В то же время если в мембранах содержится много гемоглобина и других белков, обнаруживаемых в примембранных слоях, то фрагментации мембраны определяемой таким образом, не наблюдается. Имеются и другие доказательства стабилизирующего действия гемоглобина на эритроцитарные мембраны. Например, S.Knutton и соавторам удалось получить две фракции эритроцитарных мембран, различающихся содержанием связанного
8-09-2015, 21:32
