5. Бонафтон. Обладает противовирусной активностью в отношении вируса простого герпеса и некоторых аденовирусов.
6. Оксолин. Обладает вируцидной активностью, эффективен при вирусных заболеваниях глаз, кожи, вирусных ринитах; оказывает профилактическое действие при гриппе.
7. Теброфен. Применяют в виде мази при вирусных заболеваниях глаз, а также при заболеваниях кожи вирусной или предпологаемой вирусной этиологии.Может приминятся также для лечения плоских бородавок у детей.
8. Риодоксол. Обладает противовирусной оптимальностью и оказывает противогрибковое действие.
9 .Флореналь. Открывает нейтрализующее действие в отнашении вирусов.
10 Метисазон. Подавляет репродукцию вируса основной группы: обладает профилактической активностью в отнашении вируса оспы и облегчает течение поствакцинальных осложнений, задерживает распространение кожного процесса, способствует более быстрому подсыханию эффеораций. Имеются данные об эффективности метисазона при лечении рецидивирующего генитального герпеса.
В ) Нуклеозиды
1. Идоксуридин. Применяют при кератитах в офтальмологии.
2. Ацикловир. Эффективен в отношении вирусов простого герпеса и опоясывающего герпеса. Оказывает иммуностимулирующее действие.
3. Ганцикловир. По сравнению с ацикловиром ганцикловир более эффективен и, кроме того, действует не только на вирус герпеса, но и на цитомегаловирус.
4. Фамцикловир. Имеет такие же функции, как и ганцикловир.
5. Рибамидил. Рибамидил, подобно ацикловиру, обладает противовирусной активностью. Ингибирует синтез вирусных ДНК и РНК.
6. Зидовудин. Противовирусный препарат, ингибирующий репликацию ретровирусов, включая вирус иммунодефицита человека (ВИЧ).
Г) Противовирусные препараты растительного происхождения
1. 1.Флакозид. Получают из листьев бархата амурского семейства рутовых. Препарат эффективен в отношении ДНК-вирусов.
2. Алпидарин. Получена из травы Koneermena альпийского и копеечника желтеющего, семейства бобовых. Эффективен в отношении ДНК-содержащих вирусов группы герпеса. Ингибирующее действие на репродукцию вируса простого герпеса проявляется преимущественно на ранних стадиях развития вируса.
3. Холепин. Очищенный экстракт из части растения мепедеци копеечковой, семейства бобовых. Обладает противовирусной активностью в отношении ДНК-содержащих вирусов группы герпеса.
4. Лигосин. Применяют при герпетических заболеваниях кожи.
5. Госсипол. Продукт получаемый при переработке семян хлопка или из корней хлопчатника, семейства мальвовых. Препарат обладает активностью в отношении различных штаммов вирусов, в том числе дерматотропных штаммов вируса герпеса. Оказывает слабое действие на грамположительные бактерии.
4. МЕХАНИЗМ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
4.1. Противогриппозные препараты [6]
Все препараты это группы защищают клетки человека от проникновения в них вируса гриппа, т.к. блокируют места связывания вируса с поверхностью клеточной мембраны. На вирусы, проникшие внутрь клетки, они не влияют, поэтому их применяют для индивидуальной или массовой профилактики гриппа у лиц, находящихся в контакте с больными или в период эпидемии. Все препараты (кроме оксолина) назначают внутрь. Из желудочно-кишечного тракта они неплохо всасываются. В очень небольшом проценте они связываются с белками плазмы крови, хорошо проникают во все ткани и жидкости, в том числе и в ликвор. Элиминация осуществляется частично печенью, а в основном почками (90%). Поэтому у больных с нарушением функции почек повторные приемы препаратов могут привести к кумуляции и сопровождаться нежелательными эффектами.
4.2. Противогерпетические и пртивоцитомегаловирусные препараты [6]
Противогерпетические (теброфен, риодоксол, идонеуридин, видарабин, оцикловир, валацикловир). Противоцитомегаловирусные (ганцикловир, фосфоноформат).
Все эти препараты блокируют репликацию, т.е. нарушают синтез нуклеиновых кислот вируса. Видарабин применяют местно, а при дисиминированной герпетической инфекции (энцефалит) вводят внутривенно капельно. Но препарат плохо растворяется, поэтому его инфузия в большом количестве жидкости длится около 12 часов, что нежелательно для больного с энцефалитом, отеком мозга. Применение видарабина через гематоэнцефалический барьер составляет примерно 30% от концентрации препарата в плазме крови.
В печени происходит превращение препарата в арабинозин гипоксантин, этот метаболит сохраняет активность и быстро распределяется в тканях. Элиминация происходит с мочой (50%) и калом. Ацикловир, валацикловир, ганцикловир – назначают внутрь во время еды, а также вводят внутримышечно и внутривенно.
Биоусвоение из желудочно-кишечного тракта равно 15 – 20%, тем не менее этого достаточно для оказания эффекта. У препаратов высокая активность, и они обладают способностью избирательно накопляться в клетках, инфицированных вирусом, но не в интактных клетках. Связывание с белками плазмы крови всего 9 – 30%, поэтому препараты хорошо проникают в различные ткани и жидкости. В организме человека валацикловир быстро и почти полностью превращается в ацикловир и валин под действием фермента валацикловиргидролазы. 10 – 15% ацикловира и ганцикловира подвергается биотрансформации в печени. Большая часть препаратов (80 – 90%) в неизменном виде и в виде метаболита 9-карбоксиметоксиметилгуанина выводится почками.
4.3. Лекарства, влияющие на вирус иммунодефицита человека (ВИЧ) [6] (зидовузин, фосфоноформат)
После проникновения лимфотропного ВИЧ в лимфоцит происходит синтез вирусной ДНК на матрице (вирусной РНК) под влиянием обратной транскриптазы (ревертазы), что и приводит к повреждению лимфоцитов. Механизм действия аредотимидина и фосфоноформита заключается в блокаде названного фермента. В основном препараты эффективны у носителей вируса до появления признаков заболевания. Кроме названных препаратов сейчас появились новые противоретровирусные средства: дидеоксимицетин и дидеоксицидин. Азидовудин назначают внутрь или вводят внутривенно. Биоусвояемость из желудочно-кишечного тракта 60%. Связь с белками плазмы крови 35%. Азидотимидин легко проникает в различные ткани и жидкости, включая ликвор. Он подвергается биотрансформации в печени, его главный метаболит 5| -о-глюкуронид. Экскреция – с помощью почек в неизменном виде (90%) и в виде метаболитов.
4.4. Противовирусные препараты широкого спектра действия (интерфероны) [6]
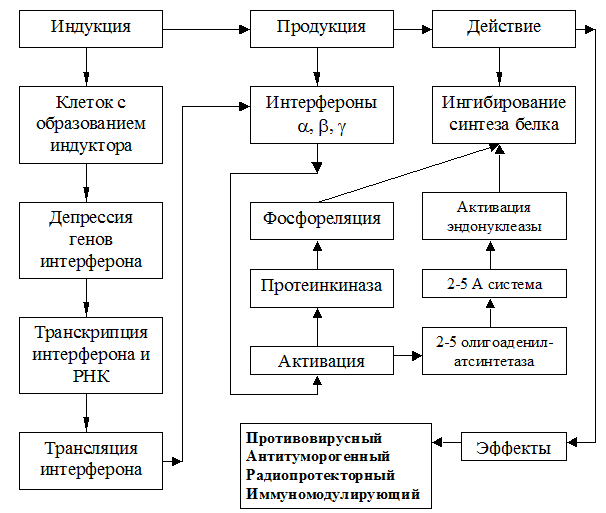
Под влиянием индукторов интерферона (многочисленных синтетических и природных агентов) осуществляется индукция, итогом которой является депрессия генов интерферона, которые локализуются во 2-й, 9-й и ,возможно, в 5-й и 13-й хромосомах человека. В ответ на индукцию происходит формирование, синтез интерферона в клетках человеческого организма.
Основным показателем активности индукторов интерферона является продукция так называемого «сыворо-точного» интерферона в крови.
При энтеральном способе введения индукторов в организм, интерфероновый ответ обеспечивается лимфоцитами (эритроцитами) системы GALT лимфоцитной ткани желудочно-кишечного тракта, сконцентрированной в виде вальдеерова кольца, пееровых бляшек, подслизистых монону-клеаров и мемфоцитов тонкой кишки и аппендикса, куда они могут быть доставлены популяцией специализированных мембранных клеток, способных транспортировать макромолекулы из стенки тонкой кишки через эпителиальный барьер. Большая часть продуцируемого при этом интерферона может быть утилизирована окружающими клетками кишечника локально и не достигает циркулирующей крови (паракринный тип). Другая часть продуцированного интерферона попадает в кровь или непосредственно из тканевой жидкости (эндокринный тип), или через мигрирующие лимфомоноциты и макрофаги. Продукция интерферона в кишечнике опережает и превосходит уровень его образования в других органах [12].
При пероральном введении высокомолекулярных индукторов интерферона, заключенных в липосомы (полигуацил, ларифан), преимущественным местом образования интерферона становится печень, а именно – гепатоциты и купферовы клетки. Хотя и в этом случае первой линией взаимодействия индуктора с организмом является кишечник, в нем синтезируется значительное количество интерферона, но в составе липосом более 80% индуктора транспорти-руется в печень, поэтому уровень продукции интерферона в этом органе в 2-4 раза выше, чем в кишечнике [12].
Таким образом,при поступлении индукторов интерферона в организм наряду с продукцией сывороточного интерферона в организме происходит автономная ,локальная продукция интерферона органами .При этом ведущая роль в продукции интерферона тем или иным органом определяется в равной степени как путями индукции интерферона , так и составом индуктора , а , следовательно, и чувствительностью интерферонокомпетентных клеток к использо-ванному индуктору.
После образования интерферона в органах, он поступает в кровь и присоединяется к так называемому «сывороточному» интерферону (синтезировался в крови, сыворотке под влиянием индукторов). Дальнейшее противовирусное действие интерферона может быть представлено в виде схемы [13].
4.5. Амиксин – возможности и перспективы применения в клинической практике
Изыскание и изучение новых фармакологических средств является одной из важнейших проблем современной медицины. Успех в производстве нового лекарственного препарата – это результат глобальной долгосрочной стратегии. При этом шансы на успешное завершение работ по созданию нового лекарства весьма незначительны, примерно 1 к 5000 – 10000, а процесс разработки и продвижения на рынок нового препарата занимает 12-15 лет.
Разработка новых лекарственных средств борьбы с заболеваниями 21 века является приоритетным направлением деятельности компании «ЛЭНС-Фарм». Особый интерес вызывают препараты, повышающие сопротивляемость организма к инфекционным факторам. Одним из таких препаратов является Амиксин.
СХЕМА ФУНКЦИОНИРОВАНИЯ СИСТЕМЫ ИНТЕРФЕРОН
Путь Амиксина в клиническую практику включал в себя ряд последовательных этапов прохождения разрешительных инстанций. Все параметры эффективности и безопасности подтверждены документально, начиная с исходного состояния до измерений, проводимых в процессе экспериментального лечения (форма дозировки, способ применения, режим приема, план подбора дозы, срок лечения). К настоящему времени сформировалось представление о потенциально эффективных курсах лечения Амиксином и потребности в нем в первую очередь при заболеваниях, для лечения и профилактики которых не существует удовлетворительных методов. При этом уточнялись влияние выбранных заболеваний на пациентов и общество в целом, недостатки, которые присущи существующим способам лечения, характеристики, которыми обладает Амиксин для улучшения любого из имеющихся способов лечения. Экономическая оценка основывалась на данных сравнения с альтернативными действиями. Особое внимание уделялось ответам на вопросы, во что обходится пациенту и (или) обществу получение желаемого результата. Доказательства эффективности и экономической целесообразности лечебно-профилактических возможностей Амиксина явились основанием для включения препарата в стандарты лечения и профилактики, а также компенсации стоимости лечения Амиксином при таких заболеваниях, как вирусные гепатиты, грипп и другие острые респираторные инфекции, геморрагические лихорадки.
Весьма важным явилось создание по результатам исследований информационно-аналитического сборника. При обобщении опыта применения Амиксина определяющая роль отводилась формализованным методам, что позволило выработать наиболее согласованные рекомендации для реальной практики. Ценность представляемой в настоящем сборнике информации определяется с одной стороны - научной обоснованностью, признаваемой ведущими учеными и специалистами, с другой - связью с решением вопросов целенаправленного и рационального использования Амиксина в реальной практике.
4.5.1. Название и описание препарата Амиксин
· Регистрационный номер 96/252/1; 96/252/3.
· Международное непатентованное название – Тилорон (2,7,-bis [2-(diethylamino) ethoxy]-9h-fluoren-9-one-dihydrochloride).
· Низкомолекулярное синтетическое соединение ароматического ряда, относящееся к классу флуоренонов.
· Таблетки, покрытые оболочкой по 6 и 10 штук в упаковке в дозе 0.125 г (взрослая форма) и 0.06 г (детская форма)
4.5.2. Противовирусная активность и индукция клеток – продуцентов интерферона.
Амиксин обладает противовирусным действием в отношении широкого круга вирусов.
Амиксин индуцирует образование интерферона как первого (альфа, бета), так и второго (гамма) типов.
Амиксин «включает» синтез интерферона в отличие от поликлональной индукции в определенных популяциях клеток.
Индукция интерферона осуществляется без вспомогательных клеток, что доказано в экспериментах с чистой культурой, в частности - Т клеток.
По интенсивности и продолжительности действия Амиксин проявляет лучшие качества индукторов: «выработка» позднего интерферона, время максимального ответа 10 - 18 часов.
4.5.3. Действие на иммунную систему и воспалительный процесс.
· Экспрессия на мембранах клеток молекул HLA 1 класса, антигенов HLA-DR 2 класса.
· Рост и активация NK-клеток.
· Восстановление функциональной полноценности антител.
· ![]() Целенаправленная поляризация Th0 Th1.
Целенаправленная поляризация Th0 Th1.
· Моделирование воспалительной реакции в зависимости от фазы воспаления.
4.5.4. Фармакокинетика
· Всасывание. После приема внутрь Амиксин быстро абсорбируется из желудочно-кишечного тракта.
· Распределение. Биодоступность составляет 60%, около 80% препарата связывается с белками плазмы.
· Выведение. 99% препарата выводится в неизмененном виде, период полувыведения составляет 48 часов.
4.5.5. Доклинические исследования противовирусная активность препарата
Противовирусная активность Амиксина оценивалась на лабораторных животных, инфицированных возбудителем геморрагической лихорадки с почечным синдромом (ГЛПС) - вирусом Хантаан. Использовались профилактическая, лечебно-профилактическая и лечебная схемы введения препарата белым мышам. Установлена наибольшая противовирусная активность Амиксина при использовании лечебно-профилактической схемы перорального введения в дозе 10 мг/кг.
Противовирусная активность Амиксина и его влияние на интерфероновый статус при гепатите исследовались на самцах белых нелинейных мышей массой 16-18 г. Вирус (штамм Мещерина) пассировали путем внутрибрюшинного заражения белых мышей. Для воспроизведения энтерального гепатита мышам перорально вводили по 0,2-0,3 мл 30-40% суспензии печени зараженных животных на физиологическом растворе. За 1-7 дней до заражения животным опытной группы перорально вводили Амиксин в дозе 4 мг. За животными наблюдали 14 дней. Однократное введение амиксина 4 мг обеспечивало 40-50% защиту животных от энтерального заражения мышей в течение 72 часов после введения препарата.
Изучено профилактическое и лечебное действие Амиксина в концентрации 0,25 г на кг веса против вируса лихорадки Западного Нила в опытах на белых мышах. Профилактическое введение Амиксина приводило к снижению летальности в опытной группе в среднем на 23,4%.
5. ПОЛУЧЕНИЕ противовирусных ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
5.1. Новые пути синтеза хлоргидрата тилорона [8, 9]

(2,7-бис-[2-(диэтиламино)этокси]-флуорен-9-он
Синтезирован двумя способами тилорон-2,7-бис[(диэтиламино)этокси] флуоренон-9(I)
Нитрованием флуоренона-9(II) HNO3 получен 2,7-(O2 N)2 -II (Т. пл. 289 – 91º), восстановленный ZnCl2 в HCl и AcOH до 2,7-(H2 N)2 -II (Т. пл. 287 – 9º), диазотированием которого NaNO2 в 50%-ной HBF4 получено соответственно бис-диазосоединение (III) переведенное действием 50%-ной H2 SO4 в 2,7-(HO)2 -III (IV, т. пл. 320 – 2º). Ацетилированием флуорена (V) AcCl и AlCl3 синтезирован 2,7-Ac2 -V (т. пл. 180 – 2º), превращенный действием 3-ClC6 H4 COOOH в присутствии F3 CCOOH в 2,7-(AcO)2 -V (VI), который окислен Na2 Cr2 O7 в AcOH до 2,7-(AcO)2 -II (VII). Взаимодействием IV или VII с KOH и Et2 NCH2 CH2 Cl*HCl получен I.
0,099 моля 85%-ной 3-ClC6 H4 COOOH прибавляют к охлажденной смеси 0,037 моля 2,7-Ас2 -V, 400мл ХЛФ и 0,3мл F3 CCOOH, защищают от света, нагревают до 20ºС, выдерживают три дня, хлороформный раствор промывают насыщенным раствором Na2 CO3 и насыщенным раствором NaCl, органический слой сушат безводным MgSO4 , фильтрат упаривают, получают IV, выход 62%, т. пл. 165 – 7ºС (МеОН – хлф1).
0,034 моля VI, 0,01 моля Na2 Cr2 O7 *2H2 O, 30мл АсОН кипятят 45 минут, раствор охлаждают, прибавляют 50мл воды, выделяют VII, выход 53%, т.пл. 224,5-6,5º (СП).
0,04 моля Et2 NCH2 CH2 Cl*HCl, 0,08 моля KOH, 0,01 моля IV или VII 0,5г PhCH2 NMe3 Br, 200мл толуола и 50мл воды кипятят 24 часа, после охлаждения отделяют органический слой, промывают водой, насыщенным раствором NaCl и высушивают безводным MgSO4 , толуол упаривают в вакууме, масло растворяют в 5мл МеОН прибавляют к 50 мл эфирн. ненасыщенного HCl. Выделяют ди-ХГ (I) 50%, т.пл. 232 – 4º (изо-PrOH-MeOH, 3:1).
5.2. Получение бонафтона (6-бром-1,2-нафтохинон)

Получение 6-бромнафтохинона-1,2 с нитрозодисульфонатом калия [10]
Реакцией β-нафтол с Br2 , в лед АсОН получен с выходом 76% 6-бромнафтол-2(I), т.кип. 200 - 5º /20 т.пл. 128ºС. Взаимодействием IcON(SO3 K)2 в дистиллированной воде при добавлении 1/6 н KH2 PO4 приводит к 6-бромнафтохинону-1,2, т.пл. 170º(разл).
Бонафтон – 14 С [11]
Разработан метод синтеза [8 – 14 С]-6-бром-1,2-нафтохинона (I, бонафтона), обладающего противовирусной активностью, взаимодействием 4-MeOC6 H4 CH2 CH2 CH2 Br с Mg и 14 CO2 получают 4- MeOC6 H4 CH2 CH2 CH2 -14 COOH (II). Циклизация (II) ПФК дает [1-14 С]-7-метокси-1-тетралон (III), восстановление которого на Pd/С приводит к [1-14 С]-7-метокситетралину (IV). Дегидрирование IV при помощи тетрахлор-1,2-бензохинона приводит к [1-14 С]-7-метоксинафталину(V-неролину-14 С) из V и HBr получают [8-14 С]-2-нафтол(VI), бромирование которого дает [1-14 C]-3,8-дибром-7-оксинафталин (VII). Из VII получают [8-14 C]-6-бром-2-нафтол (VIII). Реакция VIII с ON(SO3 K)2 приводит к (I).
5. 3. ГОССИПОЛ
2,2-бис-(1,6,7-триокси-3-метил-5-изопропил-8-альдегидонафтил)
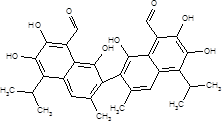 |
C30 H30 O8 Мол. масса 518.57 Т.пл. 180-181°C |
Госсипол представляет собой кристаллический канареечно-желтый порошок без запаха.
Растворим - в спирте, эфире, ацетоне, хлороформе, пиридине.
Не растворим - воде.
Качественные реакции. Кристаллик госсипола с каплей конц. серной кислоты на часовом стекле дает пурпурно-красное окрашивание.
Диоксим C30 H32 O8 N2 . В колбе с обратным холодильником нагревают на водяной бане 0.5 г госсипола, 1 г гидроксиламина гидрохлорида, 5 мл пиридина и 5 мл абсолютного спирта. Растворитель концентрируют под тягой, к остатку прибавляют спирт. Выпадают кристаллы; их отделяют и перекристаллизовывают из спирта. Т.пл. 312°C.
Госсипол является одним из главных пигментов хлопчатника, известен в трех таутомерных формах. Обладает свойствами антиоксиданта, щелочные растворы поглощают свободный кислород воздуха. Ядовит.
В ядрах семян и других частях хлопчатника содержание госсипола в среднем составляет 1%. В процессе производства хлопкового масла он превращается в глубокоокрашенные не токсичные соединения, затрудняющие рафинацию масла.
В настоящее время наряду с фармацевтической отраслью применяется для получения полимерных материалов, преимущественно лаков.
ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ
Сырье и реактивы .
| Исходное сырье | Количество | Примечание |
| Кора корней хлопчатника | 250 г | В коре корней хлопчатника содержится больше госсипола, чем в других частях растения. Отсутствие в ней жирных веществ облегчает выделение и очистку. |
| Эфир | 1000 мл | Для удаления перекисей эфир встряхивают с 5% раствором сернокислого железа(II), подкисленного серной кислотой. |
| Уксусная кислота | 25 мл | |
| Петролейный эфир | 25 мл | |
| Гидросульфит натрия | 1 г | |
| Этиловый спирт | 50 мл | |
| Пиридин | 5 мл | |
| Гидроксиламин гидрохлорид | 1 г |
1 Стадия. Выделение госсипола в виде госсиполацетата.
Госсиполацетат - молекулярной комплекс состава C30 H30 O8 * CH3 COOH, легко гидролизуемое горячей водой.
Грубоизмельченную воздушно-сухую кору корней хлопчатника перколируют при пониженной температуре 1 л эфира, свободного от перекисей. Эфирный экстракт концентрируют при небольшом разрежении до объема 40-50 мл, добавляют 15 мл ледяной уксусной кислоты, хорошо перемешивают и, не закрывая колбы, оставляют в холодильнике для кристаллизации. При медленном испарении эфира выпадает госсиполацетат. Первую порцию зеленовато-желтых кристаллов отфильтровывают на стеклянном фильтре и промывают 10 мл смеси эфира и уксусной кислоты в соотношении 3:1.
Фильтрат и промывную смесь объединяют и оставляют в стакане при комнатной температуре, пока не испарится половина объема. В это время выпадает вторая половина госсиполацетата. Соединив вместе полученные осадки, их растворяют в 50 мл эфира, добавляют 5 мл уксусной кислоты и оставляют на сутки. Выпадает чистый госсиполацетат в количестве 3 гр.
2 Стадия. Получение свободного госсипола.
На холоду растворяют 3 г госсиполацетата в 50 мл эфира, свободного от перекисей, и переносят в коническую колбу, содержащую равный объем 0.4%-ного водного раствора дитионита натрия (неверно называемый гидросульфитом натрия).
Эфир отгоняют при температуре бани около 60°C под умеренным вакуумом. По мере испарения эфира на поверхности воды выделяется свободных госсипол в виде
8-09-2015, 22:54
