Ключевые слова: α - липоевая кислота, тиоктовая кислота, оксидативный стресс, свободные радикалы, печень, первичный билиарный цирроз.
α - липоевая кислота является дисульфидным производным октановой кислоты и в течение десятилетий считалась основной простетической группой ряда клеточных ферментативных комплексов. До недавнего времени α - липоевая кислота считалась эффективным антиоксидантом. Предполагалось, что она может быть эффективным средством терапии или профилактики различных заболеваний, при которых отмечается дисбаланс окислительно-восстановительного клеточного статуса. Это может отмечаться при нейродегенерации, ишемии-реперфузии, полинейропатии, сахарном диабете, ВИЧ и нарушениях функции печени.
На основании данных большого числа экспериментальных и клинических исследований высказывались предположения о возможном положительном влиянии α - липоевой кислоты при лечении нейродегенеративных заболеваний, ВИЧ и сахарном диабете.
Для оценки эффективности α - липоевой кислоты при заболеваниях печени и желчевыводящих путей, будет проведено обсуждение экспериментальных моделей in vitro о влиянии эндогенной или экзогенно назначаемой α - липоевой кислоты на физиологию клеток. Также будет проведен анализ эффективности терапевтических препаратов по данным клинических исследований.
Транспорт, метаболизм и расщепление альфа - липоевой кислоты
Различные исследования по радиоактивному распределению dl-[14 C]- или [35 S]- липоевой кислоты в тканях крыс после интраперитонеального или перорального назначения показали, что α - липоевая кислота быстро всасывается в желудке, проникает в различные ткани, где частично метаболизируется с последующей экскрецией. После назначения α - липоевой кислоты в течение 5 недель, свободная α - липоевая кислота была обнаружена и различных тканях с наибольшей концентрацией в сердце [2]. При непосредственном поступлении в клетки in vitro, α - липоевая кислота быстро захватывалась клетками. Детальный анализ влияния α - липоевой кислоты в гепатоцитах был проведен Peinado et al. [3]. Билиарная экскреция [35 S]- компонентов после назначения [35 S]- α - липоевой кислоты показала, что липоат транспортировался в гепатоциты и не напрямую связывался с мембраной гепатоцита. Тонкослойный хроматографический анализ показал, что эти компоненты состоят в основном из продуктов метаболизма, не идентичных липоату. Было показано, что поступление в печень α - липоевой кислоты с экскрецией [35 S]-компонентов в желчный пузырь, одновременно подавлялось в присутствии жирных кислот (октаноатов), что предполагает, что липоат и эти жирные кислоты транспортируются с помощью одного переносчика [3]. После поступления липоат проходит кинетические изменения с насыщенными и ненасыщенными компонентами. Насыщенный компонент показал Km (константа Михоэлиса) 28 mM и обнаруживается при концентрации ниже 75 mM. Авторы предположили, что поступление липоата в печень с помощью переносчика осуществляется при его низких концентрациях, в то время как при высоких концентрациях диффузия становится основным способом его поступления. Физиологическая концентрация α – липоата в крови ниже уровня Km (80±17nM) [4]: следовательно, нормальное поступление происходит посредством транспортного механизма. Экскреция с мочой достигает максимальных величин через 3-6 часов после назначения α - липоевой кислоты [5-7].
В любом случае, ряд метаболических исследований у людей и крыс показали, что только малые из назначенных количеств α - липоевой кислоты экскретируются в неизменном виде [5-8]. Полученные данные показали, что печень обладает большей способностью к захвату и накоплению этих компонентов, что согласуется с данными исследований in vivo. Было показано, что пути, связанные с метаболизмом липоата, проходят в основном через b-окисление боковой цепи валериановой кислоты, а углеродный скелет дитиолового кольца значительно более устойчив к изменениям [7]. Низкие уровни метаболитов предполагают, что в основном назначаемая α - липоевая кислота находится в неизменной форме.
Роль альфа - липоевой кислоты в физиологических процессах клеток эукариотов
Уникальные физико-химические свойства α - липоевой кислоты делают ее сильной и реактивной биологической молекулой, которая была эволюционно выбрана для ряда биохимических реакций, необходимых для окислительного метаболизма и модуляции функций клеток (рис. 1).
Ферменты клеточного метаболизма, восстанавливающие липоевую кислоту
Рис. 1.
Внутриклеточный механизм экзогенно назначаемой α - липоевой кислоты, связанный с протеином. Описана природная α - липоевая кислота, представленная в пяти митохондриальных протеинах, взаимозаменяемая с восстановленной формой ДЛК с помощью энзима Е3
, требующего НАДН/НАД+
. Назначаемая α - липоевая кислота проникает в клетку и восстанавливается с помощью ферментов цитоплазмы глутатион редуктазы и тиоредоксин редуктазы при участии НАДН и митохондриального фермента Е3
. Активность каждого фермента зависит от вида липоевой кислоты и ткани.
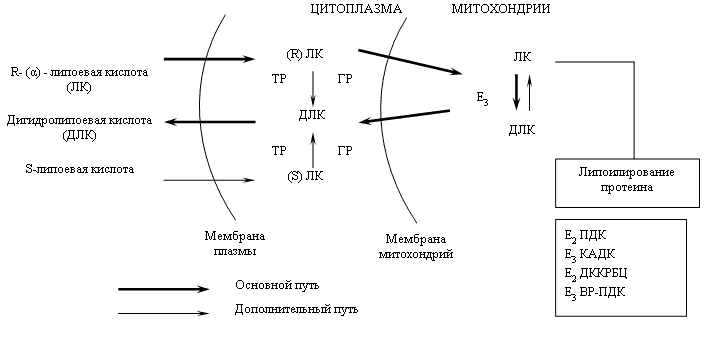
α - липоевая и дигидролипоевая кислоты обладают высокой гидрофобностью, что позволяет им с высокой скоростью проникать через биологические мембраны.
Ниже описываются биологические свойства α - липоевой кислоты, в виде простетической группы связанной с белками и в качестве свободной молекулы взаимодействующей в клеточных системах и в условиях in vitro и in vivo.
α - липоевая кислота связанная с белками
α - липоевая кислота является кофактором дегидрогеназ α – кетокислот и системы расщепления глицина. Эти ферментативные комплексы участвуют в метаболических реакциях окисления пирувата, цикле лимонной кислоты, деградации аминокислот и их биосинтезе.
Комплексы дегидрогеназ с α – кетокислотами. Комплексы дегидрогеназ с α – кетокислотами, в частности пируват-дегидрогеназный комплекс (ПДК), α – кетоглутарат-дегидрогеназный комплекс (α-КГДК), и дегидрогеназный комплекс α – кетокислоты с разветвленной боковой цепью (ДККРБЦ) составляют практически универсальное объединение ферментов. Они располагаются в митохондриальном матриксе, связаны с внутренней мембраной и катализируют окислительное декарбоксилирование различных α – кетокислотных субъектов (пирувата, α – кетоглутарата и укороченных α – кетокислот, образующихся при трансаминировании лейцина, изолейцина и валина) в соответствующие формы ацил-КоА (ацетил-КоА, сукцинил-КоА и изовалерил-КоА), соответственно, с образованием НАДН.
Система расщепления глицина (СРГ). Система расщепления глицина представляет собой мультиферментативный комплекс, располагающийся только в печеночном митохондриальном матриксе и катализирующим окисление глицина СО2 и аммиак с образованием НАДН и (N5 N10 )-метилентетрагидрофолата.
Свободная α - липоевая кислота
Были получены данные, подтверждающие, что свободная α - липоевая кислота может влиять на различные уровни биохимических процессов. Анализировалось взаимодействие α - липоевой кислоты с различными белковыми системами и было показано, что α - липоевая кислота может быть субстратом, ингибитором или эффектором.
Также сообщалось о влиянии свободной α - липоевой кислоты на ферментативную активность системы расщепления глицина [15]. α - липоевая кислота является субстратом для дегидрогеназы липоамида, обнаруженного в сыворотке у людей.
Также изучалось способность α – липоевого / дегидролипоевого комплекса быть донором водорода в реакции, катализируемой селенопероксидазой [18]. Было также показано, что глутатион-редуктаза также использует α - липоевую кислоту в качестве субстрата [19], что приводит к НАДФ-Н-зависимому образованию дигидролипоевой кислоты.
α - липоевая кислота как ингибитор фермента . Также был отмечен ингибиторный эффект α - липоевой кислоты на активность различных ферментов.
Проводился анализ влияния свободной α - липоевой кислоты на каталазную активность.
Было высказано предположение о том, что в развитии осложнений сахарного диабета участвует альдоз-редуктазный механизм вследствие повышения активности альдоз-редуктазы при гипергликемии [28]. Более того, было показано, что ингибиторы альдоз-редуктазы обладают благоприятным действием на развитие катаракты, нефропатии и нейропатии у экспериментальных грызунов с сахарным диабетом. α - липоевая кислота в дозе 0,5 мМ ингибировала активность альдоз-редуктазы, которая активировалась гипергликемией, в хрусталике крыс, который инкубировался 20 часов в присутствии 100 мМ глюкозы [29]. Строение α - липоевой кислоты в виде хелатного кольца с металлом в середине может обеспечивать подобную защиту; однако, нельзя исключить влияния восстановительного потенциала α - липоевой кислоты на альдоз-редуктазные сульфгидридные группы [30].
Дозы α - липоевой кислоты от 500 до 1000 мг считаются хорошо-переносимыми дозами препарата без развития каких-либо побочных эффектов в плацебо-контролируемых исследованиях [31-33].
α - липоевая кислота как белковый модификатор.
Было показано, что дигидролипоевая кислота и структурные аналоги бис- и тетранорлипоат, а также амид из липоамида, восстанавливают дисульфидные группы очищенного тиоредоксина Escherischia coli [14, 35]. Это приводит к усилению активности дисульфид-редуктазы этого малого белка, который является определяющим фактором активности ферментов в клеточных системах. Регуляция активности ферментов осуществляется при тиоловом контроле окисления-восстановления [36].
Было показано в исследованиях in vitro, что дигидролипоевая кислота осуществляет восстановление как метгемоглобина в оксигемоглобин, так и феррил-миоглобина а оксигемоглобин [41]. В аналогичном исследовании было показано, что α - липоевая кислота эффективно взаимодействует с феррилгемоглобином. В зависимости от присутствия перекиси водорода, α - липоевая кислота может либо прямо восстанавливать железо гемма в форме метмиогемоглобина или вступать в реакцию с пирролоновыи кольцом, образуя сульфгидрилмиоглобин.
Также был отмечен in vitro эффект α - липоевой кислоты на структурные модификации бычьего сывороточного альбумина (БСА) и лизосом, индуцированные введением глюкозы [42].
Зависимое от α - липоевой кислоты снижение окислительного образования Nα-(карбоксиметил)-лизина (основного продукта окислительной модификации гликированных протеинов) было недавно показано на примере альбумина сыворотки человека [44]. Более того, α - липоевая кислота препятствовала снижению проницаемости мембран красных кровяных клеток и снижала реактивность протеин-SH-групп в состоянии гипергликемии [45].
Активность α-липоата в качестве очистителя от свободных радикалов (таблица 1)
Дитиоловая природа липоата делает этот компонент высоко активным против ряда реактивных свободных радикалов, но одновременно способствует регенерации окисленных антиоксидантов. Интерес к антиоксидантным свойствам липоата возник после исследований Rosenberg и Culik [46], которые отметили, что назначение α - липоевой кислоты предотвращало развитие симптоматики недостаточности витаминов В и С у морских свинок и витамина Е у крыс.
Различные виды реакций приводят к образованию свободных радикалов. В качестве ответной реакции на воспалительную стимуляцию высокореактивными кислородными ионами отмечалось резкое респираторное увеличение количества нейтрофилов. Образуется супероксид, который в присутствии супер-оксид-дисмутазы, образует Н2 О2 . Далее он конвертируется в НОСl под действием миелопероксидазы.
α - липоевая кислота и дигидроксилипоевая кислота могут способствовать очищению как от перекиси водорода и НОСl, в то время как дигидролипоевая кислота способствует очищению от Н2 О2 [26, 49].
Перекись водорода может вступать в реакцию с переходными металлами с образованием высокоактивных гидроксильных радикалов. Было показано, что α - липоевая и дигидроксилипоевая кислоты способствуют очищению от гидроксильных радикалов в металлокатализирующих системах [23] и при металлосвободной реакции под действием ультрафиолета (УФЛ). При перекисном окислении липидов, образуются пероксильные радикалы с распространением реакции. Дигидролипоевая кислота способствует очищению от этих свободных радикалов, образованных от генераторов гидрофильных пероксильных радикалов [52]. Таким образом, комплекс липоатов представляет собой возможную систему очистки от потенциальных свободных радикалов.
При взаимодействии с активными кислородными ионами антиоксидант превращается в форму, которая более не в состоянии функционировать и разрушается. Таким образом, окисленный продукт должен возвратиться к своей нативной форме для последующего функционирования. Витамин Е, представляющий собой потенциальный очиститель от свободных радикалов, является основным антиоксидантом, разрушающим цепочку и защищающим биологические мембраны от перекисного окисления липидов [53]. Это достаточно трудная задача, так как на 1 молекулу витамина Е приходится примерно 1500 фосфолипидных молекул; однако, окисление мембран не является естественным процессом и витамин Е не является быстро истощающейся субстанцией. Этот явный парадокс может быть объяснен рециклом циркулирующих антиоксидантов. Ряд антиоксидантов могут осуществлять рецикл витамина Е, а также витамина С, убихинолов и глутатиона [54, 55]. Дигидролипоевая кислота имеет очень слабую взаимосвязь с радикалами токоферола, таким образом, большая часть рецикла витамина Е осуществляется посредством дигидролипоевой кислоты через промежуточный рецикл других антиоксидантов. Дигидролипоевая кислота также осуществляет рецикл витамина Е при снижении уровня окисления глутатиона [58], который впоследствии восстанавливает радикалы витамина Е. В настоящее время есть данные о том, что назначение липоата увеличивает уровень тканевого убихинола [59], который также может осуществлять рецикл витамина Е.
Таким образом, существует комплекс антиоксидантов, с которыми может взаимодействовать дигидролипоевая кислота и поддерживать как липидный, так и водный антиоксидантный статус.
Влияние α - липоевой кислоты в качестве металлической хелатной структуры (хелатное кольцо с металлом внутри) (таблица 1)
Таблица 1.
Резюме антиоксидантных и метаболических эффектов комплекса α – липоат/дегидролипоат in vitro
| Действие | Эффект | Литература |
| Участие липоата в очищении от активных кислородных радикалов Взаимодействие липоата с другими антиоксидантами Влияние назначаемого липоата на метаболические процессы |
Очищение от ОН2
, О2 , 1 О2 , ROO, HOCl, Металл в хелатном кольце Восстановление GSSG Рецикл витамина С/Е Рецикл убихинона Восстановление тиреоредоксина НАДН/НАДФ Увеличение соотношения АД/НАДН Увеличение внутриклеточного GSN Стабилизация увеличения внутриклеточного Са2+ , обусловленного окислением Ингибирование активации NF-kB |
50, 51, 52 26, 49 70 57 47, 48 61, 62 58 52, 56, 57 59 71 57 72 67 73 74 |
В дополнение к вышеописанным свойствам, α - липоевая кислота и дигидролипоевая кислоты могут включать в хелатное кольцо ряд ионов металлов, включая Cu2+ , Fe3+ [61], Mn2+ , Zn2+ и Cd2+ [62]. Включение в хелатное кольцо Cu2+ α - липоевой кислотой приводит к 1) ингибированию Cu2+ -катализируемого окисления in vitro; 2) способствует разделению Cu2+ в n-октанол, и 3) ингибируютпоступление H2 O2 , индуцируемое в пределах эритроцитов под воздействием аскорбиновой кислоты [63]. Было показано in vitro, что дигидролипоевая кислота, также как и дигидролипоамид, может перемещать железо, находящееся внутри ферритина, с образованием комплекса в виде ферритной формы. Скорость реакции увеличивается в зависимости от соотношения дигидролипоевая кислота/ферритин, на нее не влияет содержание железа в ферритине и реакция является рН зависимой [64].
Влияние α - липоевой кислоты на метаболизм глутатиона. Модификация клеточного глутатионового статуса в течение длительного времени была предметом потенциальной терапевтической оценки, так как считалось, что снижение глутатиона отмечается при ряде детоксических реакций против окисленных радикалов, образующихся при метаболизме ксенобиотиков. Влияние α - липоевой кислоты на клеточный статус глутатиона исследовалась в различных in vitro и in vivo системах (человеческие клеточные линии Т-лимфоцитов, глиальных С6, нейробластомных, Jurkat, Wurzburg клеток, эритроцитов человека и периферических лимфоцитов крови) назначение α – липоевой кислоты (10-100 mM) приводило к увеличению клеточного уровня глутатиона на 30-70 % [22, 67, 68]. Увеличение тканевого уровня глутатиона в легких, печени и почках с одновременным улучшением выживаемости после облучения всего тела отмечалось у крыс через 11 дней после интраперитонеального введения липоевой кислоты в дозах 4,8-16 мг/кг/д [68]. Увеличение уровня общего глутатиона в печени и крови, но не в почках, сердце и скелетной мускулатуре крыс, отмечалось после интрагасторального назначения липоата (150 мг/кг в течение 8 недель).
α - липоевая кислота как метаболический регулятор
Вскоре после того, как было показано, что α - липоевая кислота является ферментативным кофактором окислительного метаболизма, проводился ряд исследований по изучению ее влияния на углеводный и липидный обмены.
Влияние α - липоевой кислоты на углеводный обмен
Данные ранних исследований показывают, что α - липоевая кислота может улучшать углеводный обмен посредством влияния на разные звенья метаболизма.
Лечение морских свинок (весом 250 г) α - липоевой кислотой (0,5 мг) в течение 10 дней постепенно повышало уровень молочной кислоты (30% увеличение от контрольного уровня), и снижало уровень лимонной кислоты (60% снижение по сравнению с контрольной группой) [76]. На основании полученных данных, было высказано предположение, что α - липоевая кислота стимулировала анаэробную конверсию пирувата в лактат, реакцию, которая, по мнению других авторов может идти в двух направлениях [77, 78].
Печень играет основную рольв поддержании и модулировании уровня гликемии в сыворотке крови ( в пределах между 80 и 120 мг/100 мл) посредством глюкогенолиза, гликолиза и глюконеогенеза. Одной из основных патогенетических характеристик сахарного диабета 2 типа является инсулинорезистентность, приводящая к развитию гиперинсулинемии. Недавние исследования экспериментального сахарного диабета 1 и 2 типов показали, что α - липоевая кислота стимулирует захват глюкозы в перфузированные сердца нормальных крыс и крыс с сахарным диабетом. Haugaard [80] отметили увеличение утилизации глюкозы в диафрагме крыс in vitro после назначения α - липоевой кислоты. Аналогичная стимуляция глюкозотранспортной активности α - липоевой кислотой отмечалась в изолированной эритрохлеарной мышце как у худых инсулиночувствительных, так и у инсулинорезистентных с ожирением крыс [135].
Дозо-зависимое увеличение захвата глюкозы отмечалось в L6 мышечных клетках и адипоциатх после терапии α - липоевой кислоты из-за транслокации Glut-1 и Glut-4 транспортеров из внутриклеточного пула в мембрану [136]. При экспериментальном сахарном диабете 1 типа (крысы со стрептозотоционвым сахарным диабетом) терапия α - липоевой кислотой увеличила концентрацию Glut-4 в мышцах [138]. Jacob et al. [81] показали, что терапия α - липоевой кислотой (100 мг/кг в течение 10 дней) способствовала улучшению 1) инсулинозависимой утилизации 2-дезоксиглюкозы; 2) окисления глюкозы; 3) синтеза гликогена, и 4) снижала уровень инсулина и жирных кислот плазмы,
9-09-2015, 00:25
