Таблица 4. Константы связывания 3 Н-ДАДЛЭ с центральными ОР крыс с различным уровнем тревожности в ПКЛ
| Число выходов в откр. рукава | Обонятельные луковицы | Стриатум | |||
Кд (нМ) |
Вмах (фмоль/мг белка) |
Кд (нМ) |
Вмах (фмоль/мг белка) | ||
ин- такт- ные |
0 | 2.6±0.3 (3) | 180±6## (3) | 2.3±0.3 (3) | 67±12#** (3) |
| 1–2 | 2.6±0.1# (6) | 178±28 (6) | 2.4±0.3 (4) | 81±9#* (4) | |
| 3–5 | 3.6±0.4 (3) | 261±15 (3) | 2.6±0.2 (4) | 132±12* (4) | |
| стресс | 0 | 3.8±0.1# (4) | 203±49 (4) | 2.5±0.5* (4) | 88±15* (4) |
| 1–2 | 2.6±0.5 (5) | 147±16 (5) | 2.7±0.5 (10) | 103±27 (10) | |
* – p<0.05, ** – p<0.01 – отличие констант связывания в различных отделах мозга,
#,## – p<0.05, 0.01 – отличие от низкотревожных (по соответствующей группе) животных
Приведены средние значения ± ошибка среднего.
В результате использованного типа стрессорного воздействия происходит выраженное увеличение тревожности крыс, на фоне которого, как показано нами ранее, проявляется анксиолитический эффект даларгина, при этом на интактных животных препарат не влияет (табл. 1). По-видимому, длительный выброс эндогенных опиоидов в результате хронического стресса приводит к истощению их запасов. Даларгин в этих условиях оказывает анксиолитическое действие по компенсаторному механизму.
С другой стороны, известно, что в результате длительного контакта с агонистами может происходить десенситизация рецепторов. В частности, выброс эндогенных опиоидов при хроническом стрессе приводит к десенситизации ОР, причем δ-ОР более подвержены этому процессу, чем μ-ОР (Gaudriaultetal., 1997, Kim etal., 2003, Narita etal., 2006). В нашем исследовании радиолигандный анализ не выявил существенных изменений констант связывания 3Н-ДАДЛЭ в стриатуме крыс в результате стресса. В то же время Кд этого лиганда с ОР обонятельных луковиц у НА крыс значительно возросла и стала почти в 2 раза выше, чем у ВА крыс (табл. 4). Эта разница примерно соответствует литературным данным о соотношении аффинности ДАДЛЭ к μ- и δ-ОР (Leslie, 1987, Minami, Satoh1995, Georgeetal., 2000). То есть можно предположить, что в обонятельных луковицах ВА крыс доминируют δ-ОР, а у НА животных в этом отделе мозга в результате стресса произошла десенситизация этих рецепторов и доминируют μ-ОР. Обонятельные луковицы играют существенную роль как в исследовательской активности грызунов, так и в формировании тревоги и депрессии, что подтверждено в экспериментах с бульбектомией (Song, Leonard, 2005). Исследовательская активность является, одним из главных факторов, определяющих поведение животных в тесте ПКЛ. Десенситизация δ-ОР в обонятельных луковицах НА, но не ВА крыс (табл. 4), по-видимому, является одной из причин того, что даларгин, более селективный лиганд δ-ОР, чем μ-ОР, оказывает анксиолитическое действие только на ВА животных (табл. 1).
Известно также, ДАДЛЭ обладает более высокой аффинностью к δ1‑ОР, чем к δ2‑ОР (Minami, Satoh, 1995). Поэтому низкую аффинность ОР обонятельных луковиц НА крыс можно объяснить доминированием там δ-ОР второго типа. Фармакологические данные, полученные в данном исследовании подтверждают это предположение: анксиолитический эффект даларгина при центральном введении у ВА крыс блокируется антагонистами обоих подтипов δ-ОР, а у НА крыс – налтрибен, селективный антагонист δ2‑ОР, не блокирует анксиолитическое действие даларгина (табл. 2). Из литературных данных следует, что роль δ2‑ОР в противотревожном действии эндогенные опиоидов более существенна, чем δ1‑ОР, поскольку налтрибен, но не BNTX оказывает анксиогенное действие на животных (Saitohetal., 2005). Схожесть некоторых функций δ2- и μ-ОР может быть следствием того, что свойствами δ2‑ОР обладает гетеродимер μ- и δ-ОР, связанных между собой внутриклеточными С-концевыми участками (Fanetal., 2005). В зависимости от активности синтеза отдельных рецепторных белков в различных органах и, возможно, отделах мозга варьируют формы олигомеризации ОР (Georgeetal., 2000), что также может являться причиной вариабельности биологических эффект опиоидов, в частности, их участия в регуляции тревожности.
Как упоминалось ранее, в тесте Вогеля анксиолитическое действие даларгина более выражено у НА крыс. В этом тесте оценивается способность животных преодолевать конфликт между питьевой мотивацией и болевым раздражением, сопровождающим лизание поилки. Поэтому поведение животных в тесте Вогеля в значительной степени зависит от их болевой чувствительности, в регуляции которой μ-ОР играют более существенную роль, чем δ-ОР (Gaveriaux-Ruff, Kieffer, 2002). Можно предположить, что μ-ОР доминируют не только в обонятельных луковицах (табл. 4), но и в тех отделах мозга НА крыс, которые отвечают за ноцицепцию. Если это предположение верно, то анксиолитический эффект даларгина на НА крыс в тесте Вогеля можно отчасти объяснить его обезболивающим действием, опосредуемым μ-ОР.
Таким образом, в зависимости от состояния ОР, их соотношения в различных отделах мозга, анксиолитическое действие препаратов, взаимодействующих с этими рецепторами, может по-разному проявляться в разных тестах. Как исходный уровень тревожности, так и возможность воздействия на него экзогенно вводимыми опиоидами зависят от состояния ОР и от содержания эндогенных опиоидов в их микроокружении.
К эндогенным опиоидам, в первую очередь относят опиоидные пептиды, среди которых наиболее распространены и изучены энкефалины. Энкефалины – одни из самых короткоживущих регуляторных пептидов. Период их полураспада исчисляется минутами. Поэтому активность ферментов деградации энкефалинов может играть существенную роль как в поведенческих проявлениях тревожности у животных, так и в предрасположенности и формировании некоторых форм тревожных расстройств у людей. Попытка обнаружить взаимосвязь между активностью ЭДФ в целом мозгу мышей и выраженностью поведенческих проявлений тревожности в нашем исследовании не дала убедительных результатов. Это не удивительно, поскольку существует целый ряд ферментов, участвующих в деградации энкефалинов, и их активность существенно варьирует в различных отделах мозга (Gorenstein, Snyder, 1980). Более подробное исследование активности конкретных ферментов в различных отделах мозга, ответственных за реализацию отдельных поведенческих проявлений тревожности, безусловно, дадут положительные результаты.
Удалось также обнаружить взаимосвязь между поведенческими характеристиками и активностью ЭДФ, а также содержании эндогенных опиоидов в плазме крови животных. Так, разделение крыс на 3 группы в соответствии с исходной двигательной активностью в ATSпродемонстрировало, что в условиях стресса тестирования в «челночной камере» у крыс с высокой двигательной активностью (ВА) содержание лигандов ОР μ-типа в плазме крови достоверно выше, чем у остальных животных. У низкоактивных (НА) крыс обнаружено пониженное содержание лигандов ОР δ-типа (табл. 5).
Таблица 5. Активность лигандов ОР (пмоль-экв. ДАГО или ДАДЛЭ/мл) в плазме крови крыс с различной двигательной активностью в ATS
| Тип лигандов ОР | Двигательная активность животных | ||
| низкая (n=28) | средняя(n=28) | высокая(n=28) | |
| μ – (3Н-ДАГО) | 55,5±3,1 ** | 57,8±3,0 | 70,7±4,1 |
| δ – (3Н-ДАДЛЭ) | 57.6±2.4**++ | 76.6±6.1 | 82.0±5.1 |
** – p<0.01 – отличие от высокоактивных крыс,
++-p<0.01, +-p<0.05 – отличие от крыс со средней двигательной активностью,
Приведены средние значения ± ошибка среднего.
Обнаружены различия в активности ЭДФ плазмы крови мышей Balb/c и C57black/6 в условиях тестирования их в ОП, эмоционально-стрессовая реакция на которое у мышей этих линий кардинально отличается. Скорость деградации лей-энкефалина (150 нМ) в плазме крови мышей линии Balb/с, проявляющих повышенный уровень тревожности в ОП, составляет 50±6 нМ/мин, что на 30% выше (p<0.05), чем у низкотревожных в этом тесте мышей C57Black/6 (38±5 нМ/мин). Можно предположить, что повышенная скорость гидролиза эндогенных опиоидных пептидов является одной из биологических причин высокой тревожности животных, а фармакологические воздействия, направленные на замедление гидролиза энкефалинов, могут оказывать анксиолитическое действие.
Влияние селанка на опиоидную систему
Новый пептидный препарат селанк, синтезированный в ИМГ РАН, в преклинических испытаниях, проведенных в ГУ НИИ Фармакологии им. В.В. Закусова РАМН, проявил себя как анксиолитик, обладающий также ноотропным и стресс-протективным действием (Середенин и соавт., 1995, 1996, 1998). Вместе с тем, биологический механизм его действия до конца не изучен. Мы исследовали возможность участия опиоидной системы в механизме анксиолитического эффекта селанка.
Радиорецепторным способом было показано, что селанк и его тетрапептидный фрагмент тафтсин способны вытеснять Н-ДАДЛЭ из ОР головного мозга крыс, но в концентрациях, в 10000 и в 200 раз, соответственно, превышающих концентрацию метки. То есть мало вероятно, что механизм действия селанка опосредован его взаимодействием ОР, обладающими выраженной аффинностью к ДАДЛЭ (δ и μ-ОР).
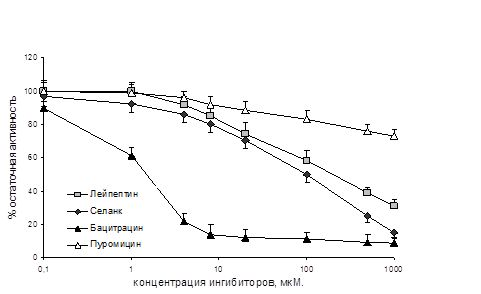
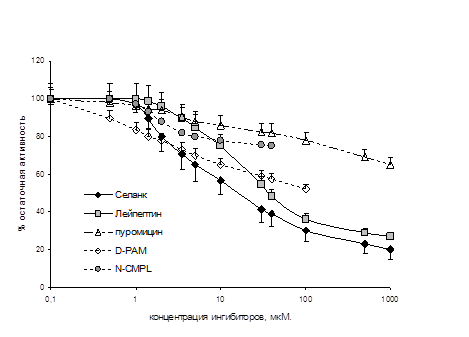
В то же время, была продемонстрирована способность селанка и его пептидных фрагментов, тафтсина и Pro-Arg-Pro-Gly-Pro, замедлять скорость гидролиза лей-энкефалина ферментами плазмы крови человека и Р2 мембранной фракции мозга крысы (рис. 2). Способность ингибировать ЭДФ у селанка была более выражена, чем у таких известных ингибиторов энкефалиназ, как N-CMPL, D-PAM, лейпептин и пуромицин, но менее выражена, чем у бацитрацина (рис. 2).
Более подробное исследование с использованием ВЭЖХ продуктов гидролиза [G3 H] – лей-энкефалина показало, что в тех условиях, когда селанк в 2 раза снижает активность аминопептидаз (основной группы ферментов, участвующих в деградации энкефалинов), он полностью блокирует гидролиз лей-энкефалина карбокси- и дикарбоксипептидазами (табл. 6). То есть можно предположить, что его сродство к ферментам последних двух групп выше, чем к аминопептидазам.
 Б
Б
Рисунок 2. Ингибирующее действие селанка на энкефалиндеградирующие ферменты сыворотки крови человека (А) и Р2 мембранной фракции мозга крысы (Б)
При изучении процесса биодеградации [G3 H] – селанка в плазме крови крысы invitro обнаружилось, что в первую очередь его гидролиз происходит под действием дикарбоксипептидаз с последовательным отщеплением Gly-Pro, и Arg-Pro с С-конца. По этому же пути происходит гидролиз селанка в присутствии одной из основных дикарбоксипептидаз, участвующих в деградации энкефалинов – АПФ.
Таблица 6. Влияние селанка на активность ЭДФ плазмы крови человека invitro
| Группы ЭДФ | фрагменты | Концентрация фрагментов (нМ) | |||
| t гидролиза (мин) | Контроль | селанк 15 мкМ | |||
| 30 | 30 | 90 | 120 | ||
| субстрат | YGGFL | 167 | 297 | 154 | 146 |
| Амино- | Y | 250 | 127 | 253 | 273 |
| пептидазы | GGFL | 216 | 100 | 202 | 228 |
| Диамино- | YG | 9 | 4 | 11 | 14 |
| пептидазы | GFL | 7 | 0 | 0 | 0 |
| Дикарбокси- | YGG | 19 | 1 | 3 | 5 |
| пептидазы | FL | 38 | 3 | 12 | 17 |
| Карбоксипептидазы | YGGF | 30 | 0 | 0 | 0 |
| другие фрагменты | GGF | 8 | 0 | 0 | 0 |
| GF | 21 | 0 | 0 | 0 | |
| F | 0 | 0 | 16 | 27 | |
Исходная концентрация 3Н-лей-энкефалина в инкубационной среде – 560 нМ.
Разделение продуктов ферментативного гидролиза проводили методом ВЭЖХ на колонке «Хромасил» 4x150 мм. Элюцию вели в линейном градиенте ацетонитрила в 0.1% ТФУ, скорость элюции 1 мл/мин при комнатной температуре.
Представлены типичные результаты одного из трех независимых экспериментов.
Среди продуктов деградации [G3 H] – селанка в плазме крови крысы не обнаружен гексапептид KPRPGP, что свидетельствует о том, что моноаминопептидазы не участвуют в его гидролизе. Таким образом, селанк ингибирует ЭДФ, являясь субстратом для дикарбоксипептидаз, но не для моноаминопептидаз. Субстратами этих пептидаз являются, кроме энкефалинов, ряд других регуляторных пептидов, которые также участвуют в регуляции тревожности. Тем не менее, некоторые поведенческие эффекты селанка обусловлены его воздействием именно на опиоидную систему, о чем свидетельствует способность налоксона блокировать эти эффекты. Так, налоксон блокирует депримирующий эффект селанка на индуцированные апоморфином поведенческие проявления гиперфункции дофаминовой системы в тесте «вертикализации» мышей (Мешавкин и соавт., 2006).
Роль опиоидной системы в реализации анксиолитического действия селанка была подтверждена в экспериментальных исследованиях invivo. На фоне повышенного уровня тревожности, вызванного процедурным стрессом внутрибрюшинного введения препарата, селанк оказывал блокируемое налоксоном анксиолитическое действие на мышей Balb/c в тесте ПКЛ (рис. 3). Причем этот эффект был значительно более выражен у мышей с исходно высокой спонтанной двигательной активностью в системе Rat-o-Matic (рис. 3), аналогично анксиолитическому эффекту даларгина, наблюдавшемуся в ПКЛ лишь у ВА (в ATS) крыс (табл. 1). Отсутствие снижения тревожности НА крыс под действием даларгина мы связывали с недостаточной экспрессией δ-ОР в некоторых отделах их мозга. Возможно, у НА мышей Balb/c наблюдается сходная картина: энкефалины, скорость гидролиза которых замедляет селанк, способны взаимодействовать как с δ-, так и с μ-ОР, оказывая через первые «противо-», а через вторые – «протревожное» действие. У НА мышей налоксон не блокирует, а наоборот, сам оказывает и усиливает анксиолитическое действие селанка (рис. 3), по-видимому, за счет блокады μ-ОР. Снижение тревожности при введении налоксона наблюдается у мышей с нокаут геном δ-ОР (Filliol etal., 2000), а также у высокотревожных мышей 129S2/SvHsd, не чувствительных к бензодиазепинам (Rodgersetal., 2006).
Анализ поведения мышей Balb/c в центральном квадрате ПКЛ, которое, с некоторой долей условности, можно рассматривать как аналог психомоторной активности животных, показал, что помимо анксиолитического селанк может оказывать психостимулирующее действие. Причем этот эффект более выражен у НА мышей и не блокируется, а наоборот усиливается налоксоном, хотя в данном случае сам налоксон не влиял на эту форму поведения животных. По литературным данным, как эндогенные (Gaveriaux-Ruff, Kieffer, 2002), так и экзогенно вводимые опиоиды влияют на локомоторную активность животных (Sandi, 1992, Baamondeetal., 1992, Jangetal., 2001, Schadetal., 2002). То есть психостимулирующий эффект селанка также может быть связан с активацией опиоидной системы.
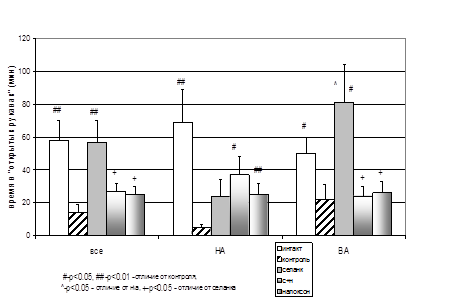
Рисунок 3. Влияние селанка на время нахождения в «открытых рукавах» ПКЛ мышей Balb/c с высокй (ВА) и низкой (НА) исходной двигательной активностью в системе Rat-o-Matic
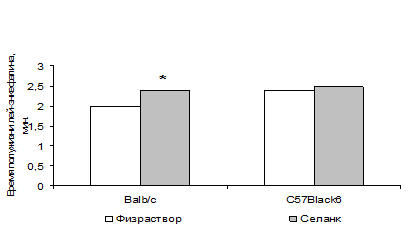
Рисунок 4. Влияние селанка на активность ЭДФ плазмы крови мышей Balb/с и C57Black/6, в условиях тестирования в «открытом поле» – эффект селанка, р<0.05
Как было продемонстрировано ранее, активность ЭДФ в плазме крови мышей Balb/с с фенотипом повышенной тревожности в тесте ОП существенно выше, чем у C57Black/6, эмоционально стабильных в этом тесте. При этом показано, что в тесте ОП селанк оказывает анксиолитическое действие на мышей Balb/с, но не C57Black/6 (Середенин и соавт., 1996). Мы воспроизвели вышеупомянутый поведенческий эксперимент, а затем у тех же животных измерили скорость гидролиза Н-лей-энкефалина в плазме крови и гомогенате мозга. Было установлено, что введение селанка (внутрибрюшинно, 100 мкг/кг) параллельно со снижением тревожности достоверно снижает скорость распада энкефалина в плазме крови мышей линии Balb/с. Вместе с тем, препарат не изменяет поведение мышей C57Black/6 и не влияет на активность энкефалиндеградирующих ферментов в плазме их крови (рис. 3). При этом достоверных изменений в активности ЭДФ гомогената мозга при введении селанка, ни у Balb/с, ни у C57Black/6 не наблюдается. Таким образом, можно утверждать, что один из механизмов поведенческих эффектов селанка связан с действием на опиоидную систему, поскольку анксиолитическое действие селанка на мышей Balb/с, регистрируемое в тесте ПКЛ, блокируется антагонистом ОР налоксоном, а анксиолитический эффект препарата на поведение мышей Balb/с, но не C57Black/6 в тесте «открытое поле» сопровождается снижением скорости распада энкефалинов в крови мышей Balb/с, но не C57Black/6.
Учитывая продемонстрированные в данном исследовании (табл. 1, 2) и неоднократно подтвержденные в дальнейшем другими авторами данные о «противотревожной» роли экзогенно вводимых агонистов δ-ОР (Vivian, Miczek, 1998, Saitoh etal., 2005, Perrineetal., 2006) и эндогенных опиоидных пептидов, в частности, энкефалинов (Ragnauth etal., 2001, Bilkei-Gorzo etal., 2004, McNallyetal., 2004, Saitoh etal., 2004, 2005, Narita etal., 2006, Perrineetal., 2006), можно предположить, что высокая скорость гидролиза последних является одной из патогенетических причин повышенной тревожности. В связи с этим нами было проведено исследование активности ЭДФ в плазме крови здоровых людей с различными личностными проявлениями тревожности и больных с разными формами тревожных расстройств.
Известно, что гидролиз энкефалинов в организме происходит по всем пептидным связям и катализируется целым рядом ферментов. В данном разделе исследования оценивали суммарную активность ЭДФ в плазме крови людей invitroпо скорости гидролиза равномерно меченного тритием лей-энкефалина. Активность ЭДФ оценивали по двум параметрам: при насыщающих концентрации субстрата определяли максимальную скорость реакции (Vmax, по кривой Михаэлиса-Ментен), являющуюся суммой действующих концентраций всех ЭДФ, при малых концентрациях субстрата – время полупревращения энкефалина (τ1/2 ), отражающее реальную скорость гидролиза этого пептида в биологических объектах.
На первом этапе были рассмотрены возможные связи параметров энкефалиназной активности с данными психологического тестирования по тесту Айзенка. Данный тест позволяет определить уровень невротизации и интровертированности личности (рис. 5). Известно, что в зависимости от конституционально-личностных особенностей организма в условиях стресса возможно развитие широчайшего спектра психоэмоциональных и соматических реакций.На одном полюсе этого спектра – «репрессивный стиль преодоления» людей-интровертов, сопровождающийся подавлением внешних проявлений эмоционального напряжения, угнетением секреции катехоламинов и активация гипофизарно-надпочечниковой системы, приводящая к выбросу опиоидных пептидов в кровь. На другом – «экспрессивная стратегия преодоления» экстравертов, сопровождающаяся высоким уровнем активации симпатоадреналовой системы при отсутствии выраженной реакции со стороны опиоидной системы (Banduraetal. 1990; Schroederetal., 2000, Зозуля и соавт., 2006).
В подтверждение этого обнаружена обратная корреляционная связь уровня экстравертированности личности с τ 1/2 энкефалина по всей выборке обследованных людей (R = -0.41, p<0.01). Вероятно, у экстравертированных личностей, к которым относятся сангвиники, не существует, так называемой, сдерживающей реакции опиоидов, что подтверждается низким значением τ 1/2 лей-энкефалина. И, наоборот, у таких интровертов, как флегматики, реакция опиоидной системы гораздо более выражена, именно здесь она выступает в роли стресс-лимитирующей системы, подавляя вегетативные реакции на стресс или тревогу.
По-видимому, в условиях адекватного функционирования опиоидной системы не происходит избыточной активации симпатоадреналовой системы, эмоциональных срывов, перехода физиологической фазы стресса в патофизиологическую. Можно полагать, что высокое τ 1/2 лей-энкефалина в плазме крови флегматиков является фактором, повышающим их адаптационные возможности. Напротив, у меланхоликов τ 1/2 лей-энкефалина достоверно ниже, чем у флегматиков (рис. 5). Адаптационные возможности людей с этим типом темперамента снижены и они наиболее предрасположены к тревожным расстройствам (Gershuny, 1998).
Аналогичное предположение можно было бы сделать и относительно холериков и, особенно, сангвиников, обладающих минимальным τ 1/2 лей-энкефалина (рис. 5). Однако, существуют данные, что у экстравертов (холериков и сангвиников) опиоидная система в условиях развития хронической стрессовой реакции, по-видимому, не играет ключевой роли (Bohnenetal., 1991; Biondiet.al, 1994; Bruehletal., 1994). Здесь, возможно, стресс-лимитирующую роль играют другие системы.
Обнаруженная зависимость τ 1/2 лей-энкефалина от темперамента людей не распространяется на Vmax, значение которого во всех группах неизменно (рис. 5). То есть, высокое значение τ 1/2 лей-энкефалина в крови флегматиков обусловлено, по-видимому, не низкой активностью ферментов, а повышенным содержанием их эндогенных ингибиторов. Полученные данные согласуются с данными Marini и соавт. (1999), также обнаружившими индивидуальную
8-09-2015, 22:33
