Шкала невротизма (эмоциональной нестабильности) в определённой степени отражает уровень тревожности, предрасположенности к тревожным расстройствам, которые формируются под воздействием как генетически обусловленных факторов, так и факторов окружающей среды. В подтверждение этому, в нашем исследовании была обнаружена корреляционная связь между уровнем личностной (врожденной) тревожности по тесту Спилбергера и показателями теста Айзенка у обследованных людей: положительная с невротизмом и отрицательная с экстравертированностью. Свидетельством компенсаторной роли опиоидной системы, видимо, можно считать достоверную прямую корреляцию между τ 1/2 лей-энкефалина в плазме крови и уровнем личностной тревожности, определяемой по тесту Спилбергера, т.е. высокий уровень врожденной тревожности у здоровых людей компенсируется низкой скоростью деградации энкефалина (табл. 7). Как видно из таблицы 7, высокий уровень врожденной тревожности по Спилбергеру сопровождается максимально высоким τ 1/2 энкефалина в крови, а лица с низким уровнем врожденной тревожности характеризуются минимальным значением этого параметра. При этом высокая скорость гидролиза лей-энкефалина в плазме крови людей с низким уровнем тревожности не связана с повышенным содержанием ЭДФ, т. к. значение Vmax, отражающее истинную концентрацию этих ферментов, в плазме крови этих людей достоверно ниже, чем у лиц с умеренной тревожностью. По-видимому, относительно высокое τ1/2 лей-энкефалина у людей с умеренной и высокой тревожностью поддерживается за счет наличия в их крови эндогенных ингибиторов энкефалиназ.
Таблица 7. Зависимость активности ЭДФ плазмы крови человека от уровня личностной тревожности, определяемой по тесту Спилбергера
| Уровень личностной тревожности | |||
| низкая | умеренная | Высокая | |
| τ1/2 , (мин) | 2.50±0.20* # (n=12) |
3.11±0.18 (n=24) |
3.65±0.22* (n=14) |
| Vmax, (мМ/мин) | 0.14±0.02* (n=12) |
0.21±0.02 (n=26) |
0.17±0.03 (n=14) |
* – p < 0.05, отличие от лиц с умеренной тревожностью,
# – p < 0.01, отличие между людьми с высокой и низкой тревожностью.
Итак, энкефалиназная активность плазмы крови связана с темпераментом здоровых людей (рис. 5), τ1/2 лей-энкефалина в плазме крови обратно коррелирует с уровнем экстравертированности и прямо – с уровнем личностной тревожности (табл. 7). Предполагается, что эти отличия, в первую очередь, обусловлены уровнем эндогенных ингибиторов энкефалиназ.
На следующем этапе были обследованы больные с различными формами тревожно-фобических расстройств по DSM‑4 (табл. 8). Выяснилось, что достоверные отличия показателей активности ЭДФ от регистрируемых в контроле величин наблюдаются при генерализованном тревожном расстройстве (ГТР). При паническом расстройстве значения параметров приближаются к норме, а при агорафобии даже превышают контрольный уровень (таблица 8), что, по-видимому, отражает поведенческую адаптацию: поведение избегания позволяет исключить стрессогенную при агорафобии ситуацию. Обнаружены корреляционные связи показателей активности ЭДФсо степенью выраженности вегетативных расстройств по Вейну и характеристиками панических атак, определяемых по методу Шихана, которые являются, по-видимому, отражением компенсаторной роли опиоидов в условиях реактивных расстройств, наблюдаемых у обследуемых больных.
Следует отметить, что при ГТР наблюдается одновременное снижение величин τ 1/2 и Vmax лей-энкефалина в плазме крови (табл. 8), что может быть связано с недостатком ингибиторов энкефалиназ при ГТР. То есть, истощение эндогенной опиоидной системы, выражающееся в недостатке эндогенных ингибиторов ЭДФ, по-видимому, является одним из механизмов стресс-индуцированных нарушений, существенных в патогенезе некоторых видов тревожных расстройств. Полученные в нашем исследовании данные позволяют предполагать, что ГТР является одной из таких нозологий. То есть стимуляция опиоидной системы с использованием синтетических аналогов опиоидных пептидов и / или ингибиторов энкефалиназ может рассматриваться в качестве патогенетически обоснованной терапии ГТР.
Таблица 8. Активность ЭДФ плазмы крови больных с разными формами ТФР
| Диагноз по DSM‑4 | τ1/2 (мин) | Vmax,(мМ/мин) |
| Генерализованное тревожное расстройство (n=13) | 2.6±0.2 # | 0.12±0.03 # |
| Паническое расстройство (n=14) | 3.2±0.2 * | 0.16±0.04 |
| Агорафобия (n=11) | 4.0±0.3 * ´´ | 0.18±0.04 |
| Здоровые доноры (n=15) | 3.1±0.3 | 0.20±0.02 |
# – p < 0.01 отличие от здоровых доноров, * – р < 0.01 отличие от ГТР, ´´– р < 0.05 отличие от панического расстройства.
Приведены средние значения ± ошибка среднего.
Было высказано предположение, что для этих больных терапия селанком может оказаться эффективной (Зозуля и соавт., 2001). Действительно, вторая фаза клинических испытаний селанка показала его эффективность при лечении ГТР (Neznamovetal., 2005). Более того, по данным, любезно предоставленным А.В. Андрющенко (НЦ ПЗ РАМН), эффективность селанка при ГТР более выражена, чем при смешанном тревожно-депрессивном расстройстве и депрессивном эпизоде. Изучение зависимости биологических эффектов селанка от темперамента больных показало, что в результате лечения этим препаратом τ 1/2 лей-энкефалина в плазме крови интровертированных (по Айзенку) больных возрастает. Напротив, у больных с преобладанием экстраверсии этот параметр после лечения селанком не изменяется или даже снижается.
Данные, полученные в рамках третьей фазы клинических испытаний этого препарата, показали, что у больных ГТР и неврастенией наблюдается пониженный уровень τ 1/2 лей-энкефалина в сыворотке крови, который коррелирует с длительностью заболевания и выраженностью проявлений тревоги, астении и ряда других симптомов, а также вегетативных расстройств. Обнаруженный в данном исследовании преимущественно положительный характер корреляций между τ 1/2 и клиническими показателями можно трактовать двояко. На первый взгляд, тот факт, что чем ниже скорость деградации лей-энкефалина в крови больных, тем сильнее выражена тревожность и / или другие сопутствующие ей симптомы, свидетельствует о противотревожной роли энкефалиндеградирующих ферментов. Однако в настоящее время существуют многочисленные экспериментальные данные о том, что эндогенные опиоидные пептиды, в частности, энкефалины выполняют противотревожные функции в ЦНС, а ингибиторы ферментов деградации энкефалинов оказывают анксиолитическое действие (Gaveriaux-Ruff, Kieffer, 2002, Perrine, 2006).
В данном исследовании мы оценивали скорость гидролиза лей-энкефалина в сыворотке крови больных, что является косвенным отражением процессов, происходящих в ЦНС. Известно, что опиоидная система, наряду с другими пептидергическими системами, выполняет стресс-лимитирующие функции в организме. В частности, в условиях стресса происходит выброс опиоидных пептидов, в том числе, энкефалинов в кровь, через которую они реализуют свои компенсаторные функции на периферии. Наличие эндогенных энкефалинов в сыворотке крови должно уменьшать наблюдаемую скорость гидролиза меченого лей-энкефалина, по которой мы определяем τ 1/2 в данном исследовании. Возможно, в регуляции тревоги опиоидная система играет такую же компенсаторную роль, как и в стресс-реакции. Для адекватного функционирования организма в условиях повышенной тревожности нормальным является пропорциональная активация стресс-реализующих (катехоламины и глюкокортикоиды) и стресс-лимитирующих (регуляторные пептиды) систем. Примером может служить полученная нами ранее положительная корреляция между τ 1/2 лей-энкефалина в плазме крови здоровых людей и уровнем их врожденной тревожности по Спилбергеру (R=0.32, p<0.05, n=27) и концентрацией кортизола в плазме крови (r=0.58, p<0.05, n=27). По-видимому, в норме этой компенсаторной функции достаточно, для предотвращения развития патологических симптомов, а при ГТР, на фоне сниженного среднего значения τ ½, т.е. повышенной скорости ферментативного гидролиза энкефалинов, опиоидная система не обеспечивает подобной компенсации.
Кроме того, известно, что эти ферменты участвуют в гидролизе не только энкефалинов, но и многих других регуляторных пептидов, секретируемых в кровь в условиях стресса (Соколов и соавт., 2007). Эти пептиды могут замедлять процесс деградации лей-энкефалина по механизму субстратной конкуренции. Многие регуляторные пептиды, как и энкефалины выполняют стресс-лимитирующие функции, а в сумме они играют роль буфера, поддерживающего нормальное функционирование организма в условиях отклонения от гомеостаза. Таким образом, исследуемый нами параметр косвенно отражает степень активации системы регуляторных пептидов, ее способность поддерживать гомеостаз в условиях повышенной тревожности.
Клинические испытания продемонстрировали высокую эффективность селанка при терапии больных ГТР и неврастенией. Анксиолитическое действие этого препарата сравнимо с действием бензодиазепинового транквилизатора медазепама (рис. 9). При этом в отличие от медазепама селанк также оказывает антиастеническое и психостимулирующее действие (рис. 9). Как упоминалось ранее, один из механизмов анксиолитического действия селанка связан с ингибированием ферментов деградации энкефалинов, а также других пептидов, выполняющих противотревожные функции в ЦНС (Кост и соавт., 2007). Энкефалины могут участвовать и в реализации психостимулирующего эффекта селанка, поскольку в эксперименте с использованием других ингибиторов ферментов, их расщепляющих, показана способность этих пептидов стимулировать двигательную активность животных (Michael-Titus, 1990, Cordonnier, 2005). Этот механизм действия селанка кажется более вероятным при его интраназальном введении, сопровождающемся непосредственным попаданием препарата в мозг (Золотарев и соавт., 2006).
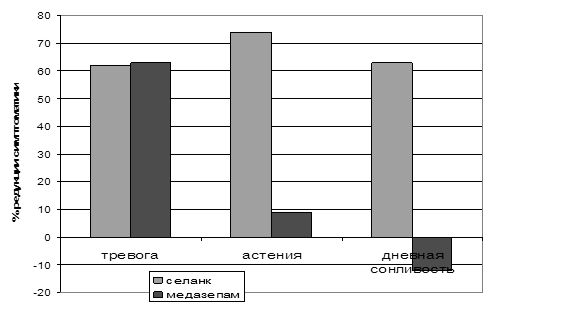
Рисунок 9. Процент редукции выраженности основных симптомов, характерных для ГТР и неврастении в результате терапии селанком и медазепамом
Изменение τ ½ лей-энкефалина в сыворотке крови больных в результате лечения скорее является косвенным отражением процессов, происходящих в ЦНС, чем результатом действия селанка на периферические ферменты деградации энкефалинов. Тем не менее, в результате лечения селанком, но не медазепамом происходит повышение среднего значения τ 1/2 лей-энкефалина в сыворотке крови больных (рис. 10). Увеличение этого параметра происходит преимущественно у больных ГТР. Анализ индивидуальных данных выявил возрастание τ 1/2 лей-энкефалина в сыворотке крови 13 из 16 больных ГТР. Следует отметить большую продолжительность заболевания у 3 больных ГТР, τ 1/2 лей-энкефалина в сыворотке крови которых в результате лечения снизилось (>1 года). Возможно, при длительном течении ГТР происходит более основательная перестройка пептидергических систем, косвенным подтверждением чему можно считать положительную корреляцию между τ 1/2 и продолжительностью заболевания. У больных неврастенией увеличение τ 1/2 лей-энкефалина в сыворотке крови в результате лечения селанком происходит лишь в половине случаев, а у остальных больных наблюдается снижение значений этого параметра. В результате при этой нозологии клинический эффект селанка не сопровождается увеличением среднего времени циркуляции регуляторных пептидов в крови (рис. 10).
О положительном прогностическом значении исследуемого параметра свидетельствует корреляция между исходными величинами τ 1/2 лей-энкефалина в сыворотке крови больных и степенью редукции астении и гиперестезии при терапии селанком (табл. 9). При терапии медазепамом (n=14) такая закономерность наблюдалась для ряда симптомов: тревога (по шкале Гамильтона, R=0.66, p=0.01), повышенная раздражительность (R=0.79, p<0.001), аффективная лабильность (R=0.61, p=0.02), локальные витальные ощущения (R=0.85, p=0.0001). По общей выборке больных исходные значения τ ½ коррелируют с эффективностью терапии к концу курса, оцениваемой по одноименной субшкале шкалы общего клинического впечатления (R=-0.30, p<0.05, n=48), и величиной изменения «выраженности заболевания» по той же шкале (R=0.29, p<0.05, n=47).
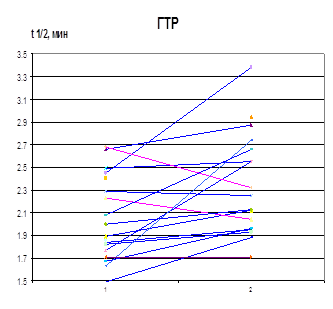
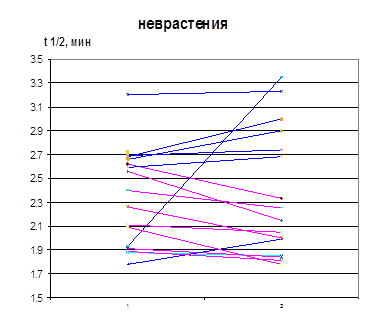
Рисунок 10. Влияние терапии селанком на период полупревращения лей-энкефалина в сыворотке крови больных ГТР и неврастенией (1 – до, 2 – после терапии)
Степень редукции выраженности тревоги, астении, гипотимии и ряда других симптомов в результате терапии селанком коррелирует с τ 1/2 лей-энкефалина в сыворотке крови больных после лечения (табл. 9). Характер этих корреляций свидетельствует о том, что при низкой степени редукции симптоматики сохраняется повышенная активность симпатоадреналовой и гипоталамо-гипофизарной систем, которая, в случае терапии селанком компенсируется относительно высоким содержанием регуляторных пептидов в крови. По-видимому, в наибольшей степени это касается тревоги, потому что степень редукции преимущественно ее симптомов коррелирует со степенью увеличения времени полужизни энкефалина в крови (Δτ ½) (табл. 9).
Таблица 9. Взаимосвязь редукции показателей выраженности симптоматики и активности ЭДФ в крови больных при терапии препаратом селанк
| Степень редукции симптомов | τ ½ до | τ ½ после | Δτ ½ |
| Тревога по шкале Цунга | -0,37 * (34) | -0.38 * (33) | |
| Тревога по ШОВС (N) | -0.52 ** (30) | ||
| Повышенная раздражительность (N) | -0,41 * (31) | -0.37 * (30) | |
| Аффективная лабильность (N) | -0,39* (30) | ||
| Пониженное настроение (N) | -0.56 * (20) | ||
| Астения | 0,34 * (36) | ||
| Апатия (N) | -0,49 * (20) | ||
| Сонливость | -0,34 * (34) | ||
| Гиперестезия | 0,39 * (36) | -0.40 * (33) |
достоверность корреляций * р<0.05, ** р<0.01
(N) – степень редукции данного симптома нормирована на исходное значение показателя шкалы
Приведены лишь достоверные показатели значений коэффициента корреляции (R).
Итак, экспериментальные и клинико-биологические данные свидетельствуют о наибольшей выраженности анксиолитического эффекта селанка в условиях повышенной активности энкефалиндеградирующих ферментов. При этом эффект селанка сопровождается увеличением времени полужизни энкефалина в крови. Это является дополнительным подтверждением связи одного из механизмов действия селанка с его способностью влиять на активность ферментов деградации энкефалина.
Воздействие на эндогенную опиоидную систему как способ коррекции соматических проявлений тревоги
Поведенческие проявления тревоги у животных и тревожные расстройства у людей, как правило, сопровождаются различного рода изменениями на соматическом уровне. Нами на уровне экспериментальных исследований было продемонстрировано, что анксиолитическое действие селанка и даларгина у животных сопровождается коррекцией стресс-индуцированных соматических нарушений сердечно-сосудистой и иммунной систем. На данном этапе работы были выбраны те же условия, в которых проводилось тестирование анксиолитического действия даларгина и селанка.
Так, ранее при тестировании тревожности мышей Balb/c в ПКЛ было обнаружено, что внутрибрюшинные уколы физиологического раствора значительно повышают их тревожность и на этом фоне селанк оказывает выраженное анксиолитическое действие, которое блокируется налоксоном (рис. 3). В исследовании, проведенном по той же схеме на 48 мышах-самцах линии Balb/c, удалось обнаружить кардиотропный эффект селанка. Повышение тревожности, вызванное введением физиологического раствора, сопровождалось стойким повышением ЧСС мышей по сравнению с контрольными животными (632±25 и 527±16 ударов/мин в среднем за 5 мин наблюдения, соответственно, p<0.01). На этом фоне однократное введение селанка (100 мкг/кг) достоверно снижает ЧСС мышей (496±26 ударов/мин в среднем за 5 мин наблюдения) по сравнению с животными, получившими уколы физиологического раствора (p<0.01).
На рисунке 11 представлена динамика сердечного ритма мышей, наблюдавшаяся в течение 5 мин с момента введения электродов мышам, не получавшим до этого никаких инъекций («интактные»), и животным, которым за 30 мин до этого ввели физиологический раствор или селанк. Из рисунка видно, что непосредственно после введения электродов ЧСС «интактных» мышей значительно выше, чем на 2–5 минутах наблюдения (622±17 и 478±23 ударов/мин в первые и последние 30 сек из 5 мин наблюдения, соответственно, p<0.01). Очевидно, это связано с процедурным стрессом введения электродов. Судя по ЧСС, этот стресс сопоставим со стрессом уколов физиологический раствор. Однако, в отличие от «интактных» животных, у мышей, получивших укол физиологический раствор в течение 5 мин тестирования не наблюдается релаксации (снижения сердечного ритма), что соответствует поведенческим данным о повышенной тревожности мышей этой линии, наблюдаемой через 30 мин после укола физиологический раствор (рис. 3).
Введение селанка предотвращает повышение ЧСС мышей в момент введения электродов (460±34 ударов/мин в первые 30 сек наблюдения, p<0.01 по сравнению с тем же показателем у «интактных» животных) и на всем протяжении тестирования достоверно снижает ЧСС мышей по сравнению с животными, получившими уколы физиологический раствор. Сердечный ритм мышей, получивших селанк, в течение 5 минут тестирования достоверно не меняется и остается на уровне ЧСС «интактных» мышей к моменту релаксации после процедурного стресса.
Таким образом, в данном исследовании нам удалось обнаружить кардиотропный эффект селанка, который проявляется в том, что введение этого препарата снижает тахикардию, вызванную как анксиогенным для мышей Balb/c стрессом внутрибрюшинно введения физиологический раствор, так и процедурным стрессом введения электродов.

Рисунок 11. Влияние селанка на динамику сердечного ритма мышей Balb/c в условиях процедурного стресса. ЧСС измеряли в течение 5 мин с момента подкожного введения электродов «интактным» мышам и мышам, получившим внутрибрюшинно инъекции физиологический раствор или селанка (100 мкг/кг) за 30 мин до начала тестирования
*, **, *** – p<0.05, 0.01, 0.001 – отличие от ЧСС мышей, получавших физиологический раствор, измеренной в тот же временной интервал.
В настоящее время доказано, что эндогенные опиоидные пептиды, в частности, лей- и мет-энкефалины обладают кардиопротективными свойствами. Помимо центрального действия на эмоциогенные зоны мозга и ядра, отвечающие за вегетативную регуляцию сердечно-сосудистой системы, опиоидные пептиды влияют на симпатическую и парасимпатическую регуляцию сердца и кровеносных сосудов, предотвращая избыточный выброс медиаторов из нервных окончаний соответствующих вегетативных нейронов и нивелируя гиперактивацию адренергических рецепторов на уровне трансмембранной передачи. Считается, что таким путем эндогенные опиоиды предотвращают развитие аритмии, гипертрофии сердца и апоптоз кардиомиоцитов в условиях гиперактивации симпатической нервной системы, например, при хроническом стрессе (Pepeetal., 2004). Кроме того, опиоидные пептиды играют существенную роль в кардиогенезе, выживаемости кардиоцитов в условиях ишемии, репаративных процессах при инфаркте миокарда (Peartetal., 2005).
Таким образом, использование Селанка как ингибитора ферментов деградации эндогенных опиоидных пептидов (энкефалинов) при лечении больных, у которых тревожные расстройства сопровождаются сердечно-сосудистыми заболеваниями, патогенетически вполне обоснованно.
Исследование иммуномодулирующего действия даларгина также проводили в условиях анксиогенного стресса, сопровождающего тестирование животных в «челночных камерах». Изучали пролиферативную активность лимфоцитов крови 84 крыс-самцов популяции Wistar, прошедших обучение в «челночной камере» и получивших после этого пятидневный курс внутрибрюшинного введения физиологического раствора (контрольная группа) или даларгина (20 мкг/кг). В процессе исследования определяли спонтанную пролиферацию лимфоцитов и пролиферативную активность, стимулированную КонА в различных дозах. Затем экстраполяцией кривой доза-эффект вычисляли ту дозу митогена, при которой наблюдается максимальная пролиферация, и определяли индекс стимуляции лимфоцитов по соотношению оптимальной и спонтанной пролиферации. По общей выборке не было обнаружено достоверных отличий между уровнем пролиферации лимфоцитов крови контрольных крыс и крыс, получавших даларгин. Введение даларгина лишь понизило чувствительность клеток к митогену: оптимальная концентрация КонА повысилась от 10.8±1.2 (в контрольной группе) до 14.1±1.0 мкг/мл (p<0,05).
В процессе статистической обработки результатов животные были разбиты на 3 подгруппы в соответствии с их исходной двигательной активностью в ATS. В результате обнаружилось, что спонтанная пролиферация лимфоцитов крыс со «средней» двигательной активностью (СА) значительно ниже, чем у высоко – (ВА) и низко – (НА) активных животных (табл. 10). Величина спонтанной пролиферации в значительной степени отражает функциональную активность лимфоцитов in
vivo
.
Ее изменение может происходить не только под воздействием попадающих
8-09-2015, 22:33
