Если на рентгенограмме, выполненной через час после начала ВЧОВ отмечаются признаки недостаточного расправления легких, увеличить МАР на 2-3см Н2 О. Повторить рентгеновское исследование через 6 часов. При оптимальной степени растяжения легких - действовать, как указано выше. При наличии признаков избыточного растяжения легких, снизить PAW на 1-2 см Н2 О, далее - как указано выше.
При сохраняющейся высокой потребности в кислороде возможно применение стратегии рекруитмента (быстрого вовлечения в газообмен максимального количества альвеол). Пошаговое увеличение МАР на 1-2 см вод. ст. в течение 2-4 минут до появления возможности снижения процента кислорода на фоне улучшающейся оксигенации. Затем, после ухода с токсических концентраций, также пошаговое снижение давления до прежних значений.
При отмене ВЧО ИВЛ возможен перевод пациента на традиционную ИВЛ при достижении МАР 5-7 см вод. ст. При необходимости более ранней отмены ВЧО ИВЛ, среднее давление в дыхательных путях не должно превышать 11 см Н2 О.
Возможна экстубация и перевод новорождённого с ВЧ ИВЛ на назальный СРАР непосредственно с осциллятора при условии, что МАР достигло 7 см вод. ст., а FiO2 не более 0,3-0,35.
Вентиляция:
При постоянной частоте осцилляций уровень PCO2 зависит от DР. Необходим контроль газового состава крови через 30 мин. после начала ВЧОВ.
PCO2 < 35ммНg - снизить DР на 10% от имеющегося
PCO2 < 25 мм Hg - снизить амплитуду на 20%
PCO2 = 35 - 55 mmHg - не изменять
PCO2 > 60 mmHg - увеличить DР на 10%
PCO2 > 85 mmHg - увеличить DР на 20%
Особые указания:
Контролировать газовый состав крови необходимо каждые 30 мин, пока не нормализуется PCO2 . (Оптимально - в процессе ВЧО ИВЛ проводить непрерывный транскутанный мониторинг уровня CO2 ).
Допускается уровень PCO2 до 65 мм рт. ст. если pH > 7,2-7,25
1. Нарушения центральной и регионарной гемодинамики не являются противопоказанием к применению ВЧОВ
2. Контролировать газовый состав крови каждые 4-6 часов при стабильном состоянии пациента; через 30 минут после изменения параметров, пока не будут достигнуты удовлетворительные показатели PO2 и PCO2 .
3. При возникновении выраженной гиперкапнии у стабильного до этого момента пациента, необходимо проверить положение эндотрахеальной трубки; не возникла ли полная или частичная обтурация эндотрахеальной трубки мокротой, и при необходимости - заменить эндотрахеальную трубку.
4. Аускультация пациента на ВЧОВ иногда может быть полезна для определения положения эндотрахеальной трубки, а также для подбора оптимальной частоты вентиляции.
Удовлетворительная аускультативная картина - симметрично, справа и слева, с одинаковой интенсивностью выслушиваются осцилляторные колебания, а главное, шум постоянного потока газовой смеси. При нарушении положения трубки, (например, срез упёрся в стенку трахеи или низкое положение трубки) шум потока газовой смеси будет выслушиваться несимметрично - с одной стороны более глухо. Аускультация проводится не только по передней поверхности грудной клетки, но обязательно и в подмышечных областях. Аккуратно меняя положение трубки (или путём поворачивания головы пациента), добивайтесь симметричной аускультативной картины. При обтурации эндотрахеальной трубки шум газового потока и осцилляции будут симметрично приглушёнными. Посторонние аускультативные шумы могут указывать на необходимость проведения санации или на скопление в контуре конденсата (проверить!). Для подбора оптимальной частоты используется аускультация легких у больных на ВЧО ИВЛ. При совпадении частоты осцилляций с собственной резонансной частотой легких выслушивается максимальное звучание осцилляций. Подобная стратегия позволяет снизить избыточную работу дыхания пациента на ВЧО ИВЛ
5. При аускультации сердца осцилляции должны быть кратковременно отключены, но контур не отсоединяют от ЭТТ, чтобы сохранялось постоянное расправляющее давление.
Особенности ухода за ребёнком на ВЧОВ
! Следует избегать частого, даже кратковременного, разъединения контура. Крайне важно поддержание лёгочного объёма. С этой целью рекомендуется применять специальные закрытые системы для санации ТБД.
!Санацию дыхательных путей проводят только при наличии абсолютных показаний:
Снижение или отсутствие видимых колебаний грудной клетки
Значительное увеличение PCO2
Снижение оксигенации
Больным РДС в первые сутки, как правило, не требуется санация. При санации время отсоединения должно быть очень коротким (менее 30 секунд) и, при необходимости, процесс повторяют два или три раза. После процедуры может понадобиться восстановление адекватного объёма лёгких и следует временно увеличить PAW (на 2-3см Н2 О в течение 1-2 минут).
Порядок изменения положения тела должен быть тщательно продуман до начала манипуляции.
При проведении высокочастотной вентиляции необходимо адекватное увлажнение. Из-за высокой скорости потока жидкость из увлажнительной камеры испаряется очень быстро. Рекомендуется постоянное капельное введение стерильной дистиллированной воды в камеру увлажнителя.
Нет необходимости вводить миорелаксанты всем детям, находящимся на ВЧОИВЛ. У большинства детей их собственная дыхательная активность не влияет на эффективность механической вентиляции, на практике она даже может сопровождаться улучшением оксигенации. Помните, что введение миорелаксантов может приводить к значимому микроателектазированию, а также увеличению вязкости мокроты.
Показания к назначению седативных препаратов включают выраженное возбуждение и очень явные, сильные дыхательные усилия. Появление активного самостоятельного дыхания может свидетельствовать о гиперкарбии или обтурации эндотрахеальной трубки.
Возможна обтурация интубационной трубки мокротой, при этом состояние больного может долгое время оставаться достаточно стабильным. Основными признаками обтурации будут снижение амплитуды видимых колебаний, увеличение парциального напряжения углекислого газа в артериальной крови. Поэтому, всегда надо быть готовым к проведению экстренной переинтубации пациента.
Особенности интерпретации данных мониторинга функции легких при ВЧО ИВЛ.
Пульсоксиметрия.
При ВЧО ИВЛ обычно поддерживают SаO2 в пределах 90-95%. Следует избегать SаO2 менее 85% (PCO2 < 50 мм рт. ст.), т.к. повышается легочное сосудистое сопротивление и возможна тканевая гипоксия. В некоторых случаях, если не нарастает метаболический ацидоз и стабильны показатели гемодинамики, можно поддерживать более низкую оксигенацию (тяжёлая баротравма, определённые виды врождённых пороков сердца, бронхолегочная дисплазия и т.д.).
В последнее время существует тенденция в острый период заболевания легких считать приемлемыми более низкие величины рН (около 7,2) и более высокие величины PCO2 (более 50 - 60 мм рт. ст.), для того, чтобы избежать повреждение легких высоким давлением и/или дыхательным объёмом (метод допустимой гиперкапнии). Для профилактики ВЖК важнее избегать резких изменений PCO2 , чем стремиться "нормализовать" его уровень.
Рентгенологический контроль.
Рентгеновский снимок грудной клетки производится до перевода на ВЧО ИВЛ и затем через 4 часа после начала ВЧО ИВЛ. Оптимальное положение правого купола диафрагмы измеренное по среднеключичной линии - между 8 и 9 ребрами (по задним дугам ребер). Положение правого купола диафрагмы на 10 ребре и ниже свидетельствует о прерастяжении легких, а выше 8 ребра - напротив, о недостаточном раздувании легких. Если пациент стабилен, и не требует увеличения параметров ВЧО ИВЛ, рентгеновские снимки повторяются каждые 12 - 24 часа, либо по показаниям. Ниже представлено оптимальное расписание проведения рентгенографического исследования:
1. Через 4 часа после начала вентиляции
2. Каждые 12 часов в последующие сутки
3. Каждые 24 часа в последующие 5 дней
4. Каждые 48 часов в следующие 8 дней
5. Каждую неделю в последующем
6. Всякий раз, когда подозревается перераздувание легких.
Графический пневмомониторинг при ВЧО ИВЛ позволяет оптимизировать дыхательную поддержку. Он осуществляется с помощью датчика потока, измеряющего инспираторный и экспираторный потоки, и давления в дыхательных путях. Датчик потока располагается между ЭТТ и дыхательным контуром. Динамика измерений давления, потока и объёма выводится на дисплей специально предназначенного монитора. На точность результатов будут влиять следующие факторы: диаметр и длина ЭТТ, величина утечки между ЭТТ и трахеей, наличие мокроты в трахеобронхиальном дереве, правильность калибровки прибора перед использованием.
Поддерживающая терапия.
Дети со среднетяжелым и тяжелым РДС не должны получать энтерального питания в первые сутки жизни. Вопрос о возможности и времени начала кормления детей с легким РДС решается индивидуально.
Обычно внутривенное введение 10 % раствора глюкозы из расчета 60-70 мл/кг/сут обеспечивает минимальную физиологическую (на уровне основного обмена) потребность в воде и калориях в первые 2-3 суток жизни. Вместе с тем у детей с массой тела более 1500 грамм, перенесших тяжелую асфиксию, в первые сутки жизни целесообразно ограничить объем вводимой жидкости до 40 мл/кг/сут. Недоношенным детям с массой от 1000 до 1500 грамм инфузиониую терапию начинают с введения 10 % раствора глюкозы в объеме на 10-20% меньшем, чем требуется для обеспечения минимальной физиологической потребности в жидкости. Детям с массой тела 800-1000 грамм инфузионную терапию целесообразней начинать с введения 7.5% раствора глюкозы, детям с массой тела 500-800 грамм - с введения 5% раствора глюкозы. В случае развития гипогликемии увеличивают концентрацию вводимой глюкозы. Основная цель проводимой терапии - поддержание биохимического гомеостаза. При проведении инфузионной терапии необходим контроль за основными биохимическими константами крови ребенка (концентрация глюкозы, мочевины, креатинина, общего белка, К, Na, Са и КОС).
При отсутствии лабораторного контроля, поддерживающая терапия должна быть направлена на обеспечение минимальных физиологических потребностей организма в жидкости, питательных веществах и электролитах. В этом случае неонатолог вынужден ориентироваться на средние значения физиологических потребностей новорожденного ребенка.
Физиологическая потребность новорожденного в жидкости зависит от массы тела, гестационного возраста (определенного на основании степени морфофункциональной зрелости организма ребенка) и постнатального возраста. Средние цифры физиологической потребности в жидкости, на которые можно ориентироваться, представлены в таблице №10.
Таблица №10
Ориентировочные потребности в жидкости детей на первой неделе жизни (в мл/кг/сут.)
| 1 сут. | 2 сут. | 3 сут. | 4 сут. | 5-7 сут. | |
| Доношенные (масса > 2500 гр.) | 50 | 60-70 | 70-90 | 90-120 | 120-150 |
| Недоношенные (масса > 1500 гр.) | 50-60 | 60-80 | 80-100 | 100-120 | 120-140 |
| Недоношенные (масса < 1500 гр.) | 60-80 | 80-100 | 100-110 | 110-130 | 120-140 |
(Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
При отсутствии контроля за электролитами крови парентеральное введение кальция проводят, начиная с конца первых суток жизни с целью профилактики ранней гипокальциемии. С этой целью используются 10% растворы глюконата или хлорида кальция (которые в 1 мл содержат 0.45 мэкв и 0.136 мэкв элементарного кальция, соответственно). Парентеральное введение натрия начинают с момента установления адекватного диуреза, введение калия - на 2-3 сутки жизни. Для обеспечения физиологической потребности в натрии может быть использовано добавление к 10% раствору глюкозы изотонического ("физиологического") раствора хлорида натрия (в 1 мл содержится 0.15 мэкв натрия). Для обеспечения физиологической потребности в калии используются 4, 7.5 или 10 % растворы хлорида калия (содержащие в 1 мл 0.6, 1.0 и 1.5 мэкв калия, соответственно). Использование с 3-4 суток панангина (в 1 мл - содержится 0.25 мэкв калия) позволяет одновременно обеспечить физиологическую потребность ребенка в магнии. В первые двое-трое суток жизни эта потребность обычно удовлетворяется путем парэнтерального введения 0.2 мл/кг 25 % раствора магния сульфата (при внутривенном пути введения этого препарата обязательным является растворение его в 10-20 мл 10% раствора глюкозы и медленная скорость введения).
Физиологическая потребность в натрии составляет 2-3 мэкв/кг/сут (у детей с массой тела менее 1000 грамм - до 4 мэкв/кг/сут)
Физиологическая потребность в калии - 1-2 мэкв/кг/сут (у детей с массой тела менее 1000 грамм - 2-3 мэкв/кг/сут)
Потребность в кальции составляет 0.45-0.9 мэкв/кг/сут.
По мере стабилизации состояния ребенка (обычно на 2-3-сутки жизни), после пробного введения стерильной воды и 5 % раствора глюкозы через зонд, начинают проведение энтерального питания. Более раннее начало питания может привести к развитию язвенно-некротического энтероколита (особенно у глубоконедоношенных детей), более позднее - к тяжелым дисбактериозам кишечника, вплоть до развития энтероколитов бактериальной этиологии. Наличие значительного количества застойного содержимого в желудке, упорные срыгивания или рвота с примесью желчи, вялая или усиленная перистальтика кишечника, кровь в стуле, симптомы раздражения брюшины служат противопоказанием для начала знтерального питания. В этих случаях ребенок нуждается в проведении парентерального питания. С этой целью в первые 5-7 дней жизни используются растворы аминокислот и глюкозы, а при необходимости длительного парентерального питания с 8-10 суток жизни подключаются жировые эмульсии.
Антибактериальная терапия.
Учитывая, что дети с РДС составляют группу высокого риска по развитию раннего неонатального сеписа, большинству новорожденных со среднетяжелым и тяжелым заболеванием показано проведение в родильном доме эмпирической антибактериальной терапии одной из двух комбинаций антибиотиков: полусинтетические пенициллины + аминогликозиды или цефалоспорины 2 поколения + аминогликозиды. Вопрос о длительности лечения и смене антибактериальной терапии должен решаться на основании микробиологических данных и результатах клинического и биохимических анализов крови.
Посиндромная терапия.
Борьба с сердечно-сосудистой недостаточностью, отеком мозга, судорогами, гипербилирубинемией, острой почечной недостаточностью осуществляется по общим принципам интенсивной терапии.
Диагностика, профилактика и лечение синдрома утечки воздуха.
Синдром утечки воздуха (СУВ) является одним из наиболее опасных осложнений РДС новорождённого при использовании ИВЛ и сурфактантов. Своевременное предупреждение, распознавание и лечение СУВ является необходимым условием для эффективного лечения РДС.
1. Пневмоторакс.
Пневмоторакс - вид СУВ, при котором воздух проникает в плевральную полость вследствие нарушения целостности висцеральной плевры. Чаще всего пневмоторакс является ургентным состоянием, сочетающимся с развитием внезапного плевропульмонального шока и гемодинамического коллапса.
По этиологии пневмоторакс подразделяют на спонтанный, осложняющий течение других легочных заболеваний (САМ, СПЛГ и т.д.) и ятрогенный (при санации ТБД, катетеризации подключичной вены и т.д.). Частота встречаемости зависит от вида респираторной терапии. Дети, получающие кислородотерапию, - до 4%, положительное давление конца выдоха - до 16%, пациенты, находящиеся на ИВЛ, - до 34%
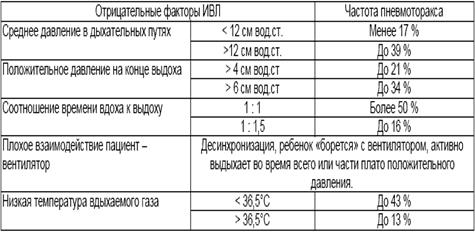
Основные факторы риска развития пневмоторакса на ИВЛ представлены в таблице 11.
Диагностика пневмоторакса
Клинически - тахипное, цианоз, сниженное проведения дыхания на поражённой стороне, ассиметрия грудной клетки, выбухание на поражённой стороне, коробочный перкуторный звук, смещение органов средостения в здоровую сторону, вздутие живота, артериальная гипотензия, брадикардия. В газах крови гипоксемия, гиперкапния, смешанный ацидоз.
Таблица 11
Частота развития пневмоторакса при традиционной ИВЛ в зависимости отдельных параметров (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Трансиллюминация.
Метод трансиллюминации позволяет заподозрить пневмоторакс в ситуациях, когда рентгенологическое исследование недоступно или требует длительного времени. Необходимыми условиями для проведения трансиллюминации является относительно затемненная комната или возможность создать локальное затемнение (например, накрыть инкубатор и исследователя плотным покрывалом, не пропускающим свет) и наличие сильного источника холодного света (сильный фонарик, источник света от эндоскопа, источник света от системы BiliBlanket). Источник света прикладывают к грудной клетке ребёнка. Если в плевральной полости воздуха нет, то свет будет образовывать небольшое кольцо вокруг источника света (Рис.13), а в случае внелегочного скопления воздуха мы будем наблюдать широкое распространение света по грудной клетке (Рис.14).
Рентгенологические данные представляют наибольшую ценность в диагностике пневмоторакса (Рис.15). Воздух в плевральной полости, коллабированное лёгкое, смещение средостения в здоровую сторону - основные рентгенологические признаки пневмоторакса.
Асимптоматический пневмоторакс у новорождённых на самостоятельном дыхании требует только консервативного наблюдения и рентгенологического контроля каждые 12-24 часа. У доношенных новорождённых небольшой пристеночный пневмоторакс, имеющий клиническую симптоматику, можно также лечить консервативно. В этом случае резорбции экстраальвеолярного воздуха способствует повышение концентрации кислорода во вдыхаемой газовой смеси. Выявление пневмоторакса у пациента на ИВЛ - обязательное показание для дренирования плевральной полости.

Рисунок 13. Метод трансиллюминации. Источник света расположен на грудной клетке. Небольшое кольцо вокруг источника света. Пневмоторакса нет (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007).

Рисунок 14. Метод трансиллюминации. Источник света расположен на грудной клетке. Кольцо вокруг источника света распространяется на всю половину грудной клетки. Пневмоторакс есть. (Диагностика и лечение РДС недоношенных // метод. Рекомендация, 2007)
Лечение пневмоторакса.
Поскольку пневмоторакс является опасным для жизни состоянием, в любом лечебном учреждении, лицензированном для оказания помощи новорождённому ребёнку должен быть всегда готов стерильный набор инструментов и расходных материалов для пункции и дренирования плевральной полости. В любой дежурной смене должен быть хоть один специалист, владеющий операцией торакоцентеза.
В набор для дренирования плевральной полости должны входить:
1. Набор для проведения местной анестезии
2. Скальпель
3. Троакар размером
4. Пуговчатый зонд
5. Дренажная трубка с двумя боковыми перфорациями
6. Изогнутые зажимы без зубчиков
7. Шовный материал
8. Набор шариков и салфеток
Пункция плевральной полости проводится как диагностическая процедура у пациентов, чьё состояние стремительно ухудшается и необходима незамедлительная диагностика.
Появление пузырьков воздуха свидетельствует о правильной пункции плевральной полости с поражённой стороны.
Инфицирование, ранение лёгкого, сосуда, грудного протока - возможные осложнения плевральной пункции, поэтому проведение процедуры требует большой осторожности.
Пункционная эвакуация воздуха из плевральной полости всегда недостаточна. Сразу же после диагностирования пневмоторакса производится дренирование.
Дренирование плевральной полости. Пневмоторакс должен быть дренирован у всех детей, имеющих клиническую симптоматику, находящихся на механической вентиляции (исключение только для пристеночных пневмотораксов без клинического ухудшения состояния пациента), а также во всех случаях напряжённого пневмоторакса.
Дренирование проводится в третьем межреберье по передней аксиллярной линии в стерильных условиях. Обязательны анальгезия, местная анестезия и седатация больного. Используют дренаж соответствующего размера (10 Fr для очень маленьких, 12-14 Fr для больших пациентов).
Во избежание ранения лёгкого непосредственно в момент постановки дренажа, рекомендуется на короткое время отсоединить новорождённого от вентилятора. С этой же целью троакар никогда не вводят более, чем на 1 сантиметр. Дренаж вводят на несколько сантиметров до достижения оптимального выхода воздуха. Все
8-09-2015, 19:49
