Оценка стоимости и эффективности антибактериальной терапии
О.Л. Розенсон, Л.С.Страчунский
Проблема выбора антибиотика будет существовать, пока появляются новые антибактериальные препараты и продолжает меняться чувствительность бактерий к ним. Принимая решение о выборе антибиотика, как правило, врач последовательно оценивает следующие факторы:
спектр активности;
фармакокинетические характеристики;
безопасность и переносимость;
стоимость антибиотика.
Если о первых трех факторах данных в медицинской литературе достаточно много, то экономические показатели антибактериальной терапии стали привлекать к себе пристальное внимание относительно недавно, что вызвано постоянным ростом расходов на здравоохранение, его недостаточным финансированием, самостоятельным планированием финансовой деятельности лечебных учреждений, увеличением количества антибиотиков на рынке.
В последнее время за рубежом публикуется большое количество фармакоэкономических исследований антибактериальных препаратов. От классических клинических испытаний их отличает то, что помимо оценки эффективности и безопасности препаратов проводится оценка всех расходов, связанных с лечением данной инфекции, причем для выбора оптимального режима антибиотикотерапии эти показатели рассматриваются в неразрывной связи друг с другом.
Общепринятым при проведении фармакоэкономических исследований считается учет трех основных составляющих стоимости заболевания: прямой (медицинской), косвенной (затраты в связи с временной или постоянной утратой трудоспособности) и так называемой нематериальной (соотносимой со снижением качества жизни) стоимости.
Следует различать понятия стоимость антибиотика и стоимость антибактериальной терапии. Под стоимостью антибиотика подразумевается его закупочная цена (цены на антибактериальные препараты организаций по оптовой продаже лекарственных препаратов, в аптеках). Понятие "стоимость антибактериальной терапии" гораздо шире, оно включает в себя несколько стоимостей: самого антибиотика его введения, дополнительного антибактериального лечения при клинической неэффективности и/или развитии нежелательных реакций, пребывания пациента в стационаре и т. д. ( табл.1).
Фармакоэкономические исследования являются обширным полем деятельности поскольку расходы стационаров на лекарственные средства в среднем составляю 15-20% от их бюджета, причем на долю антиинфекционных препаратов приходится 50-60% [ 1, 2]. Существует ряд решений, позволяющих сократить затраты н проведение антибактериальной терапии в стационаре при сохранении высокой клинической эффективности ( табл. 2).
Табл. 1. Основные компоненты стоимости антибактериальной терапии
Закупочная стоимость антибиотика. Стоимость введения:
специальные медицинские принадлежности (шприцы, иглы, системы для введения инфузионных растворов, перчатки, дезинфектанты и др.);
стерилизация;
затраты рабочего времени среднего медицинского персонала;
утилизация шприцов, игл и других расходуемых материалов.
Стоимость пребывания пациента в стационаре по поводу инфекционного заболевания, его осложнений. Стоимость консультаций специалистов (хирург, терапевт, гинеколог и др.). Стоимость дополнительного лечения при клинической неэффективности. Стоимость дополнительного лечения при возникновении нежелательных реакций. Стоимость лабораторных и диагностических исследований:
микробиологические исследования (выделение и идентификация возбудителя, определение чувствительности к антибиотикам)
терапевтический лекарственный мониторинг (при применении аминогликозидов, ванкомицина, хлорамфеникола)
клинические и биохимические анализы
инструментальные методы исследования.
Стоимость лечения (долечивания) пациента в амбулаторных условиях.
Табл. 2. Пути снижения расходов на антибактериальную терапию в стационаре
Повышение квалификации врачей в области антимикробной химиотерапии Учет локальной структуры антибиотикорезистентности Улучшение качества работы лаборатории клинической микробиологии Пероральная антибиотикотерапия Ступенчатая терапия Короткие курсы антибиотикотерапии Антибиотикопрофилактика в хирургии Применение генериков Формуляр антибиотиков Система "ограничения" применения антибиотиков Парентеральная антибиотикотерапия вне стационара Выбор антибиотиков с длительным интервалом дозирования Монотерапия
Повышение квалификации врачей области антимикробной химиотерапии учет локальной структуры антибиотико резистентности, улучшение качества работы лаборатории клинической микробиологии.
Мы сознательно объединили три эти подхода к снижению затрат при проведении антибактериальной терапии в стационаре, так как они находятся в неразрывной связи друг с другом.
Назначение антибиотиков не по показаниям можно объяснить по крайней мере тремя причинами [3]:
влиянием рекламной кампании фармацевтических фирм;
недостаточной подготовкой врача в области химиотерапии;
чрезмерными требованиями пациента к проводимому лечению.
На первое место следует поставить второй фактор, так как врачу, обладающему современными знаниями в области антимикробной химиотерапии и клинической микробиологии, гораздо легче противостоять давлению как рекламы, так и пациентов.
Знание эпидемиологической ситуации в стационаре помогает разумно подойти к применению антибактериальной терапии, что позволяет уменьшить селекцию резистентных штаммов, снизить число случаев неоправданного назначения антибиотиков и расходы на них, повысить контроль за применением антибиотиков.
Знание эпидемиологической ситуации в стационаре невозможно без качественной работы лаборатории клинической микробиологии. Чтобы результаты микробиологических анализов были достоверными, необходимо применять микробиологические материалы высокого качества, стандартизировать методы анализа в соответствии с международными требованиями, проводить внутренний и внешний контроль качества.
Пероральная антибиотикотерапия
Большинство современных пероральных антибиотиков характеризуются широким спектром действия, высокой биодоступностью, а также малой кратностью приема, что позволяет их назначать изначально при лечении ряда инфекционных заболеваний. Снижение расходов в этом случае обусловлено разницей в стоимости пероральных и парентеральных антибиотиков, значительным снижением стоимости введения антибиотика, возможностью ранней выписки пациента из стационара, снижением риска развития нозокомиальной инфекции. Кроме того, лечение для пациента становится более комфортным.
Примерами данного подхода могут являться применение коамоксиклава, цефуроксима аксетила при инфекциях дыхательных путей, фторхинолонов при инфекциях мочевыводящих путей, макролидов, цефуроксима аксетила, коамоксиклава при инфекциях ЛОР-органов.
Ступенчатая терапия
Ступенчатая терапия - двухэтапное применение антимикробных препаратов с переходом от парентерального на непарентеральный (как правило, пероральный) путь введения в возможно короткие сроки, определяемые клиническим состоянием пациента.
Основная идея ступенчатой терапии заключается в том, что, если пациента можно эффективно лечить коротким курсом парентерального антимикробного препарата с последующим переводом на пероральный прием, то это может значительно уменьшить стоимость лечения, сократить срок пребывания пациента в стационаре при высокой клинической эффективности терапии. Накоплен опыт применения ступенчатой терапии при госпитальной пневмонии, инфекции урогенитального тракта, септицемии, инфекции кожи и мягких тканей, интраабдоминальной инфекции [ 1, 2].
Ступенчатая терапия имеет клинические и экономические преимущества как для пациента, так и для лечебного учреждения. Преимущества для пациента заключаются, во-первых, в уменьшении количества инъекций, что делает лечение более комфортным и снижает риск возникновения постинъекционных осложнений (флебиты, постинъекционые абсцессы, катетер-ассоциированные инфекции). Во-вторых, при положительной динамике заболевания и отсутствии показаний для пребывания пациента в стационаре он может быть выписан раньше и продолжать лечение в домашних условиях, что будет благоприятно сказываться на его психоэмоциональном состоянии, а также позволит снизить риск нозокомиальной инфекции.
Преимущества для стационара, где проводится ступенчатая терапия, складываются из следующих факторов:
снижения затрат в связи с меньшей стоимостью оральных антибиотиков ( табл.3);
снижение расходов при применении оральных антибиотиков, что связано с дополнительными затратами на введение парентеральных антибактериальных препаратов ( см. табл.1);
возможность более ранней выписки больного, так как прием оральных антибиотиков, как правило, не требует пребывания пациента в стационаре;
снижение риска возникновения нозокомиальной инфекции, включая постинъекционые осложнения.
Табл. 3. Стоимость отдельных антибиотиков, используемых при проведении ступенчатой терапии [4]
|
* Разница в стоимости парентеральных и оральныx препаратов за разовую дозу.
Короткие курсы антибиотикотерапии
Стандартные схемы антибактериальной терапии периодически пересматриваются в связи с ростом резистентности возбудителей и появлением новых препаратов, имеющих улучшенные фармакокинетические показатели, прежде всего более длительный период полувыведения и лучшую биодоступность. Примером нового подхода к химиотерапии являются короткие курсы применения антибиотиков. Как показали результаты проспективных клинических испытаний, их можно успешно применять при инфекциях ЛОР-органов (острый средний отит, острый синусит, тонзиллофарингит) [ 5- 7], инфекциях дыхательных (обострение хронического бронхита, внебольничные пневмонии) [ 8, 9] и мочевыводящих [ 10, 11] путей.
Рассмотрим в качестве примера применение короткого курса антибиотикотерапии при стрептококковом тонзиллофарингите. 10-дневный курс пенициллина является золотым стандартом для лечения стрептококкового тонзиллофарингита с 1951г. Несмотря на то, что этот антибиотик выдержал испытание временем и остается эффективным у большинства пациентов, носительство (3-гемолитического стрептококка группы А сохраняется в 5-35% случаев, что говорит о бактериологической неэффективности пенициллина [12].
Возможными причинами клинической неэффективности стандартного 10-дневного курса пенициллина являются: низкий уровень соблюдения пациентами режима лечения, колонизация ко-патогенами, эрадикация непатогенной "защитной" микрофлоры ротоглотки, ослабление иммунного ответа при раннем начале антибиотикотерапии, переход в носительство [13]. Клинически доказанной альтернативой традиционному 10-дневному курсу пенициллина при стрептококковом тонзиллофарингите являются, например, короткие курсы цефалоспорина II поколения цефуроксима аксетила (4 дня) [14], а также антибиотиков из группы макролидов - азитромицина [15], спирамицина [16].
Короткие курсы антибиотикотерапии при высоком уровне клинической эффективности обладают следующими преимуществами:
улучшается соблюдение пациентами режима лечения;
снижается стоимость лечения за счет уменьшения расходов на антибиотик и его введение, а также возможного сокращения срока госпитализации;
снижается риск развития нозокомиальной инфекции, включая постинъекционные осложнения.
Антибиотикопрофилактика в хирургии
По зарубежным данным, развитие раневой инфекции способствует удлинению сроков пребывания больного в стационаре на 1 нед, что приводит к увеличению стоимости лечения на 10-20% [17]. В настоящее время никто не ставит под сомнение преимущества периоперационной антибиотикопрофилактики. В литературе дискутируются вопросы не о том, нужен ли антибиотик вообще, а какой препарат выбрать, чтобы добиться максимальной клинической и фармакоэкономической эффективности. В то же время многие российские хирурги не почувствовали преимуществ антибиотикопрофилактики. Во многом это связано с тем, что "антибиотикопрофилактика" начинается после окончания операции, когда больной поступает в палату. Обычный ее курс составляет 5-7 дней и включает в себя наиболее доступные антибиотики, такие как бензилпенициллин, полусинтетические пенициллины, аминогликозиды. Лишь в отдельных стационарах используются протоколы периоперационной профилактики с введением первой дозы препарата перед началом операции.
Экспериментальные работы были подтверждены результатами рандомизированных контролированных проспективных клинических испытаний. В работе D.Classen [18] показано, что, если антибактериальная терапия начинается более чем за 2 ч до момента разреза, то послеоперационная инфекция развивается в 3,8% случаев по сравнению с 0,5% при введении антибиотика за 1ч ( рис.1).
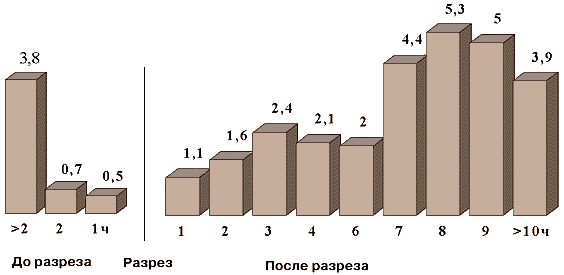
Рис. 1. Частота послеоперационной раневой инфекции (в %) в зависимости от времени между введением антибиотика и началом операции [18]
Если же антибиотик вводится после начала операции, частота развития инфекции начинает возрастать, достигая 5% при введении через 8-9 ч после разреза, причем чем позже после начала операции начата антибиотикопрофилактика, тем выше вероятность развития инфекции.
В 1995г. в одном из стационаров Смоленска мы провели ретроспективный анализ 495 историй болезни пациентов, госпитализированных в травматологическое, онкологическое отделения и отделение чистой хирургии. Ни в одном случае периоперационная антибиотикопрофилактика не проводилась. Вместо этого, как правило, в послеоперационном периоде с "профилактической целью" назначались антибиотики курсом 5-10 дней. Средняя стоимость курса составляла на 1995г. 30000 руб. в то время как проведение периоперационной антибиотикопрофилактики цефазолином стоило 12500 руб.
Введение антибиотиков с профилактической целью в периоперационном периоде при условно-чистых и условно-загрязненных оперативных вмешательствах позволяет:
снизить частоту послеоперационных инфекционных осложнений;
снизить расходы за счет сокращения числа послеоперационных инфекционных осложнений, отмены длительных курсов "антибиотикопрофилактики" в послеоперационном периоде;
снизить частоту нозокомиальной инфекции;
сократить срок госпитализации пациентов.
Применение генериков
Использование антибиотиков-генериков способно сократить расходы за счет разницы в стоимости между ними и инновационными антибактериальными препаратами ( табл.4).
На первый взгляд генерика кажется простой задачей при нынешнем изобилии на фармацевтическом рынке антибактериальных препаратов. Однако не все генерики равноценны в качественном отношении. В первую очередь это относится к пероральным препаратам, так как генерики должны быть биоэквивалентными оригинальному препарату, хотя следует уделять повышенное внимание и качеству препаратов для парентерального введения [19].
При выборе генерического антибиотика мы должны быть уверены в его соответствии общепринятым стандартам по содержанию активного вещества, концентрации примесей, а для оральных препаратов и по показателю биодоступности.
Табл. 4. Сравнительная стоимость упаковки (10 таблеток по 250мг) инновационного ципрофлоксацина (ципробай) и его генериков [4]
|
Формуляр антибиотиков
Под формуляром принято понимать перечень лекарственных препаратов, рекомендуемых органами государственного здравоохранения, медицинского страхования или предпочтительных в данном лечебном учреждении. Формуляр одной клиники может отличаться от формуляра другой, однако подходы к его составлению остаются одинаковыми.
В составлении формуляра антибактериальных препаратов принимают участие врачи разных специальностей - инфекционисты, клинические фармакологи, клинические микробиологи, хирурги и другие клиницисты. Формуляр следует систематически (1-2 раза в год) пересматривать с учетом эпидемиологических данных, появления новых антибиотиков, изменения подходов к лечению и профилактике инфекционных заболеваний. Существуют определенные принципы отбора антибиотика в формуляр, например, из нескольких представителей одного класса антибактериальных препаратов следует отдавать предпочтение какому-либо одному препарату. Так, не имеет смысла применять в стационаре несколько аминогликозидов, например гентамицин, тобрамицин, нетилмицин, амикацин. Обычно выбирают один-два из них.
Формулярная схема антибактериальных препаратов имеет следующие фармакоэкономические преимущества:
ограниченное число антибиотиков, используемых в клинике;
более детальное знание врачами этого ограниченного числа антибиотиков;
повышение контроля за использованием антибактериальных препаратов;
снижение риска появления резистентных штаммов возбудителей, улучшение эпидемиологической ситуации в клинике;
снижение затрат на закупку антибактериальных препаратов за счет ограниченного использования антибиотиков, ограничения перечня антибиотиков, возможности предоставления скидок поставщиком при приобретении крупных партий препаратов одного класса, выбора в рамках группы препарата с наилучшим показателем стоимость - эффективность.
Система ограничения применения антибиотиков
Система ограничения применения антибиотиков может иметь два варианта.
Первый из них состоит в том, что в клинике создается так называемый список резервных, ограниченных к применению антибактериальных препаратов.
Назначая пациенту антибиотик из резервного списка, врач получает из аптеки препарат только для начала терапии (на 1-2 дня), для продолжения курса он заполняет письменное требование с обоснованием выбора антибиотика. В случае, если клиническией фармаколог признает назначение антибиотика оправданным, пациент продолжает получать назначенный препарат. В противном случае клинический фармаколог или химиотерапевт обсуждает обоснованность выбора антибиотика с лечащим врачом.
Второй вариант ограничения применения антибиотиков заключается в предварительной консультации лечащего врача со специалистом по инфекционным заболеваниям (клинический фармаколог, химиотерапевт) перед тем, как назначить препарат из резервного списка. Фармакоэкономические преимущества, которые имеет система ограничения применения антибиотиков, такие же, как и при применении формулярной системы, однако при этом обеспечивается более строгий контроль за использованием антибиотиков.
В ряде исследований показано, что система ограничения применения антибиотиков позволяет сократить затраты клиник при проведении антибактериальной терапии на 30-40% [ 20, 21].
Парентеральная антибиотикотерапия вне стационара
Парентеральная антибиотикотерапия вне стационара входит в повседневную медицинскую практику во многих развитых странах. Принцип ее заключается в том, что при отсутствии противопоказаний ( табл.5) пациент может получать парентерально (в том числе и внутривенно) антибиотики амбулаторно или в домашних условиях [22].
Существует несколько моделей проведения парентеральной антибиотикотерапии вне стационара: "инфузионный центр", "медицинская сестра", "самостоятельное введение антибиотика", "процедурный кабинет" [22].
При данном подходе снижение затрат происходит за счет сокращения срока пребывания пациента в стационаре, снижения риска нозокомиальной инфекции, улучшения психологической и социальной адаптации пациента, большей комфортности лечения, более быстрого восстановления трудоспособности.
Табл. 5. Критерии для проведения парентеральной антибиотикотерапии на дому [22]
|
Выбор антибиотиков с длительным интервалом дозирования
Выбор антибиотиков с длительным интервалом дозирования позволяет сократить скрытые затраты на терапию. Под скрытыми затратами понимают расходы, связанные с введением лекарственного препарата - расходуемые материалы, рабочее время медицинского персонала, клинические анализы, терапевтический лекарственный мониторинг и др.
Т.Smyth и соавт. [23] в 1995г. представили результаты исследования, в котором проводилась сравнительная оценка прямых и скрытых: затрат при применении цефалоспоринов III поколения - цефтриаксона, цефтазидима и цефотаксима ( рис.2).
Как видно на рис.2, стоимость курса лечения, на первый взгляд, более дорогим антибиотиком цефтриаксоном реально оказывается меньшей, чем стоимость лечения цефотаксимом или цефтазидимом.
Можно выделить следующие фармакоэкономические преимущества выбора антибиотика с длительным интервалом дозирования:
повышение комфортности лечения для пациента (уменьшение количества инъекций);
уменьшение количества постинъекционных осложнений;
снижение скрытых затрат на антибиотикотерапию;
снижение затрат на антибиотик (не всегда!)

Рис. 2. Сравнительный анализ стоимости 7-дневного курса лечения цефалоспоринами III поколения [23]
Монотерапия
Учитывая затраты, связанные с введением антибактериального препарата, преимущества монотерапии по сравнению с использованием комбинации антибиотиков очевидны:
снижение скрытых затрат на антибиотикотерапию;
снижение затрат на антибиотик (не всегда!);
повышение комфортности лечения для пациента (уменьшение количества инъекций);
уменьшение количества постинъекционных осложнений.
В качестве клинического примера антибактериальной монотерапии можно рассмотреть результаты сравнительных исследований применения антибиотика широкого спектра имипенема при нейтропенической лихорадке и интраабдоминальной инфекции (табл. 6, 7).
Клиническая эффективность монотерапии имипенемом при нейтропенической лихорадке и интраабдоминальной инфекции была равной или даже превосходила таковую комбинации антибиотиков, традиционно используемых для лечения данных заболеваний. Кроме того, при назначении имипенема, в отличие от аминогликозидов, не требуется терапевтического лекарственного мониторинга и отсутствует риск ото- и нефротоксичности.
Табл. 6. Клиническая эффективность (КЭ) имипенема по сравнению с комбинированной терапией при нейтропенической лихорадке в сравнительных рандомизированных исследованиях [24]
|
Табл. 7. Клиническая эффективность (КЭ) имипенема по сравнению с комбинированной терапией при лечении интраабдоминальных инфекций в сравнительных, рандомизированных исследованиях [24]
