Л.С. Страчунский, О.Л. Розенсон
Расходы лечебных учреждений на приобретение лекарственных средств в среднем составляют 15-20% от бюджета, из них на долю антиинфекционных препаратов приходится 50-60%, что заставляет искать новые подходы к их применению [ 1, 2]. Одним из таких подходов является ступенчатая терапия (в англоязычной литературе: sequential therapy, streamline therapy, step-down therapy, switch therapy, follow-on therapy, deescalation therapy). Ступенчатая терапия - двухэтапное применение антиинфекционных препаратов с переходом с парентерального на непарентеральный (как правило, пероральный) путь введения в возможно более короткие сроки с учетом клинического состояния пациента. Основная идея ступенчатой терапии заключается в сокращении длительности парентерального введения антиинфекционного препарата, что может привести к значительному уменьшению стоимости лечения, сокращению срока пребывания в стационаре при сохранении высокой клинической эффективности терапии.
Несмотря на очевидные преимущества ступенчатой терапии, в силу разных причин (отсутствие оральных антибиотиков или сомнение в их эффективности, сложившиеся стереотипы и т.д.) она не всегда применяется на практике. По данным R.Quintiliani и соавт. [3], 75% госпитализированных пациентов с различными инфекциями могли быть переведены с парентерального на пероральный путь введения антибактериальных препаратов. В США ступенчатая терапия одобрена FDA (Food and Drug Administration) и изложена в Общих рекомендациях этой организации по проведению клинических испытаний [4]. Следует иметь в виду, что угрожающие жизни инфекции, такие как бактериальный эндокардит, менингит и др., на протяжении почти всего курса антибактериальной терапии требуют назначения парентеральных антибиотиков, тогда как при инфекциях мочевыводящих путей могут быть с самого начала назначены оральные препараты. Перечень инфекционных заболеваний, при которых проведены контролируемые клинические испытания и накоплен значительный опыт ступенчатой терапии, включает в себя пневмонию, инфекции урогенитального тракта, септицемию, инфекции кожи и мягких тканей, остеомиелит, интраабдоминальные инфекции [ 5, 6].
Первые работы по ступенчатой терапии появились в медицинской литературе в 70-е годы. T.Tetzlaff и соавт. [7], C.Prober и A.Yaeger [8] показали клиническую эффективность ступенчатого подхода при лечении остеомиелита и инфекционного артрита, используя различные парентеральные и оральные b-лактамные антибиотики (парентеральные - метициллин, цефазолин, ампициллин, оральные - цефалексин, феноксиметилпенициллин, ампициллин, диклоксациллин). R.Feigin и соавт. [9] успешно применяли при этих заболеваниях парентеральный клиндамицин с последующим переходом на его оральную форму. F.Schann и соавт. [10] продемонстрировали клиническую эффективность ступенчатой терапии хлорамфениколом у госпитализированных детей с пневмонией. Эти исследования внесли ценный вклад в формирование нового подхода к применению антибактериальных препаратов, хотя они не были рандомизированными, проспективными исследованиями. На сегодняшний день проведен целый ряд контролируемых клинических испытаний, убедительно подтвердивших клиническую эффективность ступенчатой терапии. Более того, в последнее время ступенчатая терапия стала предметом фармакоэкономических исследований, которые показали, что она способна значительно сократить расходы лечебных учреждений.
Преимущества ступенчатой терапии
Ступенчатая терапия обеспечивает клинические и экономические преимущества как пациенту, так и лечебному учреждению, причем отдельные из них, например, снижение частоты возникновения нозокомиальных инфекций или постинъекционных осложнений нельзя отнести только исключительно к одной группе. Однако в целом, в экономическом отношении она в большей степени затрагивает лечебное учреждение, а в клиническом - пациентов. Преимущества для пациента связаны, во-первых, с уменьшением количества инъекций, что делает лечение более комфортным и уменьшает риск возникновения постинъекционных осложнений - флебитов, постинъекционных абсцессов, катетер-ассоциированных инфекций. По данным J.Ramirez и соавт. [11], последние встречаются редко (1 случай за 200 дней), однако стоимость лечения каждого такого случая в среднем составляет около $3700. Во-вторых, в случае положительной динамики заболевания и отсутствия необходимости в лечебно-диагностических мероприятиях, требующих пребывания пациента в стационаре, он может выписаться раньше и продолжать лечение в домашних условиях, что благоприятно сказывается на психоэмоциональном состоянии больного. В-третьих, сокращение срока госпитализации позволяет снизить частоту нозокомиальной инфекции ( рис.1).
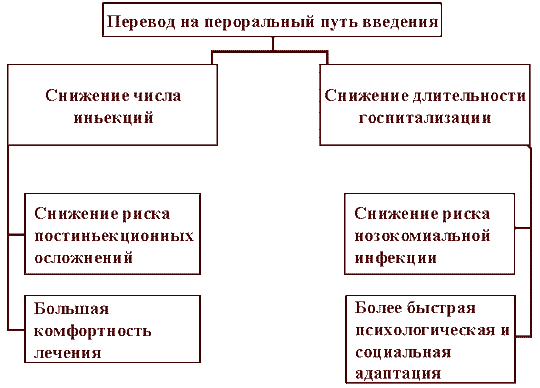
Рис. 1. Преимущества ступенчатой терапии для пациента
Преимущества для стационара складываются из следующих факторов:
1.Снижение затрат в связи с меньшей стоимостью оральных антибиотиков ( табл.1).
2.Снижение расходов при применении оральных антибиотиков, что связано с устранением дополнительных затрат на введение парентеральных препаратов: специальные медицинские принадлежности (шприцы, иглы, системы для введения инфузионных растворов, перчатки, дезинфектанты и др.); стерилизация; рабочее время среднего медперсонала; терапевтический лекарственный мониторинг (при применении аминогликозидов, ванкомицина); утилизация шприцов, игл и других расходуемых материалов.
3.Ранняя выписка из стационара, так как оральные антибиотики можно принимать в домашних условиях. Стоимость одного дня пребывания в стационаре в США составляет в среднем 752 доллара, в Великобритании - 350 фунтов [11]. В России она варьирует от от 60000 до 500000 рублей [12]; эти данные, очевидно, заниженные вследствие ограниченного бюджетного финансирования системы здравоохранения.
4.Снижение риска возникновения нозокомиальной инфекции, в том числе и постинъекционных осложнений, а также расходов, связанных с их лечением.
Таблица1. Стоимость отдельных антибиотиков, используемых при проведении ступенчатой терапии [12]
| Антибиотик (производитель) | Разовая доза, мг (путь введения) | Закупочная стоимость, $ | * |
| Ампициллин натрия (Россия) | 500 (в/в, в/м) | 0,20 | +39 |
| Ампициллин тригидрат (Россия) | 500 (внутрь) | 0,17 | |
| Цефуроксим натрия (GW) | 750 (в/в, в/м) | 3,12 | +28 |
| Цефуроксим аксетил (GW) | 500 (внутрь) | 2,26 | |
| Ципрофлоксацин (KRKA) | 400 (в/в) | 2,44 | +78 |
| 500 (внутрь) | 0,54 | ||
| Клиндамицина фосфат (Upjohn) | 600 (в/в, в/м) | 8,62 | +86 |
| Клиндамицина гидрохлорид (Upjohn) | 600 (внутрь) | 1,24 | |
| Метронидазол (RPR) | 500 (в/в) | 3,95 | +95 |
| 500 (внутрь) | 0,18 | ||
| Сульфаметоксазол | 800/160 (в/в) | 1,97 | +95 |
| Триметоприм (Polfa) | 800/160 (внутрь) | 0,1 | |
| Флуконазол (Pfizer) | 100 (в/в) | 15,99 | +55 |
| 100 (внутрь) | 7,22 |
* Разница в стоимости парентеральных и оральныx препаратов за разовую дозу.
Ограничения ступенчатой терапии
Наряду с преимуществами можно выделить определенные клинические и экономические ограничения ступенчатой терапии. Первые из них связаны с тем, что существует риск клинической неэффективности вследствие снижения приверженности (compliance) пациента при приеме оральных антибиотиков (т.е. желания пациента выполнять рекомендации и назначения врача). Основными факторами, влияющими на этот показатель, являются свойства лекарственного препарата, характер заболевания (острое, хроническое), индивидуальные особенности пациента, поведение медицинского персонала. Приверженность зависит от кратности приема препарата, длительности курса, лекарственной формы, связи с приемом пищи, переносимости. Для оральной суспензии имеют значение запах, вид, консистенция, вкус, послевкусие. S.Eisen и соавт. [13] при 10-дневном курсе терапии показали прямую зависимость между частотой приема антибиотика и приверженностью пациента: при однократном приеме она составила 84%, двукратном - 75% и трехкратном - 59%. J.Cramer и соавт. [14] опубликовали сходные данные; при назначении лекарственного препарата 4 раза в сутки приверженность снижалась до 39%, поэтому предпочтение следует отдавать оральным антибиотикам, которые можно назначать 1-2 раза в сутки.
Лекарственные взаимодействия, существенно влияя на биодоступность отдельных оральных антибиотиков, могут быть причиной снижения их эффективности. Так, антациды, препараты железа и кальций (молочные продукты) снижают всасывание оральных фторхинолонов, тетрациклина, поэтому пациенту, получающему эти препараты, следует делать двухчасовой интервал между ними и приемом вышеуказанных антибиотиков. Причиной клинической неэффективности может быть заниженная доза перорального антибиотика, а в случае назначения на втором этапе препарата другого класса - резистентность к нему возбудителя и/или нежелательные реакции, которые потребуют отмены антибиотика.
Относительные экономические недостатки ступенчатой терапии связаны с ранней выпиской и продолжением лечения в амбулаторных условиях, что вынуждает самого пациента покупать антибиотик для завершения курса лечения. Однако, это не касается пациентов, имеющих медицинскую страховку (полис) или льготы на приобретение лекарственных препаратов.
Сроки и условия перевода пациента на пероральный прием антибиотиков
Важным фактором при ступенчатой терапии является срок перевода пациента на пероральный путь введения антибиотика; ориентиром могут служить стадии инфекции. R.Quintiliani исоавт. [15] выделяют три стадии инфекционного процесса у пациентов, находящихся на стационарном лечении: I стадия продолжается 2-3 дня и характеризуется нестабильной клинической картиной, возбудитель и его чувствительность к антибиотику, как правило, не известны, антибактериальная терапия носит эмпирический характер, чаще всего назначают препарат широкого спектра действия.
На II стадии клиническая картина стабилизируется или улучшается, возбудитель и его чувствительность могут быть установлены, что позволяет провести коррекцию терапии.
На III стадии (примерно через 7 дней от начала заболевания) наступает выздоровление и антибактериальная терапия может быть завершена.
Оптимальным временем для перевода пациента на пероральную терапию является II стадия инфекционного процесса. J.Ramirez и S.Ahkee [11] приводят данные о сроках перевода на пероральный прием кларитромицина 59 пациентов с внебольничной пневмонией, первоначально получавших антибиотик внутривенно. В среднем время перевода на оральный кларитромицин составило 3 дня (у 7% пациентов в первые сутки антибактериальной терапии, у 27% на вторые сутки, у 41% на третьи, у 14% на четвертые и у 12% на пятые). Выделяют клинические, микробиологические и фармакологические критерии перевода пациента на второй этап ступенчатой терапии ( табл.2).
Табл. 2. Критерии перевода больного на пероральный антибиотик [16 с изменениями]
|
||||||||
* СРБ - С-реактивный белок.
Требования к оральным антибиотикам
Выбирая оральный антибиотик, необходимо учитывать его спектр активности, фармакокинетические характеристики, взаимодействие с другими препаратами, переносимость, а также достоверные данные о его клинической эффективности при лечении конкретного заболевания. Оральные антибиотики отличаются друг от друга по биодоступности ( табл.3). Предпочтение следует отдавать препарату с наибольшей биодоступностью, ее необходимо учитывать и при определении дозы. При назначении антибиотика врач должен быть уверен, что его концентрация в очаге инфекции будет превосходить минимальную подавляющую концентрацию (МПК) для возбудителя. Наряду с этим, следует учитывать такие фармакодинамические параметры, как время сохранения концентрации выше МПК, площадь под фармакокинетической кривой, площадь под фармакокинетической кривой выше МПК и другие. После выбора перорального антибиотика и перевода пациента на второй этап ступенчатой терапии необходимо продолжать динамический контроль за его клиническим состоянием, переносимостью антибиотика и приверженностью к проводимой терапии. Назначая пероральный антибиотик, следует всегда иметь в виду спектр его нежелательных реакций. Например, при использовании b-лактамов выше риск аллергических реакций, фторхинолоны не рекомендуют применять у детей, беременных и кормящих женщин вследствие их негативного влияния на развитие хрящевой ткани. В случае развития у пациента нежелательных явлений в первую очередь следует определить их связь с антибиотиком, тяжесть и только потом принимать решение об отмене препарата.
Табл. 3. Биодоступность отдельных оральных антибиотиков [17]
| 100-80% | 80-50% | <50% |
| Цефаклор Цефалексин Хлорамфеникол Ципрофлоксацин Клиндамицин Доксициклин Офлоксацин Амоксициллин Триметоприм | Цефтибутен Диклоксациллин | Ампициллин Цефиксим Цефподоксим Цефуроксим аксетил Оксациллин Норфлоксацин Феноксиметил-пенициллин Эритромицин |
Выбор оптимального антибиотика для ступенчатой терапии не является простой задачей. Р.Jewesson [18] приводит характеристики "идеального" перорального антибиотика для второго этапа ступенчатой терапии.
Оральный антибиотик тот же, что и парентеральный.
Доказанная клиническая эффективность при лечении данного заболевания.
Наличие различных оральных форм (таблетки, растворы и т.д.).
Высокая биодоступность.
Отсутствие лекарственных взаимодействий на уровне всасывания.
Хорошая переносимость при пероральном приеме.
Длительный интервал дозирования.
Низкая стоимость.
Варианты ступенчатой терапии
В зависимости от орального антибиотика выделяют 4 варианта ступенчатой терапии [18]: (I) парентерально и внутрь назначают один и тот же антибиотик; оральный антибиотик обладает хорошей биодоступностью; (II) парентерально и внутрь назначают один и тот же антибиотик; оральный препарат имеет низкую биодоступность; (III) парентерально и внутрь назначают разные антибиотики; оральный антибиотик обладает хорошей биодоступностью; (IV) парентерально и внутрь назначают разные антибиотики; оральный препарат имеет низкую биодоступность.
С теоретической точки зрения идеальным является первый вариант. Второй вариант ступенчатой терапии приемлем при инфекциях легкой или средней тяжести, когда возбудитель высоко чувствителен к применяемому оральному антибиотику, а у пациента нет иммунодефицита. На практике чаще всего используется третий вариант, так как не все парентеральные антибиотики имеют пероральную форму. По нашему мнению, оправданным является применение на втором этапе ступенчатой терапии орального антибиотика по крайней мере того же класса, что и парентеральный препарат, так как использование антибиотика другого класса может стать причиной клинической неэффективности вследствие резистентности к нему возбудителя, неэквивалентной дозы или новых нежелательных реакций.
Клинические и фармакоэкономические исследования ступенчатой терапии
Клиническая эффективность ступенчатой терапии при различных инфекционных заболеваниях была доказана в ходе многочисленных клинических исследований. Как видно из табл.4, наиболее часто на втором этапе ступенчатой терапии использовались b-лактамные антибиотики, на первом этапе в большинстве случаев применялись цефалоспорины первого и второго поколений. Примером ступенчатой терапии является применение парентерального антибиотика цефуроксим натрия с последующим переводом пациента на прием цефуроксимаксетила внутрь. A.Miller и F.Hancock [20] в сравнительном рандомизированном многоцентровом исследовании изучили клиническую эффективность, безопасность и стоимость терапии цефуроксимом и цефотаксимом у 305 пациентов с инфекциями различной локализации (в основном дыхательных путей). Цефуроксим натрия (по 750мг внутривенно 2 раза в сутки), а затем цефуроксим аксетил (по 500мг 2 раза в сутки) получал 151 пациент; у 154 больных проводилась терапия цефотаксимом (по 1 г внутривенно 3 раза в сутки). В группе цефуроксима пациенты были переведены на второй этап ступенчатой терапии в среднем через 3,6 (0,6-9,5) суток, средняя продолжительность терапии в группе цефотаксима составила 5,6 (0,6-13,6) суток. Клиническая эффективность составила 82% в каждой группе. Нежелательные явления наблюдались у 27% пациентов в группе цефуроксима (внутривенно/внутрь) и 23% больных в группе цефотаксима. Анализ стоимости (стоимость антибиотика + стоимость его введения) показал преимущество ступенчатой терапии цефуроксимом перед применением цефотаксима: соответственно 84 и 105 фунтов стерлингов при назначении парентеральных форм антибиотиков в виде внутривенных инъекций и 125 и 163 фунтов стерлингов при назначении их в виде внутривенных инфузий. Таким образом, с экономической точки зрения ступенчатая терапия превосходила терапию цефотаксимом при равной клинической эффективности и переносимости. Наряду с цефуроксимом для ступенчатой терапии могут применяться и другие цефалоспорины. Так, вполне обоснованным может быть применение цефтриаксона с последующим переводом на цефтибутенцефподоксим, цефиксим [21] и другие пероральные цефалоспорины III поколения.
Еще одним примером ступенчатой терапии являются результаты многоцентрового, проспективного, рандомизированного, сравнительного исследования цефуроксима и ко-амоксиклава у 512 пациентов с инфекциями нижних отделов дыхательных путей (внебольничная пневмония, обострение хронического бронхита, бронхоэктатическая болезнь) [22]. Сравнивали клиническую и микробиологическую эффективность цефуроксима натрия (по 750мг внутривенно 3 раза в сутки) с последующим назначением цефуроксима аксетила (по 500мг внутрь 2 раза в сутки) и ко-амоксиклава (по 1200мг внутривенно 3 раза в сутки, а затем по 625мг внутрь 3 раза в сутки). Продолжительность первого этапа ступенчатой терапии составляла от 48 до 72ч. Эффективность двух схем терапии была одинаковой ( рис.2), следует учитывать, что цефуроксим аксетил назначали 2 раза в сутки, а ко-амоксиклав - 3 раза в сутки.
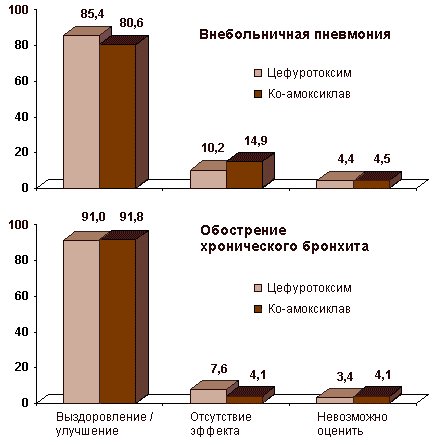
Рис.2. Клиническая эффективность ступенчатой терапии цефуроксимом и ко-амоксиклавом у стационарных больных с внебольничной пневмонией и обострением хронического бронхита (по оси ординат % больных)
Таким образом, ступенчатая терапия является фармакоэкономически обоснованным режимом антибактериальной терапии, обеспечивающим преимущества как для пациента, так и стационара. Ступенчатая терапия может применяться в любых лечебных учреждениях, она не влечет за собой дополнительных вложений и затрат, а требует лишь изменения привычных подходов врачей к проводимой антибактериальной терапии.
Список литературы
Jewesson P. Cost-effectiveness and value of an IV switch. PharmacoEconomics, 1994, 5(Suppl2), 20-26.
Jewesson P. Pharmaceutical, pharmacokinetic and other considerations for intravenous to oral stepdown therapy. Can. Infect. Dis. J., 1995, 6 (Suppl.A), 11-16.
Quintiliani R., Nightingale C., Crowe H. et al. Strategic antibiotic decision-making at the formulary level. Rev. Inf. Dis., 1991, 13, S770-S777.
Beam T., Gilbert D., Kunin C. General consideration for the clinical evaulation of anti-infective drug products. Clin. Infect. Dis., 1992, 15, S5-S32.
Ramirez J. Advances in antibiotic use: switch therapy. Curr. Ther. Res., 1993, 55 (A), 30-34.
Janknegt R., van der Meer J. Sequential therapy with intravenous and oral cephalosporins. J. Antimicrob. Chemother., 1994, 33, 169-177.
Tetzlaff T., McCracken G., Nelson J. Oral antibiotic therapy for skeletal infections of children. J. Pediatr., 1978, 92, 485-490.
Prober C., Yaeger A. Use of the serum bactericidal titer to assess the adequacy of oral antibiotic therapy in the treatment of acute hematogenous osteomyelitis. J. Pediatr., 1979, 95, 131-135.
Feigin R., Pickering L., Anderson D. et al. Clindamycin therapy of osteomyelitis and septic arthritis in children. Pediatrics, 1975, 55, 213-223.
Shann F., Barker J., Poor P. Chloramphenicol alone versus chloramphenicol plus penicillin for severe pneumonia in children. Lancet, 1985, 2, 684-685.
Ramirez J., Ahkee S. Cost-savings associated to early switch from intravenous antimicrobials to oral clarithromycin for the treatment of hospitalized patients with community-acquired pneumonia [abstract 12.06]. In: Abstracts of the 3rd ICMAS, Lisbon, Porugal, 1996, 83.
Российский фармацевтический бюллетень 1997, 40.
Eisen S., Miller D., Woodward R. et al: The effect of prescribed daily dose frequency on patient medication compliance. Arch. Intern. Med., 1990, 150, 1881-1884.
Cramer J., Mattson R., Prevey M. et al. How often medication taken as prescribed? A novel assessment technique. JAMA, 1985, 261, 3273-3277.
Quintiliani R., Cooper B., Briceland L. et al. Economic impact of streamlining antibiotic administration. Am. J. Med., 1987, 82 (Suppl.4A), 391-394.
Nathwani D. Cost-effectiveness considerations for combination therapies. In: Antibiotic combination therapy - the role of ciprofloxacin. Cambridge Medical
8-09-2015, 21:40
