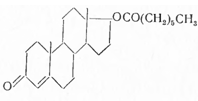
Получают по схеме:
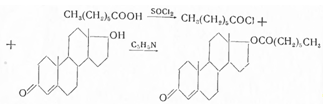
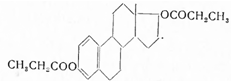
Энантовую кислоту, т. кип. 116—118°, при 14 мм рт. ст. с помощью хлористого тионила превращают в хлорангидрид, т. кип. 65—66° при 14 мм рт. ст. и последний взаимодействием с тестостероном (в сухом пиридине и бензоле) при 50—55° в тестостерон-энантат. Для удаления избытка хлорангидрида энантовой кислоты смесь перемешивают с диэтиламиноэтанолом и выливают в раствор разбавленной соляной кислоты. После отгонки бензола получают энантат тестостерона, т. пл. 36—37,5°, удельное поглощение 390. При гидролизе спиртовым раствором едкого кали, с последующей очисткой ацетоном, температура плавления выделенного тестостерона 151—153°. Чистоту препарата определяют по отсутствию сульфатной золы и энантовой кислоты. Примесь последней определяют алкалиметрическим титрованием в спиртовой среде в присутствии индикатора фенолфталеина (содержание ее не должно превышать 0,15%).
Хранят с предосторожностью (список Б)
Применяют для тех же целей, что и тестостерон-пропионат; обладает более сильным и более длительным андрогенным действием. Вводят внутримышечно в виде 5%-ного масляного раствора по 1 мл.
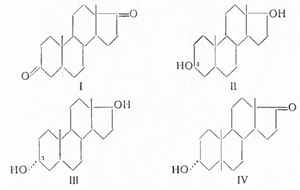
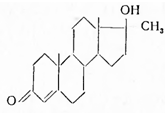
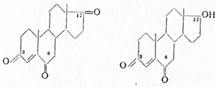
Физиологическое действие андрогенов зависит от характера кислородных заместителей, но еще в большей степени от их пространственной конфигурации и характера сочленения колец в молекуле. Так, андростандион-3,17 (I) обладает активностью 130γ, почти равной активности андростерона, а андростандиол-3α, 17ß(II) — активностью в 20—25γ. С другой стороны, эпиандростерон (III) в 5—6 раз менее активен, чем андростерон, а изомер последнего — тестанол-3-он-17 (IV) с цис-сочленением колец А и В вообще неактивен:
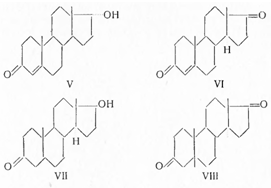
Аналогично 17-изотестостерон (V) в 20 раз слабее тестостерона, а Δ4 -андростендион (VI) слабее его лишь в 5—6 раз. Дигидротестостерон (VII) не отличается по силе действия от тестостерона, а 5-эпимер андростандиона- 3,17 (VIII) с цис-сочленением колец А и В неактивен:
Высокую андрогенную активность обнаруживают дитестостерон-янтарный и глутаровый эфиры (1949), а также гликозиды и ацетали тестостерона. Полученный из тестостерон-пропионата и пропандиола-1,3 в присутствии толуол сульфокислоты тестостерон-пропионат пропандиол-(Г,3') ацеталь обнаружил пролонгированное действие; в дозах 100у он действует 22 дня на петушиный гребень, в то время как тестостерон 15 дней. Как показали Ружичка и Кэги (1937 г.), 17-р-тестостерон в 15—25 раз менее активен, чем его 17-а-изомер; исключение представляет Дб -андростен-3-а-17-Рдиол, который лишь в 5 раз менее активен, чем его транс-аналог.
2.4 Метилтестостерон
Меlтеsтosтеrоnum. Метилтестостерон. 17-α-метилтестостерон. 17-α-метил –Δ4 -андростен-3-он-17-ол. С20 Н30 О2 . М = 302,4
Синонимы: Androral, Oraviron, Testoral идр.
Получают действием магнийбромметила на 3-ацетатдегидроэпиандростерона-17 в эфире, с последующим окислением образовавшегося 17-метиландростендиола-3,17 по Оппенауэру (циклогексаноном в присутствии изобутилата алюминия и толуола):
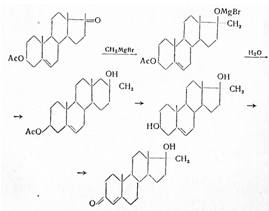
17-Метилтестостерон — белый или белый с кремовым оттенком кристаллический порошок, т. пл. 161—167°, без запаха, не растворим в воде, растворяется в спирте, эфире, ацетоне, мало растворим в растительных маслах. Удельный показатель поглощения от 520 до 540 (с = 0,001, 95%-ный спирт) при длине волны 240 ммк. На воздухе слегка гигроскопичен. При ацетилировании уксусным ангидридом в присутствии пиридина, образует 17-ацетат-17α-метилтестостерона т. пл. 173-176°.
При оксимировании гидрохлоридом гидроксиламина, в присутствии ацетата натрия в среде метилового спирта, образует 3-оксим 17-метилтестостерона, т. пл. 210—216°.
Чистоту препарата определяют по потере в весе (не более 1,5%) при высушивании до постоянного веса при 100—105° и отсутствии сульфатной золы (не более 0,1%).
Хранят с предосторожностью (список Б), в хорошо закупоренных банках, защищенных от действия света.
Высшая разовая доза — 0,05 г, суточная — 0,1 г.
Применяют при половом недоразвитии и функциональных нарушениях половой сферы, а также при маточных кровотечениях в предклимактерическом и климактерическом периодах. Для большего эффекта действия рекомендуют сублингвальное применение; таблетку метилтестостерона задерживают под языком до полного рассасывания.
Выпускают в таблетках по 0,005 г.
2.5 Метиландростендиол
Methylandrostendiolum. Methandriolum. Метиландростендиол. 17-α-метил-Δ5 -андростен-3β-17β-диол. С20 Н32 О2 . М = 304,48.
Синонимы: Androdiol, Metandiol, Notandron, Testodiol идр.
Является промежуточным продуктом при синтезе 17-метилтестостерона. 17-Метиландростендиол — белый кристаллический порошок. Не растворим в воде и мало в спирте, растворяется в хлороформе, пиридине и кипящем метиловом спирте, т. пл. 202—206°. Раствор препарата в 80%-ной уксусной кислоте в присутствии концентрированной серной кислоты дает на границе слоев оранжевую полосу и затем зеленовато-желтую флуоресценцию. При ацетилировании уксусным ангидридом, в присутствии пиридина, образуется ацетильное производное, т. пл. 133—136°.
Чистоту препарата определяют по отсутствию кетостероидов (0,002 г препарата растворяют в 1 мл 95%-ногоспирта и прибавляют 1 мл 95%-ного раствора м-динитробензола и 1 мл 15%-ного раствора едкого натра — спустя 1 ч раствор не должен быть темнее смеси 1 мл 95%-ного спирта с теми же реактивами).
Хранят с предосторожностью (список Б), в сухом месте, защищенном от действия света. Применяют сублингвально для усиления белкового анаболизма у реконвалесцентов после тяжелых травм, операций, инфекционных и других заболеваний по 0,025—0,05 г на прием в виде таблеток. Обладая значительно меньшей андрогенной активностью, нежели метилтестостерон, препарат может применяться и в женской практике с целью повышения анаболизма, а также для уменьшения активности фолликулярного гормона в климактерическом периоде (и при раке молочной железы).
При длительном применении иногда наблюдается усиленный рост волос на лице и туловище и увеличение сальности кожи.
Кувада и Мнгасака (1938) синтезировали различные эфиры 17-метилтестостерона, но не получили интересных для медицины препаратов. Недеятельным оказался 17-аллилтестостерон, синтезированный Бутенандтом и Петерсом (1938 г.).
При окислении Δ4 -двойной связи тестостерона перекисью водорода получено соединение строения:
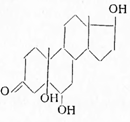
не обладающее андрогенной активностью. Аналогичны и другие полиоксисоединения, как андростантриол-3,5,6-он-17, андростантрион-3,16,17-ол-5, Δ5 -андростентрион-3,4,17 и андростантриол-3,14,17 — оказались неактивными. Напротив, андростентрион-3,6,17 и 6-оксотестостерон в опытах на кастрированных крысах (самках) вызывали течку, т. е. проявляли активность женского гормона. 3-Галогенопроизводные дегидроэпиандростерона неактивны, но 17-хлор-Δ5 -андростенол-3-ацетат достаточно активен (Вестфаль); слабой биологической активностью обладают 17-аминопроизводные андростана.
Замена пятичленного кольца Dна шестичленное приводит к незначительному уменьшению активнрсти D-гомотестостерона (20—30γ). Он получен из циангидрина дегидроэпиандростерона (I), который при восстановлении дает оксиамин (II), а при действии на него азотистой кислоты перегруппировывается по Демьянову с расширением кольца вD-гомоаналог дегИ дроэпиандростерона (III) и по методу Мамоли переводится в D-гомо- тестостерон (IV):
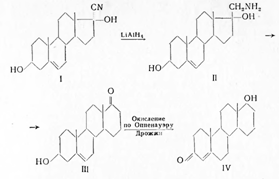
Полученный из Зα-окси-D-гомоандростерона 4,5-гомодигидротестостерон действует в опытах на крысах аналогично дигидротестостерону.
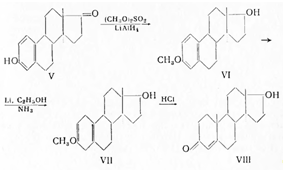
Для проявления андрогенной активности необязательно присутствие С19 -метильной группы; 19-нортестостерон также обладает андрогенной активностью. Он получается из эстрона (V) через метиловый эфир эстрадиола, с последующим восстановлением ароматического кольца литием и спиртом в жидком аммиаке в метоксикарбинол (VI); последний при кислотном гидролизе переходит в 19-нортестостерон (VII):
2.6 Определение подлинности препаратов андрогенов
Наиболее достоверно подлинность лекарственных веществ можно подтвердить рекомендуемым ФС и МФ методом ИК-спектроскопии. ИК-спектр испытуемого вещества, снятый в вазелиновом масле в области 3700-400 см-1 , должен иметь полное совпадение с полосами поглощения спектра ГСО или прилагаемого к ФС рисунка спектра.
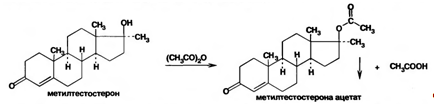
Для испытания подлинности используют реакции образования сложных эфиров и других производных указанных веществ, которые имеют стабильную температуру плавления. Так, при действии уксусным ангидридом получают моноацетаты метилтестостерона (т. пл. 173-176°С) и метандриола (т. пл. 174-180°С):
Тестостерона пропионат и метилтестостерон, содержашие в положении 3 кетонную группировку, при действии гидроксиламином образуют оксимы с температурой плавления соответственно 166-171°С и 210-216 °С. Оксим метилтестостерона образуется по схеме:
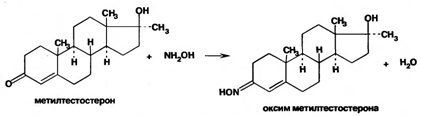
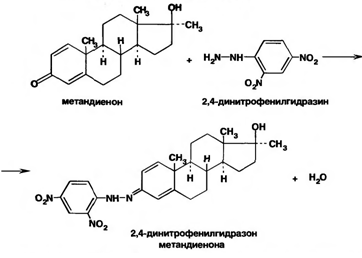
Метандиенон идентифицируют по образованию гидразона (окрашенного в оранжево-красный цвет) при взаимодействии с 2,4-динитрофенилгидразином:Аналогичную цветную реакцию дает тестостерона пропионат с изониазидом (гидразидом изоникотиновой кислоты).Образуется окрашенный в желтый цвет изоникотиноилгидразон. Реакцию используют для фотоколориметрического определения лекарственных форм тестостерона пропионата.
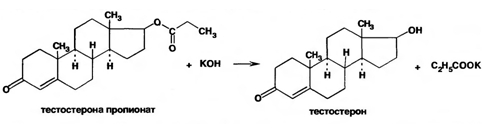
Тестостерона пропионат можно идентифицировать по сложноэфирной группировке, используя реакцию омыления с последующей проверкой температуры плавления выделяющегося тестостерона (150-156°С):
Можно применить также реакцию образования окрашенной комплексной соли железа (III) и пропионогидроксамовой кислоты:
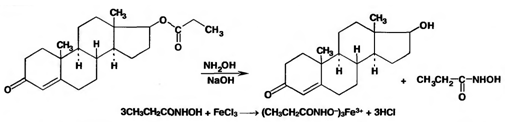
С помощью этой реакции можно отличить тестостерона пропионат от лекарственных веществ, не являющихся эфирами.
Для испытания на подлинность применяют (ФС) цветную реакцию на стероидные соединения с концентрированной серной кислотой. Метилтестостерон и мегандриол образуют при этом желто-оранжевое окрашивание с характерной зеленой флуоресценцией, а метандиенон — красное окрашивание. Подлинность тестостерона пропионата и метилтестостерона по МФ устанавливают с помощью ТСХ на адсорбенте кизельгур Р-1, в качестве проявителя используют раствор 4-толу- олсульфоновой кислоты в этаноле. Метод ТСХ рекомендован ФС для испытания подлинности тестостерона пропионата путем сравнения с ГСО. В тех же условиях определяют примеси посторонних стероидов в четырех указанных лекарственных веществах. Испытание выполняют на пластинках «Силуфол УФ-254», используя растворы анализируемых и стандартных образцов веществ-свидетелей (или ГСО) в хлороформе. Хроматограммы после высушивания просматривают в УФ-свете при 254 нм. Наличие допустимых количеств примесей (не более 1%) оценивают по совокупности величин и интенсивности пятен испытуемого лекарственного вещества и свидетеля. В метандиеноне устанавливают наличие примеси селена (не более 0,01%) методом сжигания в кислороде с последующей спектрофотометрией продукта взаимодействия селена с 3,3-диаминобензидина тетрагидрохлоридом в толуольном извлечении при длине волны 413 нм.
Метод УФ-спектрофотометрии ФС и МФ рекомендуют для испытания подлинности и количественного определения андрогенных и анаболических лекарственных веществ. Растворы в этаноле имеют максимумы поглощения у тестостерона пропионата при длине волны 240 нм, метилтестостерона — при 241 нм, метандиенона — при 245 нм. В метандриоле определяют светопоглощающие примеси, измеряя оптическую плотность (не более 0,5) 0,5%-ного раствора испытуемого вещества в этаноле при длине волны 240 нм. В соответствии с требованиями ФС в максимумах поглощения выполняют спектрофотометрическое определение указанных лекарственных веществ, используя растворитель этанол, который служит также раствором сравнения. Расчет содержания выполняют по удельному показателю поглощения (метилтестостерон — 540; метандиенон — 516) или по ГСО (тестостерона пропионат).
Метандриол количественно определяют (по ФС) поляриметрическим методом. Измеряют величину угла вращения спиртового раствора навески и рассчитывают содержание метандриола по величине удельного вращения.
Для надежной идентификации андрогенных и анаболических стероидов были использованы Н-ЯМР и масс-спектры. Выявлены химические сдвиги стандартных синглетных сигналов протонов С-18 и С-19, а также основные и характеристические ионы масс-спектров, полученных методом электронного удара. Для количественного определения применен также метод ВЭЖХ (Э.С. Матыев, А.П. Арзамасцев).
Андрогенные и анаболические стероидные лекарственные вещества хранят по списку Б, в хорошо укупоренной таре, предохраняя от действия света и влаги, под влиянием которых они могут постепенно разлагаться.
Тестостерона пропионат применяют как андрогенное лекарственное средство при климактерических, сосудистых и нервных расстройствах, а также для лечения рака молочной железы и яичников у женщин. Назначают его в виде 1%-ных или 5%-ных масляных растворов подкожно и внутримышечно. Метилтестостерон обладает аналогичным, но в 2-3 раза менее активным андрогенным действием. Он эффективен при приеме внутрь и подъязычном применении. Выпускают метилтестостерон в таблетках по 0,005 и 0,01 г. Метандиенон и метандриол обладают анаболическим действием, назначают их при нарушениях белкового обмена вследствие тяжелых травм, при коронарной недостаточности, язвенной болезни, инфаркте миокарда и т. д. Выпускают таблетки метандиенона по 0,005 г и метандриола по 0,25 г.
Глава 3. Эстрогенные гормоны
3.1 История
Эстрогенные или женские половые гормоны выделяются яичниками. В последних секретируются два типа гормонов: фолликулярные, или эстрогенные, вырабатываемые клетками созревающего фолликула и прогестенальный гормон (прогестерон), секретируемый клетками желтого тела, образующегося на месте разорвавшегося фолликула. Эстрогенные гормоны обеспечивают развитие женских половых органов, вызывают периодическое наступление овуляции, разрастание слизистой оболочки матки, подготовку ее к воспринятию яйца и развитию плода. Эстрогенные гормоны вызывают также развитие вторичных женских половых признаков. У животных эстрогенные гормоны вызывают течку. Течка вызывается также введением кастрированным животным (мышам) экстрактов яичника, и на этом явлении основан важнейший метод испытания активности женских половых гормонов, разработанный Алленом и Дойзи (1923 г.). У мышей и крыс отдельные стадии полового цикла распознаются при рассматривании под микроскопом мазка, взятого из влагалища, содержащего ороговевшие эпителиальные клетки. По методике авторов, исследуемое вещество растворяют в масле и вводят подкожно тремя порциями в течение 24ч. Одной мышиной единицей (ME) называют наименьшее количество вещества, которое у 70% мышей вызывает явления эструса. По международному соглашению 1939 г. для стандартизации женских гормонов используется кристаллический препарат, под названием эстрон, 0,1γ которого представляет собой 1 международную единицу (1 ME) эстрогенной активности. Чувствительность метода позволяет определить 0,1γ эстрона; чувствительность повышается при интравагинальном введении.
Выделение женского гормона долгое время представляло большие трудности, так как экстракты из яичников, наряду с гормонами, содержат большое количество примесей. Более пригодный источник эстрогенных гормонов был найден Цондеком в 1927 г., когда было установлено, что эстрогены содержатся в значительном количестве в моче беременных женщин. Исследованиями Бутенандта с сотр. (1939) и Онесона с сотр. (1952) найдено, что в моче беременных эстрон содержится в виде сульфата (I) и частично в виде глюкоронида (II):
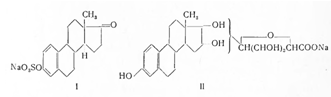
Получение эстрона Бутенандтом проводилось путем гидролиза мочи соляной кислотой и последующего извлечения гормона эфиром. После нейтрализации эфирного экстракта раствором гидрокарбоната натрия экстракт упаривался и экстрагировался толуолом. Из толуола гормоны извлекались 0,1 н. раствором едкого натра. Из 2 т мочи было выделено около 25 мг эстрона.
В дальнейшем, когда было найдено, что женские гормоны в значительно больших количествах содержатся в моче жеребых кобылиц и в моче жеребцов или меринов, были разработаны производственные методы получения эстрона.
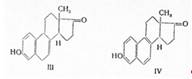
По методу М.Н. Лапинера (1936) гидролизованная моча жеребых кобылиц извлекается хлороформом и после отгонки растворителя остаток распределяется между эфиром и раствором щелочи; кристаллизацией из спирта получают эстрон с примесью эквилина (III) и эквиленина (IV):
При очистке большую помощь оказали реактивы Жирара Т и Р:
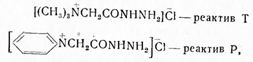
которые благодаря превращению гормона в растворимое соединение способствовали его изолированию. При последующем подкислении соляной кислотой выделялся кетон, который экстрагировался подходящим растворителем. Таким образом, Бутенандтом были выделены из мочи эстрадиол (V) и эстриол (VI). При нагревании эстриола с бисульфатом калия был выделен эстрон, чем подтверждено строение последнего; так как эстриол содержит три гидроксильные группы, то, следовательно, две из них расположены рядом. При сплавлении эстриола с едким кали получена дикарбоновая кислота (VII), которая при нагревании дала ангидрид (VIII), а не кетон, что указывало на наличие в молекуле эстриола (и, следовательно, эстрона) пятичленного кольца:
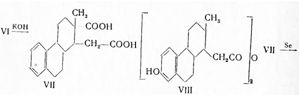
При нагревании кислоты (VII) с селеном был выделен 1,2-диметилфенантрол-7 (VIIIa), строение которого было подтверждено синтезом:
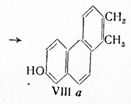
ространственное строение эстрона было доказано синтезом из дегидроэпиандростерона (IX) эстрадиола (XV) (Ингоффен) по схеме:
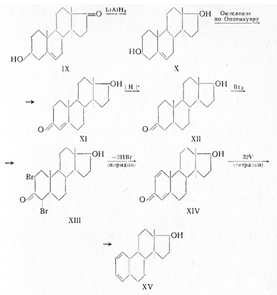
Важным доказательством в этой схеме строения эстрадиола явилось бромирование (XII) и получение дибромпроизводного (XIII), оказавшегося транс-кетоном. Транс-кетоны такого типа в отличие от цис-изомеров бромируются в положении 2 и 4, а цис-кетоны только в положении 4.
Образование других продуктов (X, XI, XII, XIV и XV) ясно из схемы.
Эстрогенные гормоны присущи животным организмам, но они найдены и в растениях, например эстрон, в вытяжке из кокосовых орехов и в женских цветках ивы.
Вначале, когда химия стероидных эстрогенов была недостаточно развита, применялись различные препараты: фолликулин — водный раствор, получаемый из очищенных экстрактов мочи жеребцов, беременных женщин и др., консервированный трикрезолом, масляный раствор фолликулина (Folliculinum oleosum), приготовленный из кристаллических препаратов смеси эстрона и его дигидропроизводного; масляный раствор эстрона, содержащий в 1 мл 0,5—1 мг кристаллического гормона, масляный раствор эстрона, содержащий в 1 мл 0,5—1 мг кристаллического гормона, масляный раствор бензоата фолликулина (Folliculinumbenzoatums. SolutioFolliculimbenzoatioleosa).
В настоящее время эти препараты отсутствуют в ГФ и используются лишь более эффективные, к которым принадлежат эстрадиол-монобензоат и эстрадиол-дипропионат, применяемые в виде масляных растворов.
3.2 Эстрадиол-монобензоат
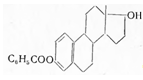
Estradiolum monobenzoicum. Эстрадиол-монобензоат. 3-монобензойный эфир β-эстрадиола. С25 Н23 О3 . М = 376,5.
Получают бензоилированием эстрадиола хлористым бензоилом по схеме:
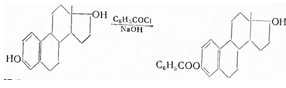
Продукт реакции промывают раствором едкого натра и перекристаллизовывают из спирта.
Эстрадиол-монобензоат — белый или желтоватый кристаллический порошок, без запаха, т. к. 191—196°, легко растворим в спирте и ацетоне, малорастворим в растительных маслах, не растворим в воде. Концентрированной серной кислотой окрашивается в зеленовато-желтый цвет с голубой флуоресценцией; при добавлении воды окраска переходит в бледножелтую. Чистоту препарата определяют по отсутствию эстрона (спиртовой раствор при нагревании со спиртовым раствором м-динитробензола и последующем действии едкого кали не должен окрашиваться в красный цвет).
Количественное определение препарата производят биологическим путем. 1 мг его должен содержать 10000ЕД (допускается отклонение от указанной активности ±25°о). Хранят с предосторожностью (список Б), в хорошо закупоренных склянках, в сухом месте, защищенном от действия света.
Эстрадиол является естественным гормоном, так как образуется в организме женщины вместе с эстроном. Являясь эфиром эстрадиола, он медленно всасывается и обладает пролонгированным действием.
Выпускают в ампулах по 1 мл 0,1%-ного раствора в масле для внутримышечного введения.
3.3 Эстрадиол-дипропионат
Estradiolum dipropionicum. Эстрадиол-дипропионат. Эфир эстрадиола и пропионовой кислоты. С23 Н31 О4 . М = 371,25.
Синонимы: Progynon, Synformon и др.
Получают этерификацией эстрадиола пропионовым ангидридом или хлорангидридом пропионовой кислоты:
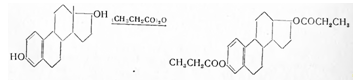
Эстрадиол-дипропионат — белый кристаллический порошок, не растворим в воде,
8-09-2015, 23:33
