Ацетат норэтистерона — белое кристаллическое вещество (т. пл. 158- 163°С), растворимое в этаноле, ацетоне и хлороформе.
Для испытания на подлинность и на присутствие посторонних примесей в прогестероне, норэтистероне и медроксип- рогестерона ацетате ФС и МФ рекомендуют метод ТСХ на пластинках Силуфол УФ-254 или с использованием в качестве адсорбента кизельгура Р1 (силикагеля Р1). Оценку производят после проявления хроматограмм путем сравнения положения, внешнего вида и интенсивности окраски основного пятна у испытуемого раствора и стандартного образца. Допустимое содержание примесей посторонних стероидов в прогестероне не должно превышать 1,5%.
Подлинность медроксипрогестерона ацетата подтверждают также по положительной реакции на ацетилированные соединения.
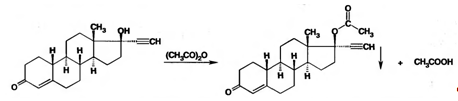
Норэтистерон можно количественно определить методом косвенной нейтрализации. В его основе лежат следующие химические реакции:
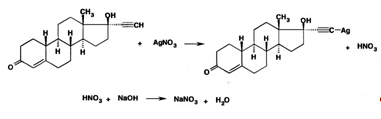
Атом водорода этинильного радикала замещается катионом серебра, образуя ацетиленид серебра. Выделившееся эквивалентное количество азотной кислоты оттитровывают гидроксидом натрия.
Количественное определение прогестерона по ФС выполняют спектрофотометрическим методом в максимуме поглощения (241 нм), используя в качестве растворителя этанол. Расчет содержания в пересчете на сухое вещество выполняют по величине предварительно установленного удельного показателя поглощения (535).
Определение содержания норэтистерона в таблетках выполняют методом УФ-спектрофотометрии при 263 нм, сравнивая оптическую плотность со стандартным образцом.
Описаны способы анализа прогестерона и его синтетических аналогов методом ВЭЖХ на колонках с прямой и обращенной фазами. Методика контроля качества смеси стероидных соединений прегнанового ряда предусматривает такие критерии разделения, как время удерживания, селективность, разрешение. Согласно требованиям НД фирм, производящих медроксипрогестерона ацетат, испытания на подлинность, однородность дозирования, наличие посторонних примесей и количественное определение выполняют методом ВЭЖХ. Подлинность подтверждают по сравнительному времени удерживания основного пика на хроматограмме у испытуемого и стандартного образцов. Последние используют в качестве внутреннего стандарта при выполнении количественного определения.
Прогестерон, норэтистерон и медроксипрогестерона ацетат хранят по списку Б, в сухом месте, в хорошо укупоренной таре, предохраняющей от действия света, при температуре не выше 20-25°С. Применяют в качестве гестагенных препаратов. Прогестерон назначают в виде 1%-ного или 2,5%-ного раствора в масле для инъекций. Норэтистерон сохраняет активность при подъязычном применении. Его назначают в виде таблеток «Норколут», содержащих по 0,005 г норэтистеро- на. Медроксипрогестерона ацетат проявляет не только гестагенное, но и противоопухолевое действие, особенно при раке матки и молочной железы. Назначают его внутрь в таблетках по 0,1-0,4 г, а также в виде растворов для инъекций в ампулах по 150 мг/мл. Депо-провера вводят внутримышечно в виде суспензии по 3,3 мл (0,5 или 0,15 г в 1 мл).
Глава 5. Кортикостероидные гормоны
5.1 Характеристика
В надпочечниках различают корковый и мозговой слои. Мозговой слой выделяет гормон адреналин, обладающий сосудосуживающим действием. Из коры надпочечников выделено 29 кристаллических стероидных соединений, получивших название кортикостероидов, из которых 6 оказались способными продлевать жизнь адреналэктомированных животных. Все они являются прегнановыми производными, содержащими в кольце А Δ4 -3-кетонепредельную группировку, а в положении 17-кетольную или диоксиацетоновую цепочку; часть из них при Сп имеет карбонильную или гидроксильную группу. Упомянутые кристаллические соединения обладают различной активностью как в качественном, так и в количественном отношениях. Так, дезоксикортикостерон (II), который относят к минералокортикоидам, регулирует солевой обмен; он способствует задержке в организме воды, натрия и повышает выделение из организма калия; кроме того, он усиливает явление анаболизма (синтез белка) и воспалительные процессы (повышает «воспалительный потенциал» организма), т. е. способность отвечать на раздражение воспалительной реакцией. Кортизон и другие родственные стероиды относят к глюкокортикоидам; они влияют на углеводный и белковый обмен и меньше на солевой обмен. По химическому строению стероидные гормоны надпочечников являются производными прегнана (I):
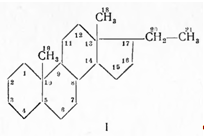
они могут быть разделены на 11-дезоксистероиды, например дезоксикорти костерон (II), 11-оксистероиды (III) и 11,17-диоксистероиды (IV)—кортизон и родственные ему соединения:
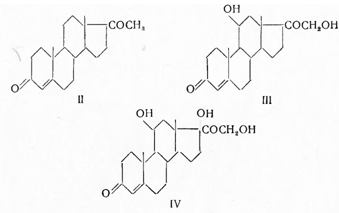
Представители глюкокортикоидов способствуют накоплению гликогена в печени, повышают содержание сахара в крови, вызывают увеличение выделения азота с мочой, обладают противовоспалительным действием.
Адренокортикотропный гормон гипофиза (АКТГ) является физиологическим стимулятором коры надпочечников, без которого невозможна нормальная функция последней.
5.2 Дезоксикортикостерон-ацетат
Desoxycorticosteronumaceticum. Desoxycorticosteroniacetas. Desoxycortoniacetas. Дезоксикортикостерон-ацетат. 11-дезоксикортикостерон-21-ацетат. С23 Н32 О4 . М = 372,51.
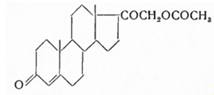
Синонимы: Соrtеnil, Соrtехоn, Соrtiron, DОСА и др. В отличие от многих кортикоидов, дезоксикортикостерон получен впервые в 1937 г. не изолированием из органов, а полусинтетическим путем (Штейгер, Рейхштейн) из 3β-ацетокси-5-этиеновой кислоты (I) — побочного продукта окисления 5,6-дибром-3-ацетата холестерина при синтезе дегидроэпиандростерона. С помощью тионилхлорида кислота эта превращена в хлорангидрид (II) и затем с помощью диазометана в диазокетон (III). При гидролизе 3-ацетильной группы едкой щелочью получен (IV), который ацетолизом превращен в 21-ацетокси-5-прегнен-3-ол-20-он. После присоединения одной молекулы брома образующийся дибромид (VI) окислен хромовой кислотой до 3-кетопроизводного (VII) и дебромированием цинковой пылью получен дезоксикортикостерон-ацетат (VIII):
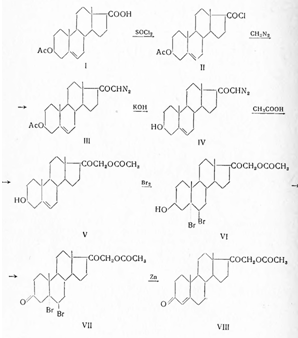
В дальнейшем метод этот (1940) был улучшен; диазокетон по Оппенауэру окислен до 21-диазопрогестерона (IV) и затем уже ацетолизом превращен в дезоксикортикостерон-ацетат (VIII).
Как показал далее Рейхштейн, 3-кето-4-этиеновая кислота (X), полученная окислением хромовой кислотой Зβ-окси-5-этиеновой кислоты (IX), после предварительного присоединения брома к двойной связи и последующего дебромирования, может быть превращена в 21-ацетоксипрегнан-3,20-дион (XIII), при бромировании с заменой водорода у С4 (XI) и отщеплении бромистого водорода с помощью пиридина (XII), а также других реакций, описанных ранее:
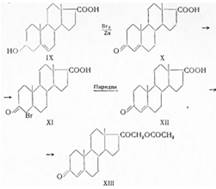
Вилдс и Шунк (1948) показали, что при действии оксалилхлорида на натриевую соль 3-кето-4-этиеновой кислоты (X) образуется хлорангидрид, который диазометаном переводят в 21-диазопрогестерон и действием затем уксусной кислоты в дезоксикортикостерон-ацетат.
Лучшие выхода получены Шормом и Черни (1952) при присоединении цианистого водорода к дегидроэпиандростерон-ацетату, отщеплении воды и селективном гидрировании дегидронитрила в присутствии Рd-СаСO3 . При гидролизе образуется кислота I:
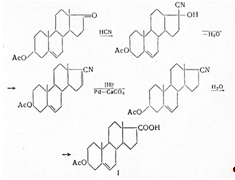
Еще в 1939 г. дезоксикортикостерон-ацетат был получен из дегидроэпиандростерона присоединением ацетилена, с частичным гидрированием 17-виниландростен-3,17-диола и его окислением с помощью четырехокиси осмия до глицеринового производного. При отщеплении воды образуется дезоксикортикостерон; еще лучше ацетилированный продукт путем перегонки с цинковой пылью превращать в дезоксикортикостерон-ацетат;
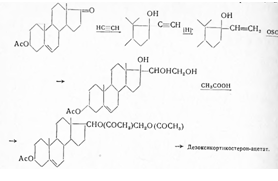
Практическое значение имеет использование Зβ-окси-5-холеновой кислоты (I), получаемой в качестве побочного продукта при окислении холестерилацетатдибромида.
После превращения ее в метиловый эфир и действия 2 мол магний-бром-фенила получают соответствующий третичный спирт, который ацетилируют. При отщеплении воды кипячением с уксусной кислотой и дезацетилировании с помощью поташа вторичная спиртовая группа при С3 окисляется по Оппенауэру и бромированием с помощью N-бромсукцинимида, а также последующим отщеплением бромистого водорода с помощью диметиланилина получают диен. При дальнейшем действии N-бромсукцинимида на свету образуется 21-бромпроизводное, от которого боковую цепь отщепляют хромовой кислотой после предварительного ацетилирования:
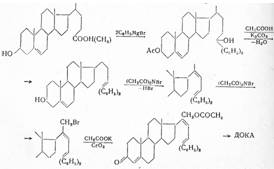
В дальнейших, технически важных синтезах в качестве исходного продукта использовали 5-прегнен-3-β-ол-20-онацетат. При обработке его тетраацетатом свинца образуется 21-ацетоксипроизводное, которое при действии раствора гидрокарбоната калия селективно деацетилируется у С21 и полученное соединение с помощью хлористого тнонила превращают в С21 -хлорид, а при дезацетилировании при С3 и окислении по Оппенауэру — в 21-хлорпрогестерон. При взаимодействии последнего с ацетатом натрия образуется дезоксикортикостерон-ацетат:
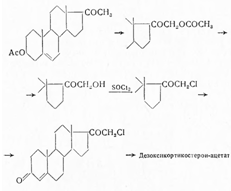
Дезоксикортикостерон-ацетат — белый или белый с кремовым оттенком кристаллический порошок без запаха, т. пл. 154—160°. Растворим в хлороформе, ацетоне, диоксане и спирте, не растворим в воде. Вращает плоскость поляризации вправо. Удельный показатель поглощения 430 (с = 0,001, 95%-ный спирт) при 240 ммк. Восстанавливает аммиачный раствор нитрата серебра и окрашивается концентрированной серной кислотой; при прибавлении хлороформа последний окрашивается в оранжевый цвет с красной флуоресценцией, водный слой окрашивается в зеленоватый цвет.
Чистоту препарата определяют по отсутствию сульфатной золы и потере в весе (допускается потеря при высушивании до постоянного веса при 100—105° не более 0,5%).
Хранят с предосторожностью (список Б), в банках оранжевого стекла с притертыми пробками, в сухом месте.
Высшая разовая доза — 0,01 г, суточная — 0,02 г.
Применяют при болезни Аддисона, общей мышечной слабости и других заболеваниях внутримышечно в масляных растворах по 5 мг 3 раза в неделю до 10 мг ежедневно. Препарат вызывает задержку ионов натрия и повышение выделения калия; противопоказан при гипертонической болезни, сердечной недостаточности, атеросклерозе и др.
5.3 Кортизон-ацетат
Cortisonum aceticum. Cortisoni acetas. Кортизон-ацетат. 11-дегидро-17-α-оксикортикостерон-21-ацетатΔ4 -прегнендиол-17α,21-трион-3,11,20,21-ацетат. С23 н30 о6 . М = 402,5.
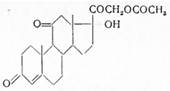
Синонимы: Аdreson, Соrtisуl, Соrtоnе.
Описаны многочисленные методы синтеза; из них практический интерес имеют лишь те, которые приводят к значительным выходам.
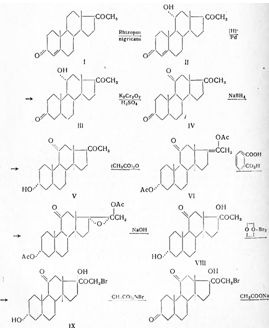
Всего целесообразнее исходить из прогестерона, который с помощью микробиологического окисления превращают в 11-оксипрогестерон и затем окислением в кортизон:
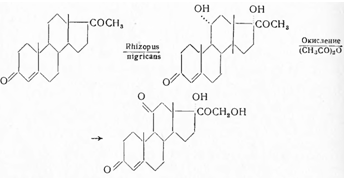
Петерсоном с сотрудниками (1953) было показано, что для синтеза кортизона целесообразно использование вещества SРейхштейна (I), которое при окислении превращают в 11-эпигидрокортизон (II); при окислении ацетата последнего образуется кортизон (III):
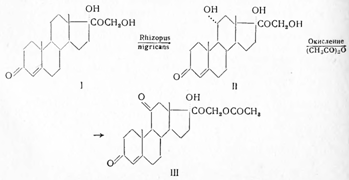
Вещество SРейхштейна не получило медицинского применения, но оказалось важным для синтеза кортизона. Еще в 1937 г. автором было показано, что оно может быть синтезировано из дегидроэпиандростерона по схеме:
Как следует из схемы, необычным является образование диена (IV), который возникает в результате дегидратации (II), и перегруппировка (V) в (VI), под влиянием пиридина, открытая еще в 90-х годах Лобри-де-Брюином на примере глицеринового альдегида, изомерирующегося в диоксиацетон.
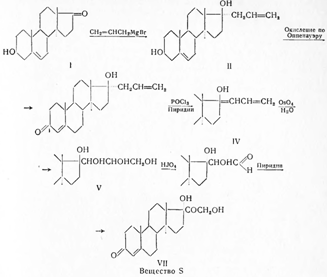
Синтез кортизона осуществлен также по методу Н.Н. Суворова из прогестерона (I) с применением микробиологических реакций.
С помощью плесневого грибка Rhizopusnigricans[I] окисляют до И ос-оксипрогестерона (II) и двойную связь при С4 гидрируют в присутствии палладия, осажденного на кальции карбонате, при обычных условиях в среде пиридина до образования прегнанол-11α-диона-3,20 (III). Последний подвергают окислению бихроматом калия в присутствии серной кислоты и образовавшийся прегнантрион-3,11,20 (IV) вновь восстанавливают в пиридиновом растворе боргидридом натрия. При выливании в охлажденную разбавленную соляную кислоту выделяется прегнанол-3α-дион-11,20 (V). С целью получения прегнандиол-3α,17α-диона-11,20 (VIII), прегнанол-3α-дион-11,20 (V) подвергают кипячению с уксусным ангидридом и получают енолацетат (VI), который окисляют надфталевой кислотой. Образовавшуюся окись (VII) гидролизуют 1%-ным водно-метанольным раствором едкого натра и продукт реакции - прегнандиол-3α,17α-дион-11,20 (VIII) извлекают хлороформом.
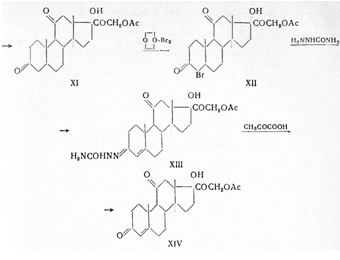
Бромирование (VIII) производят диоксандибромидом, в результате чего получают 21-бромпрегнан-диол-3α,17α-дион-11,20 (IX). Окисление производят бромсукцинимидом в метаноле при обычной температуре; при этом образуется 21-бромпрегнанол-17α-трион-3,11,20 (X). Для получения ацетата дигидрокортизона (XI) 21-бромпрегнанол-17α-трион-3,11,20 нагревают в диметилформамиде с безводным ацетатом натрия и продукт реакции высаживают водой.
Бромирование ацетата дигидрокортизона (XI) производят диоксандибромидом в диметилформамиде в присутствии катализатора п-толуолсульфокислоты и полученный бромид (XII) высаживают водой. Превращение бромида (XII) в семикарбазон кортизон-ацетата (XIII) производят обработкой семикарбазидом в смеси хлороформа и третичнобутилового спирта. При растворении последнего в уксусной кислоте и действии пировиноградной кислоты происходит пересемикарбазирование и образуется кортизон-ацетат (XIV):
Кортизон-ацетат — белый или белый с желтоватым оттенком порошок, т. пл. 235—245° (с разл.), не растворим в воде, мало растворим в спирте и в ацетоне, растворяется в хлороформе, вращает плоскость поляризации вправо. Удельный показатель поглощения 390±10 (с = 0,001, 95% спирт) при 238 ммк. При нагревании до 70° метанольного раствора препарата с раствором фенилгидразинсульфата возникает желтая окраска, а при щелочном гидролизе спиртовым раствором едкого кали и прибавлении серной кислоты ощущается запах этилацетата. Раствор препарата в концентрированной серной кислоте обнаруживает желтую флуоресценцию, которую лучше наблюдать при нанесении на белую фарфоровую пластинку (отличие от преднизона).
Чистоту препарата определяют по отсутствию галогена (проба Бейльштейна), потере в весе (не более 0,5% при высушивании до постоянного веса при 100—105°), золы, семикарбазона кортизонацетата (минерализованный концентрированной серной кислотой в присутствии пергидрола препарат с реактивом Несслера в щелочной среде не должен обнаруживать более интенсивной окраски, нежели эталон на аммиак, приготовленный с теми же реактивами по ГФ).
Кортизон-ацетат количественно может быть определен по оптической плотности при реакции с антроном в концентрированной серной кислоте.
Кортизон-ацетат растворяют в абсолютном спирте (примерно 1 мг в 1 мл), часть раствора доводят до объема в 2 мл абсолютным спиртом, прибавляют 2 мл реактива (0,2%-ный раствор анилина в 96%-ной серной кислоте) и спустя 1 ч оптическую плотность определяют при 480 ммк спектрофотометром.
Хранят с предосторожностью (список Б), в стеклянных, хорошо закупоренных банках, в защищенном от света месте. Высшая разовая доза — 0,15 г, суточная —0,3 г.
Применяют внутрь и внутримышечно при ревматизме, подагрических, инфекционных и псориатических артритах, бронхиальной астме, острых лейкозах и других заболеваниях. Детям кортизон назначают внутримышечно, начиная с 0,05 г 2 раза в день. Выпускают в порошках, таблетках по 0,025 и 0,05 г, флаконах по 5 и 10 мл суспензии, содержащей 25 мг в 1 мл.
5.4 Производные и аналоги кортизона
Синтез и изучение аналогов и производных кортизона привел к ряду интересных соединений, получивших применение в медицине. К ним относится гидрокортизон (I), преднизон (II), преднизолон (III) и др.:
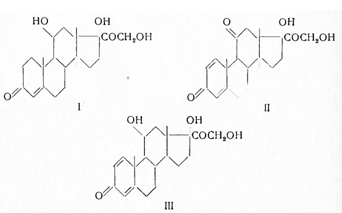
Гидрокортизон (I) оказался несколько более активным, чем кортизон; 2 /3 его дозы соответствуют примерно 1 дозе кортизона. Преднизон (II) активнее кортизона в 3—5 раз, а преднизолон (III) по действию близок к преднизону. При замене пятичленного кольца (D) кортизона на шестичленное активность уменьшается на 30—60%. Пониженную активность обнаруживает и 19-норкортизон, строения:
При введении а-метильной группы в положение 16 активность возрастает примерно на 50% (Хогг); аналогично 2-метилкортизон в несколько раз активнее кортизона. 2-Метилгидрокортизон в 10 раз выше активности гидрокортизона.
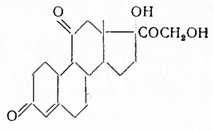
Введение галогена в кортизон или гидрокортизон повышает их физиологическое действие (Хогг, Фрид и Сабо); 9-фторпреднизолон по Хоггу в 50 раз активнее преднизолона. Введение фтора в другие положени я молекулы гидрокортизона резко усиливает их действие. Еще более активен ацетат 6α,9α-дифтор-16α-метилпреднизолона, который в 700 раз активнее гидрокортизона.
Кортизон и его аналоги широко применяют при лечении ревматоидных артритов. Больные, прикованные к постели, приобретают способность двигаться; острые боли исчезают, но терапия кортизоном, однако, не уничтожает причину заболевания, и боли иногда возникают вскоре после прекращения приема кортизона или кортизоноподобных препаратов. При длительном их применении возникает остеопороз.
5.5 Гидрокортизон
Нydrocortisonum. Гидрокортизон. 17-оксикортикостерон. 4-прегнен-11β,17α,21-триол-3,20-дион. С21 Н30 О4 . М = 346,24.
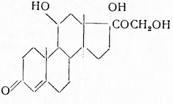
Синонимы: Cortisol, Cortril, Hydrocortal идр.
По химическому строению гидрокортизон отличается от кортизона наличием при С11 -гидроксильной группы (вместо карбонильной). Получают биохимическим путем, полусинтезом из кортизона или чисто химическим путем.
Биохимическим путем получают окислением вещества SРейхштейна с помощью Curvularialanataс 40%-ным выходом (1955) или из прогестерона (1954).
Полусинтетическим путем получен различными методами.
Хорошие выходы достигнуты при взаимодействии кортизона (I) с этиленгликолем в присутствии п-толуолсульфокислоты; образующийся 3,20-бисэтиленкеталь (II) восстанавливают LiА1Н4 до вторичной спиртовой группы при С11 , после чего обе этиленгликолевые группы гидролитически распадаются и ацетилированием получают вещество S(III):
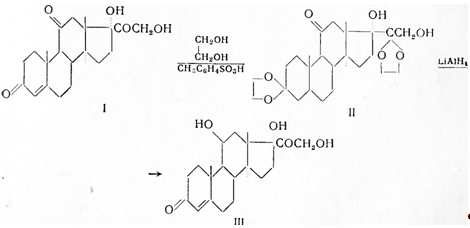
Новые полусинтетические методы описаны Оливето с сотрудниками (1953—1956), которые исходили из прегнан-11β,17α-диол-3,20-диона, дезоксихолевой кислоты или из прегнан-3α,11β,17α-триол-20-она. Из последнего получен гидрокортизон-11-формиат-21-ацетат, который после гид- 'ролиза обеих эфирных групп привел к желаемым результатам.
17-Гидрокортизон — белый кристаллический порошок, т. пл. 217— 220°, мало растворим в воде. Применяют для тех же целей, что и кортизон. Растворы готовят на изотоническом растворе натрия хлорида или на 5—10%-ном растворе глюкозы из расчета 0,2 мг гидрокортизона в 1 мл.
Гидрокортизон-ацетат — белый кристаллический порошок, т. пл. 223—225°, не растворим в воде. Получают ацетилированием гидрокортизона. При кислотном или щелочном гидролизе образуется наряду с гидрокортизоном уксусная кислота.
При внутримышечном введении в виде суспензии оказывает такое же действие, как кортизон-ацетат. При местном применении оказывает противовоспалительное действие. Применяют также в виде 1—2,5 %-ной мази при аллергических дерматозах; в глазной практике применяют 0,2— 0,5%-ную суспензию (по 1—2 капли каждые 2—4 ч) или мазь (3—4 раза в день) при лечении кератитов, конъюнктивитов, иритов.
5.6 Альдостерон
Аldostеronuм. Альдостерон. 11β,21-диокси-Δ4 -прегнен-3,20-дион-18-аль. С20 Н29 О5 . М = 349,23.
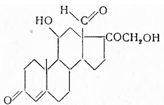
Впервые выделен из желез надпочечников в 1953 г. Симпсоном с сотрудниками (Швейцария). Частичный синтез из лактона кортикостеронкислоты (I) осуществлен Эувом с сотрудниками в 1955 г. Лактон этот превращен в 3,20-бис-этиленкеталь (II), восстановлен литий-алюминий-гидридом до циклополуацеталя (III) и освобожден кислым гидролизом от этиленгликольных остатков:
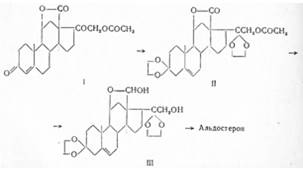
Шмидлин с сотрудниками (1955) осуществили частичный синтез альдостерона, исходя из диолэтиленкеталя (IV) Саретта окислением его до оксикетона (V). С помощью диэтилкарбоната ими получен кетоэфир (VI), алкилированием которого СН3 Jи восстановлением продукта натрий-бор-гидридом, а также циклизацией после щелочного гидролиза получен лактон (VII). Окислением хромовым ангидридом в пиридине кетогруппа регенерирована в положении I и реакцией с этоксиэтинилмагнийбромидом получен ацетиленовый карбинол (VIII). При последующем гидроксилировании в присутствии четырехокнси осмия и селективном восстановлении тройной связи в присутствии палладия была введена диольная группировка (IX). Окислением йодной кислотой получено производное ацетона (X), которое с помощью трехбромистого фосфора или тионилхлорида превращено в непредельный альдегид (XI).
При гидрировании с палладием получен изомер (XII), который действием бензойной кислоты и триэтиламина, в кипящем ксилоле, циклизован с образованием производного Δ5,16
-прегнадиена (XIII). При дальнейшем гидрировании с палладием была удалена Δ16
-двойная связь и полученный кетон (XIV) сконденсирован с диметилоксалатом до глиоксалата (XV). Йодированием и последующим метанолизом получен йодкетон (XVI), из которого ацетатом калия в ацетоне и последующим кислым гидролизом уксусной кислотой получен лактон 21-ацетата рацемической кетостерон-18-кислоты (XVII). При
8-09-2015, 23:33
