Препарат обладает замедленным и продолжительным эстрогенным действием.
Хранят с предосторожностью (список Б), в защищенном от света месте.
Применяют для тех же целей, как и эстрадиол-бензоат, в виде 0,1 %-ного масляного раствора в ампулах по 1 мл 2—3 раза в неделю.
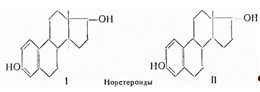
Следует упомянуть, что сам эстрадиол существует в виде двух эпимерных диолов, с т. пл. 178° и т. пл. 223°. Низкоплавкий изомер обладает более подвижной гидроксильной группой и ему приписывается 17β-конфигурация (I); он активнее своего 17α-эпимера (II) примерно в 40 раз и в 8—10 раз активнее эстрона:
При обработке метилового эфира эстрадиола (I) литием в жидком аммиаке в присутствии спирта (по Берчу) восстанавливается ароматическое ядро и образуется виниловый эфир (II), который после гидролиза переходит в непредельный кетон —нортестостерон (III), являющийся одним из активных андрогенов:
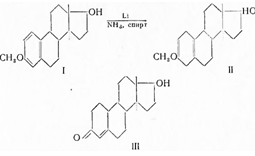
Таким образом, превращение ароматического ядра в циклогексановое сопровождается исчезновением эстрогенной и возникновением андрогенной активности. С другой стороны, разрушение кольца D, при сплавлении эстрона (IV) с едким кали, приводит к монокарбоновой дойзиноловой кислоте (V), которая столь же активна, как и эстрон:
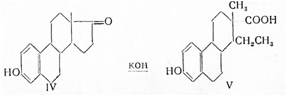
Следовательно, и без кольца Dмолекула способна обладать эстрогенной активностью.
3.4 Определение подлинности препаратов эстрогенов
Для установления подлинности используют цветную реакцию с концентрированной серной кислотоив присутствии этинилэстрадиола раствор приобретает оранжево-красную окраску с желтовато-зеленой флуоресценцией. После добавления полученного раствора к 10 мл воды окраска изменяется до фиолетовой и выпадает фиолетовый осадок Местранол с концентрированной серной кислотой образует кроваво-красное окрашивание с аналогичной флуоресценцией. Эстрадиола дипропионат под действием концентрированной серной кислоты гидролизуется с образованием эстрадиола и пропионовой кислоты. Последующее нагревание в присутствии этанола ведет к образованию этилового эфира пропионовой кислоты, имеющего характерный запах:
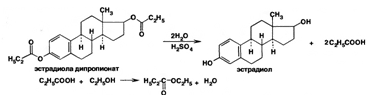
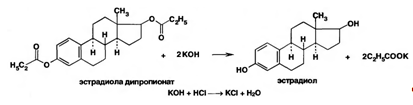
Эстрадиола дипропионат идентифицируют по образованию эстрадиола (т. пл. 173-179°С) после щелочного гидролиза с последующей очисткой его от примесей.
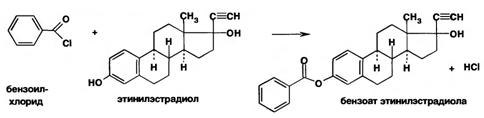
Наличие фенольного гидроксила в молекуле этинилэстрадиола подтверждают реакцией образования бензоата этинилэстрадиола, имеющего т. пл. 199-202°С:
УФ-спектр поглощения раствора этинилэстрадиола в смеси этанола и гидроксида натрия в области 220-330 нм имеет максимумы поглощения при 241 и 299 нм и минимумы поглощения при 226 и 271 нм, а раствор в этаноле — максимум поглощения при 280 нм. Этинилэстрадиол можно отличить по удельному показателю поглощения 0,005%-ного спиртового раствора при длине волны 280 нм. Он должен быть равен 65-69. Эстрадиола дипропионат идентифицируют по УФ-спектру 0,01%-ного раствора в этаноле, который в области 220-350 нм должен иметь два максимума поглощения (при 269 и 276 нм). Местранол (0,005%-ный раствор в этаноле или метаноле) при длине волны 279 нм имеет удельный показатель поглощения от 59 до 64.
Подлинность этинилэстрадиола, местранола и эстрадиола дипропионата подтверждают по ИК-спектрам, снятым в вазелиновом масле в области от 4000 до 200 см-1 . Они не должны отличаться от рисунков спектров, прилагаемых к ФС. В результате проведенных систематических исследований разработана унифицированная методика идентификации стероидных эстрогенов методом ВЭЖХ.
Примеси посторонних стероидов определяют методом ТСХ на пластинках Силуфол УФ-254. В качестве свидетелей используют СОВС эстрона, эстрадиола и др. ФС допускает суммарное содержание примесей стероидов — не более 2%, в т. ч. в этинилэстрадиоле не более 1% эстрона.
Этинилэстрадиол количественно определяют методом косвенной нейтрализации так же, как норэтистерон. В качестве растворителя используют очищенный от перекисных соединений тетрагидрофуран. Выделившуюся после добавления нитрата серебра азотную кислоту титруют 0,1 М раствором гидроксида натрия потенциометрическим методом со стеклянным индикаторным электродом. Этинилэстрадиол образует с нитратом серебра двойную соль, которая состоит из серебряной соли этинилэстрадиола и шести молекул нитрата серебра:
![]()
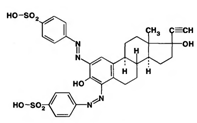
По МФ определение этинилэстрадиола выполняют спектрофотометрическим методом в среде безводного этанола при длине волны 281 нм. Фотоколориметрическая методика определения этинилэстрадиола основана на использовании диазореактива (смесь сульфаниловой кислоты, нитрита натрия и хлороводородной кислоты). В щелочной среде образуется окрашенное бисазосоединение:
Для количественного определения эстрадиола дипропионата используют реакцию щелочного гидролиза точно отмеренным количеством 0,1 М спиртового раствора гидроксида калия, избыток которого титруют 0,1 М раствором хлороводородной кислоты (индикатор фенолфталеин):
Для идентификации, установления наличия примесей посторонних стероидов и количественного определения стероидных эстрогенов (в т. ч. этинилэстрадиола, местранола, эстрадиола дипропионата) использован комплекс физико-химических методов: ТСХ, ВЭЖХ, масс-спектрометрия (Родионова P.A., Тугунтаев Г.И., Арзамасцев А.П.). Ряд разработанных методик включен в ФС.
Производные эстрадиола хранят по списку Б. Этинилэстрадиол сохраняют в хорошо укупоренных банках оранжевого стекла, а местранол и эстрадиола дипропионат — в сухом, защищенном от света месте.
Применяют в качестве эстрогенных средств. Учитывая пролонгированное действие эстрадиола дипропионата, его вводят внутримышечно по 1 мл 0,1 %-ного раствора в масле 2-3 раза в неделю. Этинилэстрадиол назначают внутрь в виде таблеток по 0,00001 и 0,00005 г. Местранол является одним из компонентов таблеток инфекундин (Infecundin) — активного перорального контрацептива, содержащего 0,0001 г местранола и 0,0025 г норэтинодрела. Этинилэстрадиол входит в состав таких противозачаточных средств, как марвелон, ноновлон, овидон, применяемых в виде таблеток.
стероидный гормон синтез животное человек
Глава 4. Гестагенные гормоны
4.1 История
Название «гестагенные» гормоны происходит от латинского слова — gestatio, т. е. беременность, поэтому в более ранних исследованиях гестагенные гормоны назывались гормонами беременности. Гестагенные гормоны были выделены в результате исследования функций желтого тела (Corpus luteum), периодически образующегося после овуляции и развивающегося после оплодотворения. Как показал Френкель в 1902 г., удаление желтого тела у беременных животных приводит к выкидышу плода. Исследованиями Окинчица, Леба и других авторов показано, что главной функцией желтого тела является подготовка слизистой оболочки матки к имплантации оплодотворенного яйца и поддержания дальнейшего развития зародыша. Однако только через 20 лет Корнеру и Аллену (1932) удалось экспериментально доказать, что желтое тело производит гормон, необходимый для поддержания беременности. Гормон этот также тормозит овуляцию и подвижность матки, сенсибилизирует последнюю к восприятию зародыша и способствует имплантации яйцеклетки. Помимо этого, гормон оказывает влияние и на развитие молочных желез. Выделение гормона желтого тела в чистом виде оказалось возможным лишь после разработки биологических тестов, позволивших определять лутоидмую активность. По Клаубергу, неполовозрелым крольчихам в течение 8 дней вводят ежедневно по 10 МЕ (мышиных единиц) эстрогенного гормона, затем в течение 5 дней вводят подкожно гестагенный гормон. Наименьшее количество вещества, вызывающее в слизистой оболочке матки изменения, подобные наблюдаемым в начале беременности, цазывается кроличьей единицей (КЕ). Эстрогенные гормоны уже в весьма небольших количествах (0,1 мкг) подавляют лутоидное действие гормона желтого тела, названного прогестероном. Поэтому экстракты перед испытанием обрабатывают 30%-ным раствором едкого натра для отделения эстрогенных (фенольных) гормонов.
По международному соглашению, 1 MEгормона желтого тела соответствует 1 мг стандартного кристаллического прогестерона.
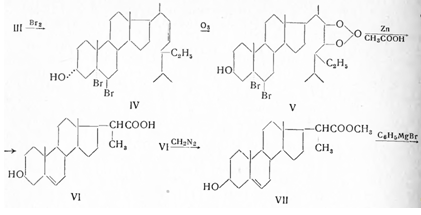
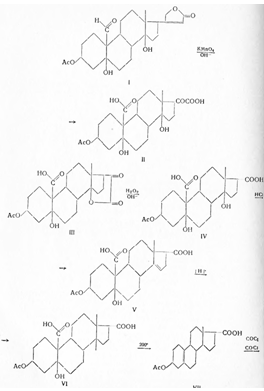
Впервые прогестерон (II) выделен Бутенандтом в 1934 г. из желтого тела свиней (спустя 6 лет после открытия эстрона). Строение его было выведено на основании аналитических и спектральных данных, подтвержденных частичным синтезом из прегненолона (I); сам прегненолон получен при окислении 3-ацетата 5,6-дибромхолестерина:

Ввиду малых выходов (1—3%) этот способ не получил практического использования. Более пригодным оказалось получение прогестерона (II) из неомыляемой части масла соевых бобов — стигмастерина (III), путем окислительного расщепления последнего через прегненолон (I):
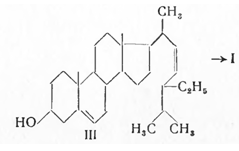
При бромировании стигмастерина образуется с присоединением брома к 5—6 двойной связи дибромид стигмастерина (IV), который при озонировании превращают в озонид (V), а при последующей обработке цинком и уксусной кислотой в 3β-оксибиснорхоленовую кислоту (VI):
После этерификации кислоты (VI) с помощью диазометана в метиловый эфир (VII) последний с помощью магний-бромфенила превращают в третичный карбинол (VIII).
При кипячении его с ледяной уксусной кислотой и перегонке в высоком вакууме происходит дегидратация и образуется дважды непредельный спирт (IX), изолированный в виде ацетата. Озонированием его переводят в прегненолон и затем окислением в прогестерон:
Описаны многочисленные синтезы прогестерона из прегненолона с применением различных окислителей (перманганата калия, перекиси водорода, хромового ангидрида) дегидрирующих веществ — металлических акцепторов водорода Сu, Ag, Аu, Рt, Рd, Ni, Zn), а также кетонов, альдегидов, ненасыщенных соединений, например, коричной, фумаровой кислот, хинолина.
Хорошие выхода получают при окислении по Оппенауэру с применением третичного бутилата алюминия.
Окисление прегненолона может быть проведено и микробиологически с помощью Rhizopusnigricans, как это показано Мамоли (1938).
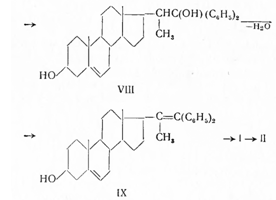
При использовании в качестве исходного продукта 3(β)-ацетокси-Δ5 - этиохоленовой кислоты (X) ее превращают с помощью тионилхлорида в хлорангидрид (XI), который восстанавливают в альдегид (XII) и затем через 3-окси-17-метил-магний-йод гидролизуют при охлаждении разбавленной серной кислотой. При перекристаллизации из смеси ацетон-вода получают чистый прегнендиол-3,20 (XIII), который окисляют хромовой кислотой в ледяной уксусной кислоте обычным путем в прегненолон (I):
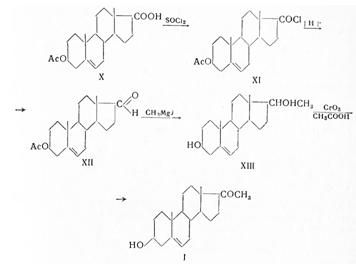
Н.Н. Суворовым (1956) показано, что прогестерон может быть получен из соласодина-агликона стероидных алкалоидов, получаемого из растения паслен птичий (Solanum aviculare Forst) по схеме.
Дальнейшее превращение Δ5,16 -прегнадиенол-3-она-20 (III) в прогестерон (II), связано с гидрированием, гидролизом ацетильной группы и реакцией Оппенауэра:
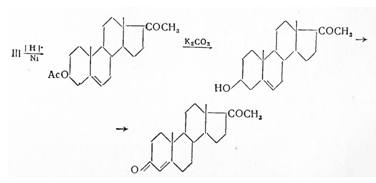
4.2 Прогестерон
Progesteronum. Прогестерон. 4-прегнен-3,20-дион. С21 Н30 О2 . М = 314,47.
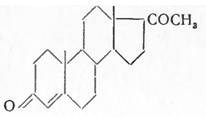
Синонимы: Lutocyclin, Progestin, Progeston, Proluton идр.
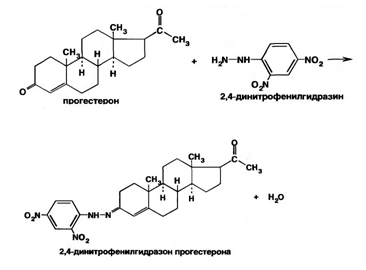
Прогестерон — белый кристаллический порошок, т. пл. 127—129°, удельный показатель поглощения 515 (0,001, 95%-ный спирт при к = 241 ммк), не растворим в воде, растворяется в спирте, эфире, хлороформе, мало растворим в растительных маслах. Спиртовой раствор в присутствии щелочи и м-динитробензола окрашивается в красно-фиолетовый цвет, раствор его в смеси концентрированной уксусной кислоты и 88%-ной фосфорной дает интенсивную желтую флуоресценцию (реакция Боскотта). Являясь кетоном, образует оксим, т. пл. 240°, и 2,4-динитрофенилгидразон.
Количественное определение прогестерона производят весовым путем, в виде 2,4-динитрофенилгидразона, получаемого кипячением препарата с реагентом в спиртовом растворе. После кипячения его с концентрированной соляной кислотой осадок отфильтровывают, промывают 0,5 н. раствором соляной кислоты, спиртом и высушивают при 100° до постоянного веса. Вес осадка, умноженный на 0,466, соответствует количеству прогестерона.
Содержание прогестерона в препарате должно быть не менее 98,5%. Хранят с предосторожностью (список Б), в хорошо закупоренных банках, в защищенном от света месте.
Высшая разовая доза—0,01 г, суточная — 0,01 г. Применяют при патологических процессах, связанных с недостаточностью желтого тела: при дисфункциональных маточных кровотечениях, функциональной и анатомической недостаточности половых органов, болезненных менструациях, привычном и угрожающем выкидыше, бесплодии. Вводят в виде масляных растворов внутримышечно или подкожно по 0,01 г (2 мл 0,5-ного раствора в масле). Выпускают в ампулах по 1 мл.
По своему строению прогестерон отличается от андрогенных гормонов наличием при С17 боковой цепи; такие соединения относятся к группе прегнана. Так как андрогены получаются легче и с лучшими выходами, нежели производные прегнана, то последние обычно получают из производных андростана.
В 1936 г. Бутанандт, а также Ружичка с помощью гриньяровского синтеза получили впервые 17-этилтестостерон; этот продукт оказался слабым эстрогеном и неактивным в отношении теста Клауберга. Более важными оказались производные ацетилена и, в частности, 17-этинил тестостерон, строения:
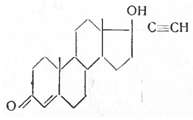
названный прегнином.
4.3 Прегнин
Praegninum. Aethisteronum. Прегнин. 17-α-этинилтестостерон. Δ4 -17-этиниландростен-3-он-17-ол. С21 Н28 О2 . М = 312,46
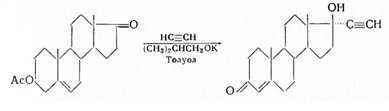
Прегнин — белый или слегка желтоватый кристаллический порошок без запаха, т. пл. 268—274°, не растворим в воде, мало растворим в спирте и ацетоне, хлороформе и в пиридине. С гидрохлоридом гидроксиламина в присутствии ацетата натрия в среде метилового спирта образует оксим, который, после перекристаллизации из 70%-ного метилового спирта, плавится при 226—232°. Раствор в концентрированной серной кислоте при разбавлении водой и прибавлении хлороформа окрашивает последний в красный цвет.
Чистоту препарата определяют по отсутствию примесей (сульфатная зола не должна превышать 0,1%, а потеря в весе при высушивании до постоянного веса при 100° —0,5%).
Хранят с предосторожностью (список Б), в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Высшая разовая доза — 0,015 г, суточная —0,05 г.
Применяют по 2 таблетки (по 5 мг) 3 раза в день; он в 5—6 раз менее активен, нежели прогестерон. Особенностью прегнина является его свойство сохранять активность и оказывать терапевтическое действие при приеме внутрь, особенно сублингвально.
При гидрировании двойной связи прегнина или замене карбонильной группы гидроксильной активность утрачивается, но при расширении пятичленного цикла Dдо шестичленного — D-гомопрогестерон обнаруживает почти такую же активность, как и прогестерон. Синтез D-гомопрогестерона представляет собой точное повторение синтеза прогестерона из 3-ацетата Дегидроэпиандростерона-17. При действии на последний (I) синильной кислоты получен оксинитрил (II), который восстановлением литийалюминийгидридом превращен в оксиамин (III) и при обработке азотистой кислотой в гомодегидроэпиандростерон (IV). С помощью реакции Оппенауэра и др. (IV) Превращается в D-гомопрогестерон (V):
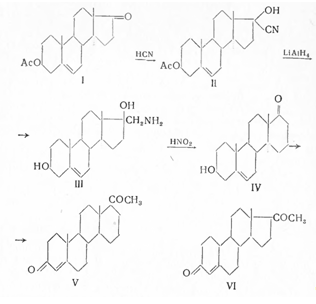
Превращение III в IV под влиянием азотистой кислоты является известной перегруппировкой Демьянова. Не только замена пятичленного цикла на шестичленный, но и удаление С19 -метильной группы не изменяет гормональных свойств; активность молекулы повышается и 19-норпрогестерон (VI) в 7—8 раз активнее прогестерона.
При синтезе 19-норпрогестерона исходят из метилового эфира эстрона (VII) и боковую цепь образуют аналогично предыдущему. Действием реактива Гриньяра на нитрил (VIII), образующийся в результате дегидратации оксинитрила (II), получают после гидрирования кетон (IX). При восстановлении ароматического кольца (Л) литием в жидком аммиаке восстанавливается и карбонильная группа (IX), но гидролиз образовавшегося винилового эфира (X) приводит к α,β-непредельному кетону (XI), который при окислении хромовым ангидридом переходит в 19-норпрогестерон (VI):
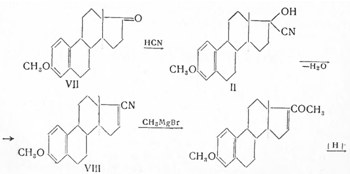
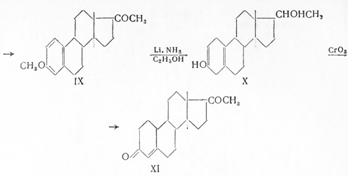
Исходя из метилового эфира эстрона, был получен по нижеприведенной схеме 19-норпрегнин (норлутин), оказавшийся в 3—4 раза активнее прегнина с транс-сочленением колец В/С и С/D:
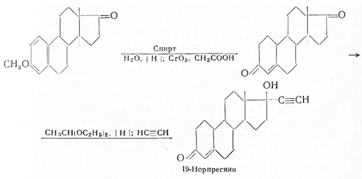
В 1957 г. Эренштейн в США получил 19-норпрогестерон с цис-сочленением колец С/Dи α-положением боковой цепи (-СОСН3 ) строения:
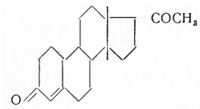
Его активность оказалась в 8 раз выше активности прогестерона. Этот факт заслуживает внимания, так как ранее принималось, что стероиды с цис-сочленением колец С/Dявляются неактивными. Для получения 19-норпрогестерона ацетат строфантидина (I) окислялся перманганатом калия в щелочной среде и образовавшаяся за счет «лактонного» кольца с одной стороны и альдегидной группы с другой кетокислота (II) самопроизвольно замыкалась в лактон (III). При обработке последнего перекисью водорода, в присутствии щелочи, боковая цепь окислялась до карбоксильной группы, причем под влиянием щелочи происходила инверсия у С17 , в результате чего получилась кислота (IV). При действии хлористого водорода на (IV) наступала дегидратация с образованием V, а при последующем гидрировании получалась кислота с цис-сочленением колец С и D(VI). При нагревании до 200° удалялись ангулярные — ОН группа при С14 и СООН — группа при С10 и образовывалась непредельная при Q—С10 ацетоксикислота (VII). Действием оксалилхлорида на (VII) получался хлорангидрид (VIII), который с диметилкадмием превращался в оксикетон (IX) и затем по Оппенауэру в 19-норпрогестерон (X):
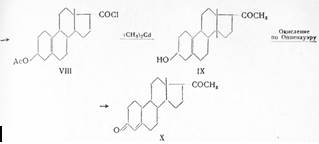
Из аналогов прегнина, содержащего при С6 и С21 метильные группы, следует отметить полученный В. Петровым (Англия). Действием ацетиленида лития в жидком аммиаке на 3-ацетат дегидроэпиандростерона-17 (I) синтезирован 3,17-диол (II), гидроксильные группы которого защищались дигидропираном и дигидропиранилдиол (III) обрабатывался последовательно бутиллитием и йодистым метилом, что после гидролиза привело к пропинилдиолу (IV). Окислением диола (IV) по Оппенауэру синтезирован соответствующий кетон (V) и из него этиленкеталь (VI). При действии на кеталь (VI) надфталевой кислоты получена соответствующая окись (VII), которая с магнийбромметилом, с разрывом окисного кольца, превращена в гликоль (VIII). Кислым гидролизом гликоль (VIII) превращен в кетодиол (IX) и действием едкого натра в пиридине — в кетон (X). При действии на кетон (X) хлористого водорода образуется эпимер, переходящий в α-метилпроизводное (XI), оказавшееся в 12 раз активнее прегнина:
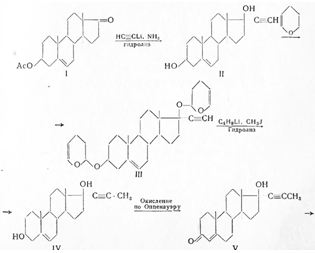
4.4 Определение подлинности препаратов гестагенов
Для испытания подлинности прогестерона фс рекомендует цветную реакцию на наличие стероидного цикла с концентрированной серной кислотой. После добавления 3 мл воды образуется желтое окрашивание с зеленой флуоресценцией. После добавления хлороформа оба слоя становятся бесцветными. Спиртовой раствор прогестерона образует с м-динитро-бензолом в щелочной среде окрашенное в красный цвет соединение.
По ФС прогестерон идентифицируют о помощью ИК-спектра, снятого в вазелиновом масле в области 3700-400 см-1 . Он должен полностью совпадать с прилагаемым к ФС рисунком спектра.
УФ-спектрофотометрию, основанную на измерении оптической плотности при 241 нм (максимум светопоглощения). применяют для идентификации прогестерона.
Для норэтистерона НД указывает максимум поглощения 240 нм В качестве растворителя используют этанол.
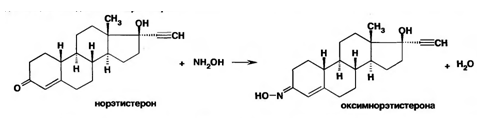
Реакция образования оксима за счет наличия кетогруппы в положении 3 стероидного цикла может быть использована для испытания подлинности норэтистерона:
Реакцию осаждения 2,4-динитрофенилгидразона используют для количественного определения прогестерона (гравиметрическим методом) и для испытания его подлинности (по температуре разложения 2,4-динитрофенилгидразона):
Наличие спиртового гидроксила в молекуле норэтистерона позволяет использовать для испытания на подлинность реакцию
8-09-2015, 23:33
