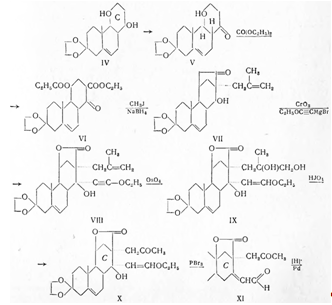
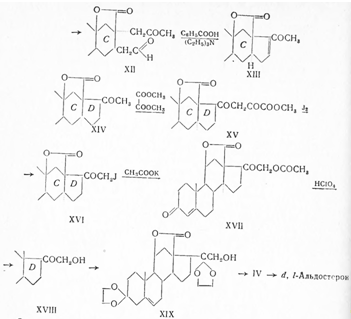
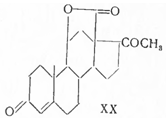
С помощью микробиологического 21-гидроксилирования удалось этот синтез существенно укоротить и получить оптически активный (+) альдостерон (Витер с сотрудниками, 1956). Так, кислым гидролизом рацемического этиленкеталя (XIV) прогестероновое производное (XX) с помощью микроорганизма Ophiobolus herpotrichus гидроксилировано в позиции 21, причем реагировал только один из обоих антиподов, в результате чего получен чистый лактон (+) кортикостерон-18-кислоты (XVIII). Затем через оптически активный промежуточный продукт (XIX) и (IV) он переведен в (+) альдостерон.
Альдостерон — бесцветные кристаллы, т. пл. 164—169 (гидрат плавится при 105—112°, причем плав вновь затвердевает и вторично плавится при 155—165°.
Альдостерон приблизительно в 100 раз активнее дезоксикортикостерона и известных минералкортикоидов. При адиссоновой болезни он действует в дозах в 20—30 раз меньших, чем дезоксикортикостерон. 21-Моноацетат альдостерона в 1,25 раза и диацетат в 136 раз менее активен, чем альдостерон (Симпсон с сотрудниками, 1953—1955).
5.7 Преднизон
Prednisonum. Преднизон. Метикортен. Δ1,4 -прегнандиендиол-17α,21-tpиoh-3,11,20 или Δ1 -дегидрокортизон. С21 Н26 О5 . М = 358,44.
Синонимы: Decortin.
Получают из кортизон-ацетата микробиологическим путем с помощью Mycobacterium и Bacillus megatherium. При этом происходит дегидрирование и дезацетилирование.
Преднизон—белый кристаллический порошок без запаха, горького вкуса, т. пл. 227° (с разл.), не растворим в воде, мало растворим в хлороформе, в метиловом и этиловом спиртах. Фенилгидразинсульфат в метанольном растворе вызывает желтую окраску; концентрированной серной кислотой окрашивается также в желтый цвет (в отличие от преднизолона). При нанесении этого раствора на белую фарфоровую пластинку и рассматривании в ультрафиолете наблюдается желтовато-зеленая флуоресценция (отличие от кортизон-ацетата).
Чистоту препарата определяют по отсутствию влаги при высушивании до 100—105° (не более 0,5%), остатка при прокаливании.
Оптическую плотность Dраствора измеряют при длине волны 239 ммк в кювете, толщиной слоя 1 см (в контрольную кювету помещают метиловыи спирт).
0,02—0,05 г преднизона растворяют в 70—80 мл метанола, раствор разбавляют метанолом до 100 мл. 5 мл данного раствора разбавляют метанолом до 100 мл и измеряют оптическую плотность, как указано выше.
Хранят с предосторожностью (список Б), в хорошо закупоренных банках, в защищенном от света месте.
Применяют внутрь по 0,02—0,03 г в день, в виде порошка или таблеток по 0,001, 0,0025 и 0,005 г.
5.8 Преднизолон
Prednisolone. Преднизолон. Δ1 -дегидрогидрокортизон. 11β,17α-21-тригидроокси-Δ1,4 -прегнандиен-3,20-дион. С19 н28 о5 . М = 336,22.
Синонимы: Decortin Н, Metacortandrolon, Miticortelon, Hydrocortancyl идр.
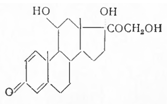
Открыт одновременно с предннзоном (1955) и впервые синтезирован в 1955 г. Герцогом с сотрудниками (США). Ацетат преднизона переводят в 3,20-дисемикарбазон и восстанавливают при С11 калийборгидридом. Полученный таким путем преднизолон-3,20-дисемикарбазон расщепляют азотистой кислотой, образуется 21-ацетат преднизолона (с 5%-ным выходом). Лучшие выхода (10%) получены дегидрированием гидрокортизона с помощью двуокиси селена, тетраацетата свинца и микробиологическим путем с помощью Согупе bacteriumsimplex.
Преднизолон — белый кристаллический порошок, т. пл. 240—241° (с разл.); его ацетат плавится при 237—239°(с разл.).
Применяют для тех же целей, что и преднизон, в дозах 0,001, 0,0025, 0,005 г в таблетках.
5.9 Дексаметазон
Dexamethasonum. Дексаметазон. 16α-метил-9α-фторпреднизолон. 9α-фтор-11β,17а,21-тригидрокси-Δ1 -прегнен-3,20-дион. С21 Н30 О5 . М = 335,02.
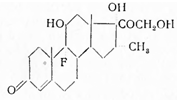
Синонимы: Decadron, Dexadrol, Fortecortin.
Впервые получен Фридом и Сабо в 1954 г. (США). Они исходили из 11-эпимера гидрокортизона (1), который получали гидроксилированием вещества SРейхштейна.
Ацетнлированием и тозилированием был получен 21-ацетат-11α-тозилат, который переводился в 17α-окси-21-ацетокси-Δ4,9(11) -прегнадиен-3,20-дион (II). При взаимодействии с м-бромацетамидом в водном диоксане в присутствии хлорной кислоты возникал 9-α-бромгидрокортизонацетат (III), который при действии ацетата калия в этаноле превращался в 9β,11β-окись (IV). При взаимодействии последнего с безводным фтористым водородом в хлороформе получался фторкортизонацетат (V) с 50%-ным выходом:
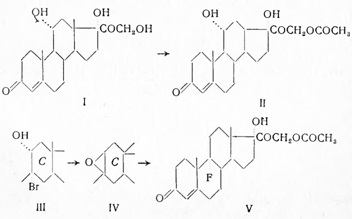
Гиршману с сотрудниками (1956) удалось повысить выход на последней стадии до 75% при применении в качестве реакционной среды органических оснований.
9β,11β-Эпоксид (IV) является единственной ступенью синтеза Δ4,9(11) -прегнадиенового производного микробиологическим путем с помощью Сurvulаrіа lаnаtаилиСunninghаmеllа blaкеslеаnа.
Дексаметазон — белый порошок, т. пл. 260—262° (с разл.).
Применяют внутрь аналогично другим кортикостероидам; препарат хорошо переносится в терапевтических дозах (0,5—1 мг), относительно мало влияет на обмен электролитов и не вызывает задержки хлористого натрия и воды в организме.
5.10 Определение подлинности препаратов кортикостероидов
В испытаниях, рекомендуемых для оценки качества кортикостероидов и их аналогов, много общего. При нагревании на водяной бане смеси спиртового раствора кортикостероида и реактива Фелинга выпадает красно-оранжевый осадок. Реакция обусловлена восстановительными свойствами а-кетольной группировки, которая легко окисляется до карбоксильной:
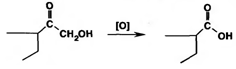
В присутствии реактива Фелинга:
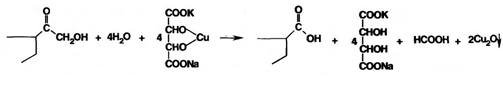
Восстанавливающие свойства а-кетольной группы лежат в основе реакции «серебряного зеркала», которое образуют ряд кортикостероидов (кортизона ацетат, гидрокортизон, преднизолон):
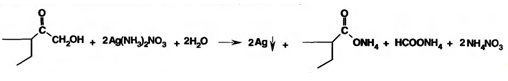
Кортикостероиды, содержащие а-кетольную группу (кортизон и его аналоги), дают цветную реакцию, основанную на окислении 0,5%-ным раствором хлорида трифенилтетразолия в этаноле в присутствии 10%-ного раствора гидроксида тетраметиламмония. Появляется красная окраска, обусловленная образованием формазана:
Реакцию используют для фотоколориметрического определения при длине волны 525 нм. Кортикостероиды можно отличить друг от друга по реакции с концентрированной серной кислотой (табл.).
Таблица 2
Результаты взаимодействия кортикостероидов с концентрированной серной кислотой
| Лекарственное вещество | Окраска раствора | Флуоресценция |
| Дезоксикортона ацетат | Желтая (после добавления воды — фиолетовая) Красная (после нагревания до 80-90°С) | Зеленовато-желтая окраска с красной флуоресценцией (после добавления этанола) |
| Кортизона ацетат | Оранжевая (через 2 мин) | Желтая (через 5 мин в УФ-свете) |
| Гидрокортизон | Желтая, переходящая в красноватую (через 5 мин) | Желто-зеленая, переходящая в зеленую (после добавления воды) |
| Преднизолон | Зеленая, переходящая в красную | Отсутствует |
Известны и другие испытания на отдельные кортикостероиды. Раствор кортизона ацетата в этаноле, выпаренный досуха в вакууме, после нагревания до 70°С в течение 30 мин, с 1 М раствором гидроксида натрия приобретает желтое окрашивание, имеющее интенсивное поглощение при 370 нм (в отличие от преднизолона, который в тех же условиях приобретает лишь слабо-желтое окрашивание).
Кортикостероиды можно отличать друг от друга с помощью реакций на те или иные функциональные группы.
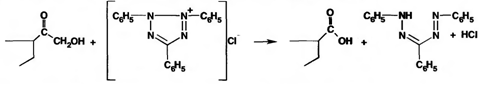
При нагревании на водяной бане спиртовых растворов лекарственных веществ с раствором фенилгидразина появляется желтое окрашивание. Реакция обусловлена образованием фенилгидразона (с кетонной труппой в положении 3) и на примере кортизона ацетата происходит по схеме:
Для идентификации лекарственных веществ, представляющих собой сложные эфиры, использована реакция получения ацетогидроксамовой кислоты, которая затем с солями железа (III) образует соединения, окрашенные в темно-вишневый (кортизона ацетат) или красно-коричневый (дезоксикортона ацетат) цвет:
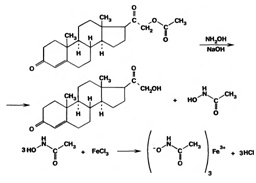
Ацетильную группу можно обнаруживать после гидролиза кортизона и гидрокортизона ацетатов в спиртовом растворе гидроксида калия. Последующее прибавление концентрированной серной кислоты приводит к образованию этилацетата, имеющего характерный запах. Эта реакция рекомендована ФС для испытания на подлинность гидрокортизона ацетата:
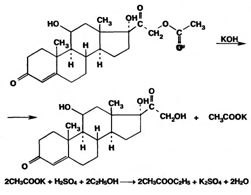
Для качественного и количественного анализа кортикостероидов и их аналогов используют спектрофотометрию в УФ-области. Расчет содержания лекарственного вещества выполняют по удельному показателю поглощения или (преднизолон) по оптической плотности ГСО. В табл. приведены условия, в которых ФС рекомендуют выполнять испытания на подлинность и спектрофотометрическое определение лекарственных веществ, производных кортикостероидов.
Таблица 3
Условия спектрофотометрического определения кортикостероидов
| Лекарственное вещество | Растворитель | Максимум поглощения, нм | Удельный показатель поглощения |
| Дезоксикортона ацетат | Этанол | 241 | 430-450 |
| Кортизона ацетат | Этанол | 238 | 390 І |
| Гидрокортизона ацетат | Этанол | 241 | 395 1 |
| Преднизолон | Метанол | 242 | 400-430 |
Для установления подлинности и проведения испытаний на посторонние примеси ФС рекомендована также ИК-спектроскопия и метод ТСХ. Так, для испытания подлинности преднизолона рекомендовано снимать ИК-спектр в вазелиновом масле в области от 3700 до 400 см-1 и сравнивать его с прилагаемым к ФС рисунком спектра.
Методом ТСХ на пластинках Силуфол УФ-254 или Сорбфил устанавливают во всех лекарственных веществах наличие примесей посторонних стероидов. На пластинку помимо испытуемого раствора наносят стандартные образцы различных количеств стероидов, примеси которых обнаруживают. В состав подвижной фазы входят метиленхлорид, метанол, хлороформ, вода в различных соотношениях. Обнаружение пятен проводят в УФ-свете с длиной волны 254 и 365 нм. Проявителем может также служить фосфорномолибденовая кислота. Суммарное содержание примесей не должно превышать 2-4%.
Идентифицировать и определить содержание дезоксикортона ацетата спектрофотометрическим методом можно с помощью реакции, основанной на взаимодействии с гидразином изатина. Оптическую плотность образовавшегося гидразона измеряют в среде диоксана при длине волны 445 нм.
Методики фотоколориметрического определения гидрокортизона ацетата и других 3-кетостероилов основаны на использовании в качестве реактивов на кетогруппу при С-3 стероидного цикла: фенилгидразина, 4-аминоантипирина, изониазида, боргидрида натрия.Микроколоночную ВЭЖХ применяют для идентификации и испытаний на чистоту ряда кортикостероидов: дезоксикортона ацетата, кортизона ацетата, преднизона ацетата и преднизолона. Для анализа используют отечественный прибор «Миллихром» с УФ-детектором при 238 нм. Количественное содержание примесей устанавливают методом внутренней нормализации. Метод ВЭЖХ в прямофазном и обрашеннофазном вариантах использован для количественного определения гидрокортизона ацетата и преднизолона в мазях. Для анализа на прямой фазе используют смесь хлороформ-метанол (93:3), на обратной — метанол.Лекарственные препараты кортикостероидов хранят по списку Б, в хорошо укупоренной таре, предохраняя от действия света.Дезоксикортона ацетат, являющийся минералокортикостероидом, применяют при болезни Аддисона, миастении, астении, общей мышечной слабости и других заболеваниях. Вводят внутримышечно в виде масляных растворов от 0,005 г 3 раза в неделю до 0,01 г ежедневно. Лекарственные препараты глюкокортикостероидов оказывают противовоспалительное, десенсибилизирующее, антиаллергическое и антитоксическое действие. Их применяют для лечения ревматизма, различных форм полиартрита, бронхиальной астмы, кожных и различных аллергических заболеваний. Кортизона ацетат назначают внутрь по 0,1-0,2 г в сутки, гидрокортизон — в виде 25%-ной суспензии в полость суставов. Преднизалон по характеру действия аналогичен кортизону, но более активен. Поэтому его высшие дозы: разовая — 0,015 г, суточная — 0,1 г (внутрь). Для местного применения при глазных и кожных заболеваниях выпускают 0,5-1%-ные гидрокортизоновую и 0,5%-ную преднизолоновую мазь.В результате исследования влияния галогенов, введенных в молекулу кортикостероидов, на их фармакологическую активность были синтезированы моно- и дифторпроизводные преднизолона. Они содержат в положении 9 один атом фтора— дексаметазон (Dexamethasone), триамцинолон (Triamcinolone) или в положениях 6 и 9 два атома фтора — флюметазона пивалат (FlumethasonePivalate) и флюоцинолона ацетонид (FluocinoloneAcetonide):
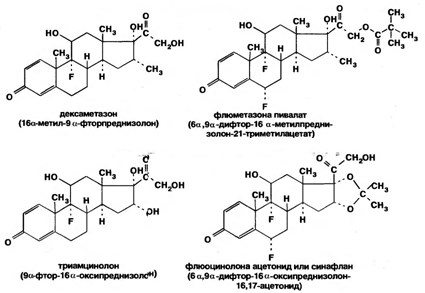
Введение атома фтора в положение 9а осуществляют действием фтороводорода, а образование двойной связи в положения 1-2 — микробиологическим путем.По физическим свойствам указанные лекарственные вещества сходны с рассмотренными кортикостероидами. В основе способов их испытаний на подлинность-чистоту и количественного определения лежат методы ИК- и УФ-спектрофотометрии, ТСХ, ВЭЖХ. Широкие исследования в области стандартизации и создания новых лекарственных форм синафлана, других коргикостероидов проведены на кафедре фармхимии Пятигорской фармацевтической академии (М.В. Гаврилин).Фторпроизводные отличаются более активным чем У преднизолона, противовоспалительным, антиаллергическим действием. Они высокоэффективны при местном применении. Дексаметазон в 35 раз активнее кортизона. Дексаметазон назначают внутрь до 0,002-0,003 г, а триамцинолон — до 0,01-0,02 г в сутки. Флюметазона пивалат и флюоцинолона ацетонид применяют в виде 0,02-0,025%-ных мазей, кремов, эмульсий.
Выводы
Стероидные гормоны — группа физиологически активных веществ (половые гормоны, кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека. У позвоночных синтезируются из холестерина в коре надпочечников, клетках Лейдига семенников, в фолликулах и желтом теле яичников, а также в плаценте.
· Гормоны коркового слоя надпочечников:
o Кортикостероиды:
- Кортизон,
- Гидрокортизон,
- Кортикостерон,
- Прегнан,
- Преднизолон.
· Половые гормоны
o Андрогенные (мужские):
- Андростерон,
- Тестостерон,
- Метилтестостерон.
o Эстрогенные (женские):
- Эстрон (Фолликулин),
- Эстрадиол,
- Эстриол,
- Этинилэстрадиол.
Стероидные гормоны являются производными ряда углеводородов, главным образом прегнана, андростана, эстрана:
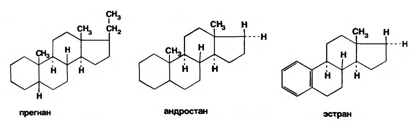
Они сходны между собой по химической структуре. Отличие от андростана состоит лишь в том, что прегнан имеет в молекуле этильный радикал, а эстран — ароматическое ядро и у него отсутствует одна из метальных групп.
Структурной основой стероидных гормонов является гидрированный скелет углеводорода циклопентанпергидрофенантрена:
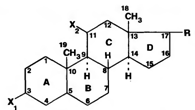
Метильные группы, присоединенные к стероидному циклу в положениях 10 и 13, называются ангулярными. Радикал Rи атомы водорода (в положениях 8, 9, 14) ориентированы в пространстве в цис- или транс-положении. Условно принято считать, что ангулярные метильные группы расположены над плоскостью чертежа (это обозначают сплошной линией). Если другие заместители находятся в цис-положении, т. е. в одной плоскости с ангулярными группами (Р-конфигурация), то их также обозначают сплошной линией, а если в транс-положении (а-конфигурация), то пунктирной линией.
К числу производных прегнана относятся кортикостероиды и гестагенные гормоны, производными андростана являются андрогенные гормоны, а эстрана — эстрогенные гормоны.
Исходя из представленной общей формулы и функциональных групп (заместителей), указанных в табл., можно написать химические формулы каждой группы стероидных гормонов.
| Группа гормонов | Двойная связь | Заместители | ||
| X1 | Х2 | R | ||
| Кортикостероиды | ен-4 диен 1,4 |
=О | -Н -ОН =О |
-СО-СН2 ОН -ОН |
| Гестагены | ен-4 | =О | -Н | -СО-СН3 |
| Андрогены | ен-4 | =О | -Н | -ОН |
| Эстрогены | триен-1,3,5 (нет С-19) |
-ОН | -Н | -ОН =О |
Имеющие стероидную структуру полусинтетические аналоги указанных групп стероидных гормонов содержат в своих молекулах ряд других атомов и функциональных групп.
Стероидный цикл, указанные функциональные группы влияют на физико-химические свойства гормонов и их аналогов. На использовании этих свойств основаны способы испытаний на подлинность, количественное определение, установлены условия хранения и стабильность лекарственных веществ, имеющих стероидную структуру.
При испытании на подлинность для подтверждения стероидного цикла в молекулах широко используют реакцию образования окрашенных и флуоресцирующих веществ при действии концентрированной серной кислотой. а-Кетольную группу открывают за счет проявления восстановительных свойств Кетогруппу обнаруживают реакцией образования ке- токсимов при взаимодействии с гидроксиламином, а также гидразонов — с фенилгидразином и другими гидразинами и гидразидами. Наличие спиртового и фенольного гидроксилов в молекулах подтверждают реакцией этерификации с последующим установлением температуры плавления образующихся эфиров, а наличие сложноэфирных групп (в ацетатах, пропионатах, энантатах и др.) — либо по образованию окрашенных солей гидроксамовых кислот, либо реакциями гидролиза в щелочной или кислой среде. При наличии фенольного гидроксила в молекуле (природные и синтетические эстрогены) используют также реакции галогенирования и образования азосоединений. Ряд перечисленных химических реакций применяют для количественного определения стероидных гормонов и их аналогов титриметрическими или фотоколориметрическим методами. Испытания на подлинность и количественное определение выполняют также методом УФ-спектрофотометрии.
Список использованной литературы
1. Арзамасцев А.П. Фармакопейный анализ – М.: Медицина, 1971.
2. Беликов В.Г. Фармацевтическая химия. В 2 частях. Часть 1. Общая фармацевтическая химия: Учеб. для фармац. ин-тов и фак. мед. ин-тов. — М.: Высш. шк., 1993. - 432 с.
3. Глущенко Н.Н. Фармацевтическая химия: Учебник для студ. сред. проф. учеб. заведений / Н.Н. Глущенко, Т.В. Плетенева, В.А. Попков; Под ред. Т.В. Плетеневой. — М.: Издательский центр «Академия», 2004. — 384 с.
4. Драго Р. Физические методы в химии – М.: Мир, 1981
5. Кольтгоф И.М., Стенгер В.А. Объемный анализ В 2 томах – М.: Государственное научно-техническое издательство химической литературы, 1950
6. Коренман И.М. Фотометрический анализ – М.: Химия, 1970
7. Коростелев П.П, Фотометрический и комплексометрический анализ в металлургии – М.: Металлургия, 1984, 272 с.
8. Логинова Н.В., Полозов Г.И. Введение в фармацевтическую химию: Учеб. пособие – Мн.: БГУ, 2003.-250 с.
9. Мелентьева Г.А., Антонова Л.А. Фармацевтическая химия. — М.: Медицина, 1985.— 480 с.
10. Мискнджьян С.П. Кравченюк Л.П. Полярография лекарственных препаратов. – К.: Вища школа, 1976. 232 с
11. Фармацевтическая химия: Учеб. пособие / Под ред. Л.П. Арзамасцева. – М.: ГЭОТАР-МЕД, 2004. - 640 с.
12. Фармацевтический анализ лекарственных средств / Под общей редакцией В.А. Шаповаловой – Харьков: ИМП «Рубикон», 1995
13. Фармацевтичний аналіз: Навч. посіб. для студ. вищ. фармац. навч. закл. III—IV рівнів акредитації/ П.О. Безуглий, В.О. Грудько, С.Г. Леонова та ін.; За ред. П.О. Безуглого,— X.: Вид-во НФАУ; Золоті сторінки, 2001.— 240 с.
8-09-2015, 23:33
