Терапевтическая эффективность липосом с липофильными пролекарствами показана нами in vivo на моделях рака молочных желез и лимфолейкозов. Увеличение продолжительности жизни мышей c перевитым лейкозом Р-388 при лечении липосомальным препаратом диглицеридного конъюгата сарколизина возросло в 1,5 раза, по сравнению с лечением интактным лекарством [9], а при лечении мышей BLRB c перевитым раком молочных желез этот показатель увеличился в два раза [10]. Недавно нами проведено кратковременное лечение острого Т-лимфолейкоза мышей метотрексатом и липосомальными препаратами конъюгата метотрексата. Эта модель лимфолейкоза проявляет сходство с Т-клеточными лимфомами человека, которые очень агрессивны и трудно поддаются химиотерапевтическому лечению. Тем не менее даже в режиме умеренной терапии липосомы с конъюгатом метотрексата показали улучшение выживания по сравнению с исходным лекарством почти на 10 %. Необходимы дальнейшие исследования для оптимизации режимов лечения (дозы, число инъекций и т.д.) и исследования фармакокинетики и биораспределения лекарственных липосом, которые уже зарекомендовали себя как перспективную систему доставки для наномедицины.
2.6 Иммуносомы-разновидность липосом
Оригинальным направлением в липосомологии явилась разработка нового поколения лекарственных препаратов – иммунолипосом. Иммунолипосомы представляют собой липосомы, к которым прикреплены моноклональные антитела (МКА). МКА обеспечивают специфическое связывание липосом с антигенпозитивными клетками, а липосомы несут соответствующий гидрофобный или гидрофильный химиотерапевтический препарат.
В настоящее время различают три типа иммунолипосом: А, В и C [3]. В иммунолипосомах типа А МКА ковалентно связаны с обычными липосомами посредством короткого якоря. Тип B – это уже пегилированные липосомы, в которых МКА также ковалентно связаны с ними посредством короткого якоря. Тип С (Pendant-type PEG-immunoliposomes) – это стерически стабилизированные ПЭГ липосомы, в которых МКА прикреплены к дистальному терминальному концу ПЭГ.
С помощью липосом типа А было убедительно продемонстрировано, что иммунолипосомы более эффективно доставляют лекарства в клетки-мишени по сравнению с обычными липосомами в тестах как in vitro, так и in vivo [4]. Однако связывание иммунолипосом с клетками-мишенями in vivo было более сложным. Изучение иммунолипосом in vivo показало, что прикрепление к липосомам антител усиливало их захват мононуклеарами РЭС. Эффективность связывания иммунолипосом с клетками-мишенями зависела от плотности антител на поверхности липосом. Захват иммунолипосом клетками РЭС и эндотелиальный барьер, разделяющий сосудистое русло от опухолевой ткани, побудили исследователей к созданию нового типа липосом. Это привело к конструированию стерически стабилизированных иммунолипосом, с удлиненным периодом циркуляции в крови.
В первых работах по созданию долгоциркулируюших иммунолипосом к стерически стабилизированным липосомам, содержащим фосфолипиды с модифицированными ПЭГ головными группами, антитела были прикреплены через короткий гидрофильный якорь близко к поверхности липосом (липосомы типа B) [5]. Эти липосомы сохраняли свойство долговременной циркуляции, но взаимодействие с клетками-мишенями было угнетено по тому же механизму, как и угнетение захвата мононуклеарами РЭС, т.е. из-за блокады ПЭГ [6].
Позже МКА были прикреплены к дистальным концам цепей ПЭГ, связанным с липосомами (липосомы типа С). Это привело к сохранению способности стерически стабилизированных липосом специфически связываться с клеточной поверхностью клеток-мишеней и быть защищенными от захвата мононуклеарами РЭС [7].
липосома транспортный частица лечение терапия
Сравнение эффективности специфического связывания и захвата мононуклеарами РЭС этих трех типов иммунолипосом, проведенное K. Maruyama [3] на модели МКА 34А против поверхностного эпителия легких, показало, что 42,5% липосом типа А накапливаются в легких, а в крови и печени выявляется небольшое количество. При введении липосом типа С специфически связываются 56,6% от введенной дозы липосом. В крови и печени накапливалось меньше препарата (7%), чем при инъекции липосом типа А. Липосомы типа B показали низкий уровень специфического связывания и около 60% препарата от введенной дозы долго циркулировало в крови. Таким образом, наиболее перспективными являются липосомы типа С.
В настоящее время для ковалентного прикрепления МКА к терминальным концам ПЭГ, с целью получения стабильной связи антител с ПЭГ, используют три метода, т.е. связывание через серу (thiother) [7], амидные группировки (amide) [3] и гидразоны (hidrazone) [8].
К антителам, используемым в конструировании иммунолипосом, предъявляют определенные требования. МКА должны сохранить свою специфичность при конъюгации с липосомами, иметь афинность, достаточную для связывания низкой концентрации иммунолипосом, обладать низкой иммуногенностью. С этой целью используют гуманизированные МКА, для удаления мышиного белка, а также Fab' фрагменты антител для удаления фрагментов Fc. Антитела должны эффективно интернализовываться клетками-мишенями путем эндоцитоза, обладать биологической активностью и усиливать противоопухолевый ответ. МКА должны быть технологичны в производстве и иметь достаточный срок хранения [9].
К антигену, являющемуся мишенью для иммунолипосом, также имеются определенные требования. Он должен сильно и гомогенно экспрессироваться в опухолевой ткани, быть жизненно важным для опухолевой клетки и не исчезать с клеточной поверхности. Антиген должен минимально слущиваться с поверхности опухолевой клетки для избежания связывания иммунолипосом с растворимым антигеном или усиления клиренса. Комплекс антиген–иммунолипосома должен пиницитироваться в опухолевую клетку.
Связь антител с липосомами должна быть стабильной в крови. Якорь не должен связываться с распознающим местом на молекуле антител и быть иммуногенен, должен быть нетоксичен и избегать опсонизации, не должен влиять на препарат в липосоме, стабильность липосомной мембраны и оказывать стерическое препятствие.
Эффективное связывание иммунолипосом с клетками-мишенями происходит лишь тогда, когда мишени находятся в сосудистом пространстве или когда иммунолипосомы проходят сквозь слабую сосудистую стенку. В литературе рассматриваются два анатомических подхода. Первый – это уже существующие внутрисосудистые места, такие как поверхностный эндотелий сосудов, клетки крови или тромбы. Второй – менее доступные места, такие как солидные опухоли, места инфекции или воспаления, в которых сосудистые структуры слабы [3]. Доказано, что капиллярная проницаемость эндотелиального барьера во вновь васкулиризируемых опухолях значительно выше, чем в нормальных тканях. Нормальные ткани выстланы нефенестрированным сосудистым эндотелием, и прохождение макромолекул или липосом в ткань затруднено. Кроме того, в опухолевой ткани практически отсутствует дренирование лимфатической системой, поэтому макромолекулы и липосомы накапливаются в опухолевой ткани и остаются там длительное время. Несколькими методами в различных опухолевых моделях на мышах было убедительно доказано, что липосомы диаметром 100–200 нм проходят через сосудистую стенку и накапливаются в опухолевой ткани.
Большое значение имеет соотношение антител к липидам в иммунолипосоме. Так, при весовом соотношении 1:50 к одной липосоме присоединялось 24 молекулы моноклональных антител, а при соотношении 1:1 – 935 молекул антител. Специфическое накопление иммунолипосом, конструированных при соотношении 1:50, было 3% от введенной дозы, а созданных при соотношении компонентов 1:1 – 60% от введенной дозы иммунолипосом. Захват иммунолипосом клетками печени снижался с 50% от введенной дозы для липосом с низким содержанием антител до 12% для липосом с высоким содержанием антител. При этом захват иммунолипосом, содержащих низкое количество антител, не отличался от захвата обычных липосом. Иммунолипосомы, которые не связались с клетками-мишенями при первых нескольких пассажах через опухолевые капилляры, накапливались в печени и селезенке [3].
Специфическая доставка противоопухолевых препаратов с помощью иммунолипосом способствовала лучшей терапевтической эффективности и снижению токсичности по сравнению с обычными липосомами [1]. Это было убедительно продемонстрировано на моделях солидных опухолей у мышей [10] на ксенотрансплантатах человеческой B-клеточной лимфомы у голых мышей [8].
К настоящему времени описано несколько препаратов иммунолипосом, потенциально перспективных для применения в онкологической практике. Они направлены против клеток, экспрессирующих антигены CD71 (рецептор трансферрина), Her2/neu (рецептор эпидермального фактора роста) [11], HLA-DR (антигены гистосовместимости II класса) [12, 13], CD19 (обще-В-клеточный маркер) [8], LL2 (антиген В-клеточной лимфомы) [14] и др.
Глава 3. Технология получения липосом
3.1 Структура липосомы
Мембрану липосом обычно формируют из тех же фосфолипидов, которые входят в состав биологических мембран: фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина. Это позволяет достичь полной биосовместимости липосом. Липосомы готовят различными способами, например, подвергая смесь фосфолипидов и воды воздействию ультразвуком, замораживанию и оттаиванию, экструзии через фильтры с наноразмерными порами. В последнее время для получения липосом используют технологию суперкритических растворов. С помощью этих методов можно получить многослойные липосомы, а также крупные и мелкие однослойные липосомы. Размеры липосом, в зависимости от метода их изготовления, могут быть от нескольких микрон до десятков нанометров (наносомы). Если при изготовлении липосом используется водный раствор лекарственного вещества, то часть этого раствора оказывается замкнутой внутри липосомального контейнера и в виде такой лекарственной формы вводится в организм человека. Это важно в тех случаях, когда вводится токсическое соединение, например, противораковый агент, или если лекарственное вещество необходимо защитить от разрушения до момента его доставки к цели. Неполярные органические лекарственные соединения встраиваются в мембрану липосомы и также могут доставляться к цели. Для направленной доставки содержимого липосом к их поверхности ковалентно пришивают адресные моле кулы, например, антитела к поверхностным белкам клеток-мишеней, витамины. Пришивка молекул полиэтиленгликоля защищает сами липосомы от захвата клетками иммунной системы и, таким образом, увеличивает время нахождения липосом в кровотоке. Липосомы доставляют лекарственное вещество в клетки либо путем слияния с их мембраной, либо за счет эндоцитоза. Липосомы как наноконтейнеры для лекарственных веществ применяются в медицине при лечения рака, а также в составе косметических кремов.
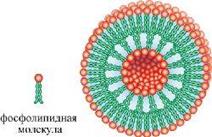
Липосомы, или липидные пузырьки, известны давно, да и знакомы, наверно, каждому: очень похожи на них те капельки жира, которые попадают в воду, но это, разумеется, сходство чисто внешнее. Конечно, те, о которых пойдет речь, очень малы – много меньше клетки, и жир в них не пищевой, а клеточный – липиды, входящие в состав всех клеток организма. Липосомы представляют собой замкнутые пузырьки воды, окруженные одним или несколькими слоями липидов.
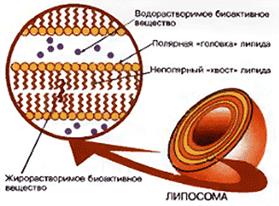
3.2 Механизм действия липосом
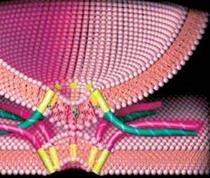
Рис. 6 Липосома в процессе слияния с клеточной мембраной (компьютерная модель)
Важную роль играет также характер взаимодействия липосом с клетками. Оно может принимать разные формы: самая простая – липосомы адсорбируются (прикрепляются) на клеточной поверхности. Дело может на этом закончиться, а может пойти дальше: липосому поглотит клетка (этот процесс «заглатывания» называется эндоцитоз), и вместе с ней внутрь клетки попадут те вещества, которые она доставила. Наконец, липосомы могут слиться с мембранами клеток и стать их частью. При этом могут изменяться свойства клеточных мембран: например, их вязкость и проницаемость, величина электрического заряда. Может также увеличиться или уменьшиться количество каналов, проходящих через мембраны. Таким образом, благодаря липосомам появляется новый способ направленного воздействия на клетку, который можно назвать «мембранной инженерией».
Формы взаимодействия липосом с мембраной клетки: липосома может увеличить проницаемость мембраны – вызвать образование дополнительных каналов (I); может прикрепиться к мембране – адсорбироваться (II); важная форма взаимодействия – поглощение липосомы клеткой, в этом случае вещество, принесенное липосомой, попадает непосредственно в клетку (III); иногда клеточная мембрана и липосома обмениваются липидами (IV), а в других случаях мембраны липосомы и клетки сливаются (V).
Как носители лекарств липосомы наиболее широкое применение получили в экспериментальной онкологии. Суть в том, что существует ряд препаратов, весьма эффективно разрушающих злокачественные клетки или тормозящих их рост. Однако применить их в терапевтических целях не всегда возможно из-за их большой токсичности или плохой растворимости в воде. С помощью липосом эти трудности можно преодолеть. Так, в одной лаборатории с помощью липосом вводили мышам, больным лейкемией, нерастворяющиеся препараты и наблюдали замедление роста числа злокачественных клеток. Другие исследователи нагружали липосомы антрациклинами: эти вещества активны против широкого круга злокачественных опухолей, но весьма ядовиты для остальных тканей, особенно для сердечной мышцы, – и вредное воздействие этих соединений значительно снижалось, что, как следствие, позволяло существенно увеличивать их дозы.
Липосомы можно использовать и для борьбы с инфекционными заболеваниями. Весьма показательными в этом плане могут служить экспериментальные данные по лечению лейшманиоза – заболевания, широко распространенного в южных странах, где различными его формами страдает около 100 миллионов человек. Болезнь поражает печень, селезенку, костный мозг.
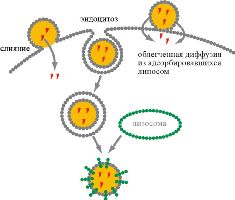
Рис 7. Способы проникновения содержимого липосом в клетку
3.3 Технологии получения липосом
Для получения липосом известны различные способы. Так, например, они могут быть получены способом дегидратации/регидратации, в соответствии с которым липид растворяют в органическом растворителе, таком как хлороформ, дихлорметан или спирт, такой как метанол или этанол. Затем раствор высушивают с использованием, например, роторного испарителя, после чего на стенке испарительной колбы образуется пленка липида. Добавление к сухой пленке воды или водного раствора, такого как буфер, приводит к образованию многослойных липосом. Образованием именно этого продукта завершается первая стадия образования везикул с использованием различных методик. Последующая обработка может приводить к дегидратации/регидратации везикул, или ДРВ (DRV) (Kirby and Gregoriadis, Biotechnology (1984) 2, 979-984). Альтернативно, при последующей обработке ультразвуком липидной суспензии получают однослойные липосомы (A.D.Bangham et al., J. Mol. Biol. 13, 238 (1965)).
Другие известные в технике способы включают детергентную обработку (Y. Kagawa et al. , J. Biol. Chem. (1971) 246, 5477), выпаривание с обращением фаз (F. Szoka and D.Рараhadjopoulos, Proc. Natl. Acad. Sci, USA (1978) 75, 4194) ивведениеэфира (D.Deamer et al., Biochim. Biophys. Acta, (1976) 433, 629), а также лиофилизацию (см., например, работу Ohsawa et al., Chem. Pharm. Bull, (1984) 32, 2442-5 and Kirby and Gregoriadis (1984) supra.) иметодызамораживания - оттаивания (D.D.Lasic "Liposomes: From Physics to Application, Elsevier, 1993, p. 98).
В зависимости от применяемого для образования липосом способа получают липосомы разного размера и с различающимися характеристиками. Липосомы могут использоваться для инкапсулирования материалов, таких как биологически активные продукты, в частности фармацевтические средства, включая вакцины, а также нефармацевтические средства, такие как продукты, воздействующие на кожу, в частности препараты для искусственного загара и другие средства макияжа. Методики инкапсулирования варьируют в зависимости от природы инкапсулируемого реагента и размера и свойств образованных липосом.
Размер липосом важен с точки зрения их применения. В некоторых случаях нужны крупные липосомы, в тех случаях, например, когда инкапсулируются частицы, включающие микроорганизмы, такие как бактерии, для получения, например, вакцин, как описано в документе WO 95/09619.
Однако во многих случаях предпочтительны мелкие липосомы. Это связано с тем, что мелкие липосомы не так быстро удаляются ретикуло-эндотелильной системой (РЭС), и в меньшей степени, чем крупные липосомы (с размерами свыше 200 нм). Захват везикул в РЭС возрастает с увеличением их размера. Кроме того, крупные липосомы при их внутримышечной инъекции не способны эффективно достичь регионарных лимфатических узлов и доставить в них вакцины и другие средства (Gregoriadis G. , Liposomes as Drug Carriers: Recent Trends and Progress, Wiley Chichester, 1988).
Липосомные препараты, содержащие различные лекарственные средства, могут быть оптимизированы с точки зрения содержания лекарственного ингредиента, стабильности, картины биологического распределения и уровня поступления в клетку путем изменения физико-химических параметров липосом, таких как температура фазового перехода, размер липосом, характер распределения препарата по размеру, величина поверхностного заряда, гидратация поверхности соединениями, несущими гидрофильные группы, и характер распределения по размеру частиц.
Размер липосом представляет собой параметр, который определяет фракцию, захватываемую РЭС (Senior et al., Biochem., Biophys., Acta (1985) 839. 1-8: Nagayasu et al. , Biol. Pharm. Bull. (1995) 18 (7), 1020-1023). Мелкие липосомы могут быть получены при использовании гомогенизаторов под высоким давлением (Talsma et al., Drug Development and Industrial Pharmacy (1989) 15 (2) 197-207, Vemuri S. et al., Drug Development and Industrial Pharmacy (1990) 16 (15), 2243-2256), но при этом используют большие количества липидов, для того чтобы добиться приемлемой величины коэффициента отношения включенного лекарственного средства к липидной массе. При использовании другого подхода (Gresoriadis et al. , Int. J. Pharm. 65
8-09-2015, 20:13
