Показан стабилизирующий эффект на везикулы, возникающий при добавлении сахара после получения липосом (Crowe L.M. et al., Arch. Biochem. Biophys. 242 (1985) 240-247, Hauser et al., Biochem. Biophys. Acta (1987) 897, 331-334), в том случае, например, когда липосомы, содержащие лекарственное средство, лиофильно высушивают для хранения и затем подвергают повторной гидратации.
Предлагается способ получения липосомного препарата, содержащего реагент, который включает следующие стадии:
(1) образование пустых липосом;
(2) смешивание липосом, полученных на стадии (1), с раствором сахара и указанного реагента и
(3) высушивание смеси, полученной на стадии (2).
При повторной гидратации высушенного материала, полученного на стадии (3), образуются липосомы, содержащие включенный в них реагент. При получении таким способом липосом увеличение их размера относительно липосом, образуемых на стадии (1), происходит в значительно меньшей степени, чем в случае липосомных препаратов, которые не содержат сахара. И в этом случае указанные выше процессы экструзии, обработки в псевдоожиженном слое или гомогенизации могут быть исключены.
Установлено, что в ходе сушки с использованием соответствующих концентраций сахаров, до определенной степени снижается уровень слияния и агрегации липосом при образовании аморфной стеклоподобной массы (Crowe et al., Arch. Biochem. Biophys. , 242 (1985) 240-247), а также взаимодействие сахаров с основной группой фосфолипидов (Crowe et al., Cryobiology, 31 (1994) 355-366). В ранних исследованиях дегидратированные/регидратированные везикулы (ДРВ) получали без использования cахаров в качестве стабилизаторов, при этом процедура основывалась на индукции слияния/агрегации образующихся мелких однослойных везикул при контролируемой регидратации (Kirby, Gregoriadis, 1984). В этой связи, можно было предположить, что общая стабилизация мелких однослойных везикул за счет добавления соответствующих количеств cахаров будет сопровождаться при восстановлении исходных MOB (SUV) очень низкой величиной включения.
Однако оказалось, что это не так. Хотя, как и в случае всех липосом, степень включения реагента зависит в некоторой мере от характеризующего систему коэффициента отношения липид:реагент, тем не менее ожидается, что уровень инкапсулирования реагента в липосомы, достигаемый при использовании способа по настоящему изобретению, будет вполне приемлемым.
Кроме того, применение липосом в качестве системы доставки лекарств налагает определенные требования к их физической и химической стабильности. Липосомы в виде водной дисперсии подвергаются гидролизу и физическим изменениям в процессе хранения, включая подтекание инкапсулированных лекарственных средств, а также изменение размеров в результате агрегации или слияния. Однако ожидается, что физическая и химическая стабильность липосом, получаемых по способу настоящего изобретения, будет хорошей.
Таким образом, настоящий способ дает возможность получать мелкие липосомы с высокой загрузкой, которые, как отмечалось выше, будут особенно полезны при создании фармацевтических композиций. Кроме того, заявленный способ может использоваться для приготовления инкапсулированных материалов разных типов.
Однако способ согласно настоящему изобретению будет особенно полезен при изготовлении липосом для применения в фармацевтической области. В этом случае используемые в рамках данного способа реагенты будут включать биологически активный материал, такой как фармацевтический ингредиент или лекарственное средство. Для этой цели получаемые на стадии (i) липосомы должны представлять собой мелкие однослойные везикулы со средним размером, например, в диапазоне от 25 нм до 90 нм, предпочтительно в диапазоне от 50 нм до 90 нм и наиболее предпочтительно от 70 нм до 90 нм. В конечном итоге, получаемые в рамках этого способа липосомы будут иметь все еще небольшой размер, в среднем менее 500 нм и обычно от 100 до 200 нм.
Имеющиеся на стадии (1) липосомы представляют собой пустые липосомы, получаемые посредством любого традиционного способа, например с помощью описанного выше классического способа. При этом любые образованные липосомы, в случае если их средний размер слишком велик для целевого использования, могут быть уменьшены с помощью известных в технике способов, например ультразвука, гомогенизации, экструзии или техники псевдоожиженного слоя.
Для получения липосом используют известные в технике липиды. Они включают, например, лецитины, такие как, например, фосфатидилхолин (ФХ), дипальмитоилфосфатидилхолин (ДПФХ), дистеароилфосфатидилхолин (ДСФХ), или заряженные липиды, в частности анионные липиды, такие как фосфатидиновая кислота, или катионные липиды, такие как стеариламин, необязательно в присутствии холестерина. Предпочтительным липидом является ДСФХ. Выбор липида зависит, в определенной мере, от природы активного средства и от цели использования липосом.
Приемлемые для использования на стадии (2) растворы сахаров включают водные растворы моносахаридов, таких как глюкоза и фруктоза, дисахаридов, таких как лактоза или сахароза, а также полисахаридов. Особенно предпочтительным для использования в способе настоящего изобретения сахаром является дисахарид, такой как сахароза или лактоза, или моносахарид, такой как глюкоза. В особенности, в качестве сахара предпочтительна сахароза.
В предпочтительном варианте на стадии (2) используют такое количество сахара, чтобы отношение массы сахара к массе липида составляло от 1:1 до 6:1 (вес/вес) и более предпочтительно - в диапазоне от 1:1 до 5:1 (вес/вес). Было обнаружено, что чем большее количество сахара используют, тем меньше увеличение размера липосом, получаемых после регидратации, в сравнении с имевшимися на стадии (1). Однако при этом уровень включения реагента может быть ниже. Таким образом, правильный выбор используемых в данном способе коэффициентов указанных соотношений будет зависеть от их целевого использования, при этом необходимо определять нужный баланс между степенью включения реагента при данном содержании липтида и размером липосомы. Разница между этими параметрами находит отражение в определенной вариабельности воздействия конкретного реагента на образование липосом, что будет пояснено ниже. В приемлемом варианте количество имеющегося сахара менее 10% (вес/объем) от всей композиции.
Кроме того, было показано, что увеличение объема используемого в рамках данного способа сахарного раствора при снижении его концентрации может способствовать повышению уровня включения. Приемлемые концентрации растворов сахаров находятся в диапазоне от 20 до 200 мМ, предпочтительно от 30 до 150 мМ.
Далее, было также обнаружено, что если последующую регидратацию проводить при повышенных температурах, например от 30 до 80oС, в частности от 40 до 65oС, и в особенности примерно при 60oС, то уровень включения может быть повышен. Показана эффективность такой процедуры в случае липосом, включающих ФХ и холестерин (ХОЛ), которые обычно образуются при комнатной температуре. Однако при использовании в рамках такого способа повышенных температур может наблюдаться некоторое увеличение размера липосом в сравнении с их исходными значениями, что нужно принимать во внимание при выборе условий, практикуемых для получения липосом в каждом конкретном случае.
К числу других факторов, которые, как было показано, также влияют на уровень включения, относятся индивидуальная природа реагента, такого как инкапсулируемое лекарственное средство, и, в частности, растворимость и количество такого реагента. При этом в некоторых случаях растворимость реагента может лимитировать то его количество, которое может быть растворено на стадии (2) и далее включено в липосому. К числу других факторов, влияющих на количество включаемых реагентов, относятся взаимодействия реагента с липидами липосомы, а также проницаемость липосомы для реагента.
В случае наличия в растворе, используемом на стадии (2) реакции, высоких концентраций реагента процент его включения может быть снижен. В этой связи, по экономическим причинам может быть выгодно снижать количество применяемого реагента.
Условия, выбираемые для целей получения липосом желательных размеров и нагрузки, включают коэффициент отношения массы сахара к массе липида, природу липида, концентрацию используемого раствора сахара, количество включенного в раствор реагента и температуру регидратации, которые могут быть определены для каждого конкретного реагента с помощью обычных процедур.
Указанная выше стадия (3) может проводиться с использованием традиционных способов, например с помощью лиофильной сушки, распылительной сушки, флэш-кристаллизации, высушивания в воздушном потоке (например, в псевдоожиженном слое), вакуумной сушки, сушки в печи или посредством любого другого известного в технике способа. И хотя механические свойства продуктов, получаемых описанными способами, могут различаться, при том что продукт распылительной сушки будет представлять собой дискретный и зачастую текучий порошок, тогда как лиофильная сушка дает твердую лепешку, свойства липосом при регидратации с точки зрения их стабильности и способности к нагрузке реагентом будут в целом сходными.
Распылительная сушка может оказаться предпочтительной для ряда приложений, включая приготовление фармацевтических композиций, поскольку она позволяет получать продукт с приемлемыми для дальнейшей обработки механическими свойствами.
Продукт, получаемый при лиофильной сушке, включает блочную пористую массу, обладающую относительно слабыми механическими характеристиками. С помощью размалывания этой массы ей могут быть приданы лучшие механические свойства, однако имеется риск возникновения повреждений на такой дополнительной стадии.
Распылительная сушка может дать продукт с хорошими механическими характеристиками, который может быть доставлен ингаляцией или введен парентерально после разбавления водой.
Последующая стадия регидратации может быть осуществлена в ходе процесса производства или альтернативно композиция может поставляться в сухом виде и дальше подвергаться регидратации уже в сайте предполагаемого введения, например, в больнице или в фармацевтическом отделении, когда инкапсулированное лекарственное средство должно быть доставлено пациентам.
Образуемые липосомы отличаются хорошей стабильностью, что определяет длительный срок годности продукта. Это свойство важно, например, для косметических продуктов, гигиенических принадлежностей и фармацевтических средств.
Как отмечалось выше, указанный способ особенно хорошо подходит для получения относительно мелких липосом с высокой степенью нагрузки реагентом. Это особенно желательно для применения в фармацевтической области, в частности для доставки материалов, таких как полимерные или белковые лекарственные средства, ДНК-содержащие вакцины, векторы для генной терапии или химические лекарственные средства. Приемлемые химические средства включают антибиотики, такие как окситетрациклины, b-лактамные антибиотики, такие как пенициллины, в частности пенициллин G, ампициллин или амоксициллин, или цефалоспорины, а также противораковые средства, гормоны, иммунотерапевтические препараты, противовирусные средства, противовоспалительные соединения и др.
На основе получаемых с помощью вышеописанного способа липосомных продуктов могут быть приготовлены фармацевтические композиции, например, при объединении их с фармацевтически приемлемыми носителями или наполнителями. Такие композиции могут быть пригодны для целей перорального, парентерального, и, в частности, внутривенного, или местного введения, например, на поверхность кожи или слизистой. Особенно полезной в рамках настоящего изобретения является композиция, пригодная для введения с помощью аэрозольного распылителя или ингалятора. Было обнаружено, что для этой цели приемлемы нейтральные липосомы липидной природы с высоким фазовым переходом, такие как липосомы, образуемые из смесей ДСФХ и холестерина. При осуществлении процесса в соответствии со способом настоящего изобретения, проведение экструзии перед сушкой может стать необязательной процедурой.
Ниже изобретение пояснено с помощью прилагаемых чертежей, при этом:
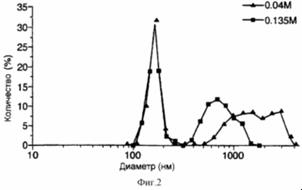
Рис 8. представляет собой график, демонстрирующий изменение размера дипальмитоилфосфатидилхолиновых (ДПФХ) и холестериновых (ХОЛ) липосом при их обработке ультразвуком и при лиофильной сушке с 0,0357 М сахарозы и затем регидратации;
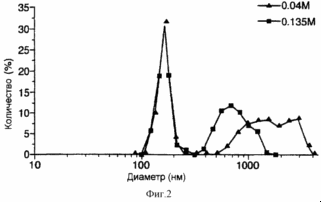
Рис. 9 представляет собой график, иллюстрирующий влияние молярности раствора сахарозы на распределение размеров ФХ:ХОЛ липосом, включающих FITC-альбумин (% распределения:интенсивность), получаемых после лиофильной сушки и регидратации,
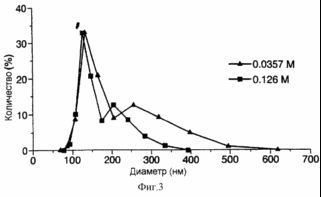
Рис. 10 представляет собой график, демонстрирующий влияние молярности раствора сахарозы на распределение размеров, получаемых после регидратации ФХ:ХОЛ липосом, включающих эпидермальный ростовой фактор (EGF)
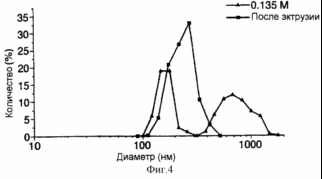
Рис . 11 представляет собой график, иллюстрирующий в сравнительном аспекте данные по распределению размеров экструдированных и регидратированных ФХ:ХОЛ липосом, содержащих FITC-альбумин,
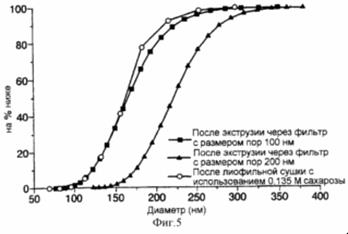
Рис . 12 представляет собой график, иллюстрирующий распределение размеров экструдированных и лиофильно высушенных липосом, полученных по способу настоящего изобретения, которые содержат в инкапсулированном виде карбоксифлуоресцеин (КФ);
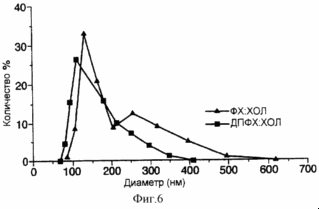
Рис . 13 представляет собой график, иллюстрирующий распределение размеров различных липосомных композиций
В приведенных ниже примерах фосфатидилхолин яйца (ФХ), дипальмитоилфосфатидилхолин (ДПФХ) и дистеарилфосфатидилхолин (ДСФХ) получают от Липоид ГмбХ (Lipoid GmbH, Ludwigshafen, Germany), холестерин, карбоксифлуоресцеин (КФ), альбумин, меченный флуоресцеинизотиоцианатом (FITC-альбумин), рибофлавин, даунорубицин, доксорубицин, Тритон Х-100, сахарозу, глюкозу и додецилсульфат натрия (ДСН, SDS) получают от компании Сигма (Sigma, Лондон). Эпидермальный фактор роста (ЭФР, EGF) был любезно предоставлен Центром Биологических Исследований, Гавана, Куба (Centre of Biological Sciences). Na125I, С14-меченый гидроксипропил-b-циклодекстрин и С14-меченый пенициллин были приобретены у компании Амершам Интернешнл, Великобритания (Amersham International, Amersham, UK). Мечение ЭФР с помощью 125I выполняют по хлораминатному методу. Все другие реагенты имеют аналитическую степень чистоты.
3.4 Гидрогель липосомные гибриды
Для получения своих липосом-гидрогелевых гибридных пузырьков исследователи адаптировали разработанную специалистами NIST и Университета Мэриленда технологию, известную как COMMAND (COntrolled Microfluidic Mixing And Nanoparticle Determination), в которой используется микроскопическое жидкостное (микрофлюидное) устройство. В новой работе ученых молекулы фосфолипидов растворены в изопропиловом спирте и подаются через тончайший входной канал (21 микрометр в диаметре) в канал-«смеситель», а затем «фокусируются» в струю жидкости водным раствором, подаваемым через два боковых канала. Молекулы предшественника гидрогеля смешены с фокусирующей жидкостью.
В то время как компоненты смешиваются на границе раздела потоков жидкости, происходит самосборка молекул фосфолипидов в нанопузырьки контролируемого размера, захватывающие внутрь находящиеся в растворе мономеры. Вновь образованные пузырьки затем облучаются ультрафиолетовым светом, чтобы полимеризовать находящиеся в них молекулы-предшественники гидрогеля в твердый гель из поперечно-связанных цепочек. Эти цепочки придают прочность пузырькам, позволяя им сохранять сферическую форму конвертов-липосом (что, в свою очередь, способствует проходу всей частицы через клеточную мембрану).
Чтобы превратить гибридный гидрогель-липосомный пузырек в средство адресной доставки лекарственных веществ в опухолевую клетку, нужно добавить лекарство или другой груз к фокусирующей жидкости в процессе производства.
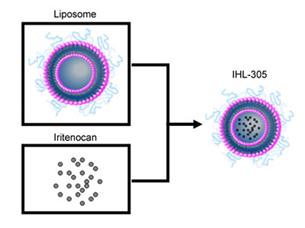
Корпорация "Terumo" совместно с Yakult Honsha Co. Ltd. запустили в производство липосомный комплекс, включающий в себя лекарство против рака. Первая стадия клинических испытаний стартовала в мае этого года в США.
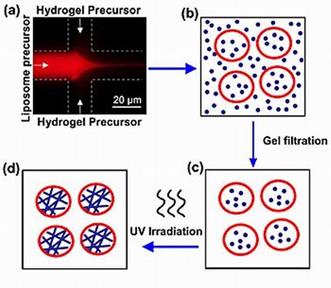
Рис 13 Схематическое изображение образования гидрогель-липосомного гибрида.
Раствор, содержащий фосфолипиды (предшественники липосом), смешиваются с раствором, содержащим молекулы предшественника гидрогеля (а). Смешиваясь на границе раздела двух жидкостей, фосфолипиды образуют липосомы (b), захватывающие внутрь себя молекулы предшественника гидрогеля. Вещество снаружи пузырьков удаляется (с), а липосомы подвергаются воздействию ультрафиолетовым светом. Это полимеризирует белковые цепочки гидрогеля и приводит к образованию гидрогель-липосомного гибрида
Глава 4. Способы активизации липосом как транспортных частиц
4.1 Липосомы, способные к триггерному выходу лекарства: Термо и рН- чуствительные липосомы
Стабилизированные липосомы проникают из сосудов в опухолевые ткани, где в конечном итоге происходит выход лекарства и проникновение его в опухолевые клетки. Процессы, действующие как стимуляторы выхода препарата из липосом, могут включать захват липосом рэтикулоэндотелиальной системой, а также дестабилизацию тканевыми липазами, окисляющими агентами или другими тканевыми компонентами [44]. Новые подходы в создании липосомальных препаратов включают конструирование липосом, способных к триггерному выходу препарата: такие липосомы могут подвергаться структурным изменениям в ответ на физико-химические стимулы, таким образом можно контролировать выход препарата из липосом. Примером таких липосом являются: термочувствительные липосомы, из которых при гипертермии наблюдается выход лекарства, и рН-чуствительные липосомы, триггером которых является кислая среда.
Гипертермия может усиливать накопление в опухоли стабильных и длительно циркулирующих липосом, при этом гипертермия используется и как дестабилизатор термочувствительных липосом, таким образом, обеспечивая выход лекарства в гипертермированный регион. Термолипосомы должны состоять из липидов температурная фаза перехода которых выше 37С. Таким образом, гипертермия индуцирует структурные изменения, приводящие к быстрому выходу инкапсулированного в липосомы препарата. Например, термочувствительные липосомы с доксорубицином были тестированы in vitro на клетках сублинии MCF-7 с МЛУ. При действии на них липосомального доксорубицина и гипертермии клеточный рост был ингибирован на таком же уровне, как и на клетках без МЛУ [87]. При этом наблюдался быстрый выход доксорубицина при 39-40С.
4.2 Комбинация липосом и ингибиторов мембранных транспортеров
Многие агенты способны ингибировать мембранные транспортеры, такие как P-gp, хотя до сих пор нет четких доказательств преимущества этих ингибиторов в клинике. Трудностями в развитии ингибиторов P-gp являются фармакологические ограничения, как самих ингибиторов, так и в комбинации с химиотерапией. Например, PSC 833 (валосподар) аналог циклоспорина и мощный ингибитор P-gp. Хотя этот агент сам вызывает токсичность при использовании его в комбинации с химиотерапевтическими препаратами, такими как даунорубицин, доксорубицин и паклетаксел, наблюдается значительное изменение в клиренсе и фармакокинетике химиотерапевтических лекарств, приводящее к усилению токсичности [12]. В предклинических исследованиях комбинация PSC 833 с липосомальным доксорубицином была предпочтительнее, чем со свободным препаратом, поскольку он предотвращал нежелательное взаимодействие между лекарствами, пегилированный липосомальный доксорубицин был не затронут PSC 833. Липосомальная доставка может уменьшать определенные фармакологические сложности, связанные с сопутствующей антирезистентной терапией, путем включения антирезистентных агентов в липосомы. В ранних исследованиях в липосомы упаковывали ингибитор P-gp валиномуцин, который сам обуславливал значительную токсичность. Липосомальный валиномуцин давал меньшую токсичность без уменьшения ингбиторной активности для P-gp в экспериментальных моделях [40].
4.3 Доставка аналогов гидрофобных лекарств
Липосомы могут также использоваться для доставки аналогов гидрофобных лекарств, предназначенных для предотвращения резистентности, опосредованной мембранными транспортерами. Например, антрациклин -аннамицин и липофильное производные платины [105]. Эти соединения предназначены для того, чтобы сделать клеточный захват относительно независимым от P-gp и/или других выбрасывающих лекарства насосов. Хотя липосомальный аннамицин, проявил активность в предклинических исследованиях на моделях с лекарственной резистентностью, во II фазе клинических исследований липосомальный аннамицин никаких ясных доказательств эффективности у пациентов с раком молочной железы, резистентных по доксорубицину не показал [24].
4.4 Использование липосомальных векторов
8-09-2015, 20:13
