Существуют различные подходы генной терапии для ингибирования, преодоления или использования механизмов резистентности. Прогресс в этой области и в генной терапии опухолей в настоящее время ограничен недостаточным развитием генно-векторной технологии для доставки нуклеиновых кислот. Для вирусных векторов характерны: канцерогенность, токсичность, иммуногенность, не специфичность, низкая экспрессия вирусных рецепторов на опухолевых клетках, а также сложная процедура создания. Использование липосомальной системы доставки более дешево. Однако эти системы опираются в основном на катионные липиды/липосомы для упаковки нуклеиновых кислот, которые являются более стабильными, чем нейтральные липосомы, созданные для эффективной длительной циркуляции. Конструкции, содержащей ген, необходима стабильность для проведения успешной генной терапии, более того, добавление фрагментов антител или других лигандов к конструкции может позволить сделать генную доставку более специфичной и эффективной.
Генная терапия на основе липосом включает подходы, при которых возможно прямое воздействие на механизмы лекарственной резистентности [71, 104]. Например, использование катионных липосом для доставки антисмысловых олигонуклеотидов или рибозимов против сиквенсов MDR1 гена, а также использование технологии генной терапии для гиперэкспресси генов лекарственной резистентности в нормальных тканях, для защиты тканей от токсического действия химиотерапии [123, 15, 83]. Например, ген MDR1 трансфецированный посредством липосомальных векторов в гематопоэтические предшественники в костном мозге [14].
Олигонуклеотиды сконструированы для того, чтобы смодулировать передачу генетической информации, но механизмы, с помощью которых олигонуклеотиды могут индуцировать биологический эффект, сложны. Для того чтобы антисмысловые олигонуклеотиды снижали экспрессию гена, он должен проникнуть в клетки мишени. Данные о точных механизмах, вовлеченных в этот процесс не ясны. Захват происходит через активный транспорт, который в свою очередь зависит от температуры, структуры и концентрации олигонуклеотидов и линии клеток [78, 128, 135]. Многочисленными работами было продемонстрировано, что олигонуклеотиды плохо интернализуются в клетках вне зависимости от того отрицательно они заряжены или нет, а также обязательным условием для действия антисмысловых олигонуклеотидов является, по-видимому, их ядерная локализация [54, 22]. Для того чтобы улучшить клеточный захват и активность антисмысловых олигонуклеотидов используют транспортеры, такие как липосомы. Использование этих транспортеров позволяет увеличить стабильность олигонуклеотидов от разрушения нуклеазами и позволяет использовать их меньшие концентрации .
Нуклеиновые кислоты могут легко инкапсулироваться в липосомы, которые содержат водное пространство, либо могут быть связанными с липосомальной поверхностью электростатическими взаимодействиями. Эти векторы, из-за их положительного заряда, имеют высокую аффинность к мембранам клеток, которые отрицательно заряжены при физиологических условиях [119].
Вс1-2 - важный антиапоптотический белок, который определяется в различных человеческих опухолевых клетках. Его ингибирование может теоретически вызывать чувствительность клеток к цитотоксической химиотерапии, что было показано в ряде последних исследований на тканевых культурах и экспериментальных моделях, которые привели к началу клинических испытаний [59].
Гиперэкспрессия Вс1-2 наблюдается при многих видах новообразований. Вс1-2 повышен приблизительно в 35% опухолей у больных раком предстательной железы [86, 21]. При гиперэкспрессии белка bcl-2 в опухолевых клетках простаты LNCaP увеличивался их in vivo туморогенный потенциал и появлялась резистентность к апоптозу [108]. Экспрессия Вс1-2 в нормальных эпителиальных клетках предстательной железы является низкой или отсутствует.
Первоначально, антисмысловые фосфодиестер и фосфоротиоат олигонуклеотиды к мРНК bcl-2, использовались для ингибирования роста клеток в культуре 697 человеческой лейкемии [112]. Мишенью олигонуклеотидов является сайт инициации трансляции человеческого мРНК bcl-2. Оба класса олигомеров уменьшают клеточную пролиферацию: фосфоротиоаты более сильные ингибиторы, эксперименты с фосфодиестером в настоящее время потеряли свою значимость. Предполагалось, что фосфоротиоат bcl-2 антисмысловые олигонуклеотиды индуцируют клеточную гибель через взаимодействие со специфическими участками [26, 45].
Препарат G3139, представляющий собой фосфодиестер и фосфоротиоат антисмысловые олигонуклеотиды, направленные против первых шести кодонов Bcl-2 мРНК (G3139, Genta, Inc., Lexington, Mass.), был успешно использован на клетках Неходжскинской лимфомы. Молекулярная масса G3139 - 579,99. Он нестабилен в растворах со значением рН менее 3 или выше 7. Предполагаемое специфическое уменьшение уровня Вс1-2 мРНК через один день после обработки было продемонстрировано Kitada и соав. в клетках SU-DHL-4 [69]. Соизмеримое уменьшение в уровне белка Вс1-2, наблюдалось только после трех дней, по-видимому, из-за длительного периода жизни белка Вс1-2, что было связано с сильным снижением клеточной жизнеспособности. Обработка клеток лимфомы RS11846 препаратом G3139 приводила к уменьшению экспрессии Вс1-2 и увеличени. чувствительности этих клеток к АгаС и метотрексату [70]. При этом использовалась чрезвычайно высокая концентрация олигонуклеотидов.
Обработка опухолевых клеток LNCaP и опухоли Шионоги in vitro G3139 ингибировала экспрессию Вс1-2, что зависело от дозы и специфичности последовательностей [50, 89]. Авторы использовали катионный липид липофектина для доставки и измеряли уровни bcl-2 белка и мРНК. Однако они использовали только одиночный контроль олигонуклеотида, который уменьшает достоверность эксперимента. В других экспериментах, антисмысловые олигонуклеотиды существенно усиливали чувствительность к паклитакселу и доцетакселу, причем усиление действия препаратов зависело от их дозы. Характерные апоптотические изменения были обнаружены только после комбинированного лечения, а не после использования одного Вс1-2 олигомера [37, 51].
В настоящее время фосфоротиоат олигонуклеотиды (G3139) изучаются при введении внутривенно или интроперитонеально у пациентов, которые принимают участие в клинических испытаниях [13, 60]. Эти олигонуклеотиды стабильны в течение 48 часов, к этому времени их уровни все еще могут определяться в тканях. После внутривенного введения G3139 в дозе приблизительно 5 мкг/кг, элиминация в плазме составляет 22ч [34, 35, 111, 133].
Данные клинических исследований дают основания для дальнейшего клинического развития G3139, как монотерапии, так и в комбинации с другими цитотоксическими препаратами [29, 36, 64, 65, 91, 130, 131]. G3139 в настоящее время проходит I/II фазы испытаний у пациентов с андроген-независимым раком предстательной железы, которым назначают G3139 в комбинации с доцетакселом. Клинические испытания других нозологии опухолей планируются [29, 91]. Эффективность этого препарата в клинике в настоящее время обнадеживает, так как его токсичность относительно низкая, состоит, главным образом, в утомлении и тромбоцитопении.
Глава 5. лекарственные препараты на основе липосом
При парентеральном введении распределение липосом в организме зависит от состава липосомальной мембраны, их размера, заряда, других химических и физических параметров везикул и иммобилизованных в них веществ, а также от способа введения. Так, например, после подкожного введения большинство липосом депонируется в месте введения и элиминируется оттуда преимущественно лимфогенным путем. Таким образом, местное введение липосомальных препаратов является оптимальным способом их доставки в регионарные лимфоузлы.
При внутримышечном введении липосомы способны создавать депо препарата в месте введения, скорость элиминации из депо зависит от размера и свойств липосом и составляет от нескольких часов (мелкие липосомы) до нескольких дней (крупные). Мелкие бислойные липосомы в отличие от крупных при внутрибрюшинном или внутримышечном введении гораздо быстрее проникают в кровеносное русло, что указывает на ограниченную способность последних проходить через капилляры и мембраны сосудов. При внутривенном введении мелкие липосомы выводятся из кровотока медленнее, чем крупные.
Для повышения тропности липосом к определенным органам и тканям их изготавливают из фосфолипидов, изолированных из этих органов, или фиксируют на поверхности специфические антитела против соответствующих тканевых антигенов, или применяют так называемые молекулы-посредники, обладающие двумя типами сродства: к клеткам макроорганизма и к липосоме. При необходимости локального воздействия на клинический процесс для исключения системного влияния на организм целесообразно местное применение лекарственных препаратов.
Липосомальные препараты по сравнению с такими традиционными лекарственными формами для наружного применения, как мази и гели, обладают большей способностью проникать в кожу и волосы, поэтому они более доступны для живых клеток-мишеней. Установлено, что липосомы интенсифицируют процессы взаимодействия активных веществ с кожей при лечебной наружной терапии, что повышает терапевтическую эффективность иммобилизованных в них лекарственных веществ. Скорее всего, такой эффект обусловлен слиянием липосом с липидными ламеллами вне базального слоя и высвобождением их внутреннего содержимого. Подвижные липиды липосом встраиваются в липидные ламеллы, увеличивая таким образом «жидкостность» барьера, что улучшает его проницаемость. Другим важным путем проникновения липосом и их содержимого вглубь кожи являются волосяные фолликулы. Эффективность трансдермального липосомального переноса лекарственных веществ можно усиливать с помощью методов ионо- и фонофореза
5.1 Фосфоглив- оригинальный препарат российских технологий
Фосфоглив - оригинальный гепатопротективный препарат на основе фосфатидилхолина (фосфолипид) растительного происхождения (из семян сои) и тринатриевой соли глицирризиновой кислоты из корня солодки.
Фосфоглив разработан в ИБМХ РАМН, как усовершенствованный аналог выпускаемого фирмой Nattermann Internetional GmBH, Germany препарата Эссенциале, используемого для лечения заболеваний печени.
Фосфолипиды являются основным структурным компонентом всех клеточных мембран. При препоральном введении в организм фосфолипиды воостанавливают целостность мембран клеток, в первую очередь печени - гепатоцитов.
Глицирризиновая кислота обладают широким спектром биологической активности, противовоспалительными свойствами, применяются для лечения заболеваний печени токсического и вирусного происхождения, в том числе и гепатита С. За счет детергентного действия обеспечивает эмульгирование фасфатидилхолина в кишечнике.
Сочетание этих двух компонентов делает фосфоглив особенно эффективным при лечении печени.
На протяжении нескольких последних десятилетий «эссенциальные» фосфолипиды являются ведущими препаратами в лечении алкогольной болезни печени и широко применяются в России. Препараты этой группы известны врачам и пациентам и вошли во все отечественные руководства по клинической фармакологии [12].
Основная роль фосфолипидов сводится к восстановлению структуры и функций поврежденных клеточных мембран. Предотвращая потерю клетками ферментов и других биологически активных веществ, фосфотидилхолин, составляющий основу в структуре фосфолипида, нормализует белковый и жировой обмены, восстанавливает детоксицирующую функцию печени, ингибирует процессы формирования соединительной ткани, тем самым снижая интенсивность развития фиброза и цирроза печени. Кроме того, доказано, что алкоголизм служит благоприятным условием для широкого распространения вирусных гепатитов, которые на его фоне имеют более тяжелое течение и неблагоприятные исходы [13].
Авторами было выявлено, что терапия Фосфогливом пациентов с «акогольной болезнью» сокращает сроки пребывания в реанимационном отделении стационара на 16%, а следовательно, уменьшает и затраты на лечение данной категории больных.
Фосфатидилхолин (действующее вещество фосфолипидов) является основным структурным элементом клеточных и внутриклеточных мембран, способен восстанавливать их структуру и функции при повреждении, оказывая цитопротекторное действие. Нормализует белковый и липидный обмены, предотвращает потерю гепатоцитами ферментов и других активных веществ, восстанавливает детоксицирующую функцию печени, ингибирует формирование соединительной ткани, снижая риск возникновения фиброза и цирроза печени.
Глицират (глицирризиновая кислота и соли) обладает противовоспалительным действием, подавляет репродукцию вирусов в печени и других органах за счет стимуляции продукции интерферонов, повышения фагоцитоза, увеличения активности естественных клеток-киллеров. Оказывает гепатопротекторное действие благодаря антиоксидантной и мембраностабилизирующей активности. Потенцирует действие эндогенных глюкокортикостероидов, оказывая противовоспалительное и противоаллергическое действие при неинфекционных поражениях печени.
5.2 Липосом-форте –препарат для применения в неврологической практике
Активное действующее вещество: фосфолипиды гипоталамуса (общее название активного ингредиента) в ампулах по 2 мл содержит: Гипоталамуса фосфолипиды 28 мг.
Вспомогательные вещества: Маннитол, натрия фосфат двузамещенный додекагидрат, фосфат натрия дигидрофосфат дигидрат, эфир п-гидроксибензойной кислоты, вода для инъекций.
Форма выпуска: Раствор для в.м. / в.в. инъекций (внутримышечных или внутривенных инъекций) - № 5ампул по 2мл.
Показания: Терапия метаболической аномалии в результате церебрального нейроэндокринного расстройства. И как вспомогательное средство при болезни Паркинсона и синдромов паркинсонизма.
5.3 Другие препараты,применяемые в медицине
| Торговое название | Международ-ное название | Фирма- производитель или разработчик препарата | Форма выпуска и доза | Примечания. Состав для комбинированных препаратов | ||||
| 1 | 2 | 3 | 4 | 5 | ||||
| Фосфолип | Лецитин | Universal medicare (Индия) | Kапсулы 0,35 г | |||||
| Липин* | Липин* | «Биолек», Украина, Харьков | Лиофилизированный порошок во флаконах для приготовления р-ра для инъекций или ингаляций | При суспендировании в воде образует липосомы | ||||
| Мега-Липин | Фосфатидил холин |
Mega Pharmaceutical (Германия-Ирландия) | Порошок во флаконах для приготовления р-ра для ингаляций или в/в введения; 0,5 г во фл. 50 мл. | Обладает антигипоксическим, муколитическим и бронхолитическим действием. | ||||
| Эссенциале | Эссенциале* | Rhone-Poulenc Rorer (США/Франция), Natterman (Германия) | Р-р для инъекций, капсулы | Эссенциальные фосфолипиды, комплекс витаминов гр. В, РР, Е, ненасыщенные жирные кислоты | ||||
| Лиолив | KНИФТ АМН Украины, УкрФА, «Биолек», Харьков | Лиофилизированный порошок во флаконах для приготовления р-ра для инъекций или перорального приема | Kомплексное соединение, содержащее мефенаминат алюминия, заключенный в липосомы липина. | |||||
| Липофен | ГНЦЛС, Харьков | Kапсулы | Эссенциальные фосфолипиды, витамины В1, В6 и Е, флакумин. | |||||
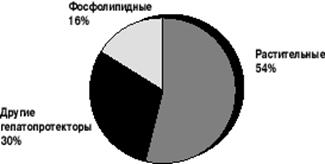
Доля фосфолипидных препаратов в общей номенклатуре «истинных» гепатопротекторов
Амфотерицин В (АмВ) используется в клинической практике с 1959 года. Долгое время он являлся единственным препаратом для терапии тяжелых инвазивных микозов. Сейчас основной причиной применения АмВ в качестве препарата второго ряда или препарата резерва является его нефротоксичность и высокая частота инфузионных реакций. Липосомальные формы амфотерицина В, в частности липидный комплекс АмВ, липосомальный АмВ и коллоидная дисперсия АмВ, не имеют нежелательных реакций такого рода.
В статье, опубликованной в журнале Clinical Infectious Diseases, Ostrosky-Zeichner L. и соавт. попытались обосновать точку зрения о том, что липосомальные формы амфотерицина В ничем не уступают по своей эффективности и превосходят по своей переносимости обычный амфотерицин В, в связи с чем есть основания рекомендовать данные формы препарата в качестве препаратов выбора для большинства системных грибковых инфекций.
В исследованиях in vitro в отношении криптококка, грибов рода Candida и некоторых мицелиальных грибов были показаны более высокие показатели МПК и минимальной фунгицидной концентрации для всех липосомальных форм амфотерицина В. Однако данный факт можно связать с более трудным высвобождением активного препарата из липидных молекул, что направлено, в первую очередь, на фармакокинетические превращения препарата в организме, в связи с чем данные, полученные in vitro, трудно сопоставить с показателями клинической эффективности. Это обуславливает необходимость поиска новых путей определения активности in vitro липосомальных форм амфотерицина В в отношении различных видов грибов.
В настоящее время проведено достаточное количество многоцентровых сравнительных рандомизированных клинических исследований, позволяющих с уверенностью говорить, по крайней мере, об эквивалентной эффективности липосомальных форм амфотерицина В по сравнению с обычной формой препарата, в первую очередь, в плане выживаемости пациентов. Некоторые исследования продемонстрировали значительно более быстрый ответ на терапию липосомальными формами, в частности, при криптококковом менингите (Leenders и соавт.). Наиболее показательным исследованием можно считать многоцентровое двойное слепое рандомизированное исследование, проведенное Walsh и соавт. В нем сравнивался обычный и липосомальный амфотерицин В при лечении пациентов с нейтропенической лихорадкой. В итоге оба препарата показали одинаково хорошую эффективность, но использование липосомального амфотерицина В сопровождалось меньшим числом нежелательных лекарственных реакций. При сравнительном исследовании обычного амфотерицина В и его коллоидной дисперсии при инвазивном аспергиллезе (Bowden и соавт.) оба препарата продемонстрировали одинаковую клиническую эффективность, однако частота развития нефротоксичного действия при использовании коллоидной дисперсии амфотерицина В была в 3 раза реже (12% vs 38%).
Таким образом, липосомальные формы амфотерицина В в настоящее время вполне могут рассматриваться как препараты выбора для терапии системных грибковых инфекций с возможностью использования широкого диапазона дозировок от 3 мг/кг/сут при инфекциях Candida spp., до 6 мг/кг/сут при криптококкозе или микозах, вызванных мицелиальными грибами. Они должны полностью заменить обычный амфотерицин В в тех случаях, когда его использование опасно в силу высокого риска развития у пациента нефротоксичности или инфузионных реакций. Однако для выбора оптимальной липосомальной формы АмВ и наиболее подходящего режима дозирования при различных формах инвазивных грибковых инфекций потребуется проведение дальнейших клинических исследований.
5.4 Липосомы в дерматологии
Проблема проницаемости кожи весьма выпукло предстает перед нами при обсуждении липосомальных кремовых композиций. Липосомальная частица классическом варианте представляет собой сферическую структуру
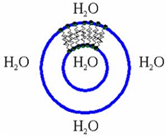
Небольшой объем водного раствора, содержащего вещество А, отделен от окружающей среды бислойной липидной мембраной, состоящей из соевого или яичного лецитина с включением других липидов - фосфатидилсерина, фосфатидилэтаноламина, холестерина и т. д. Молекулы лецитина и других фосфолипидов имеют полярную "головку", обладающую высокой гидрофильностью (сродство к воде), и липофильные фрагменты жирных кислот (липофильный "хвост"). Полярные "головки" молекул фосфолипидов внутреннего слоя мембраны регулярным образом направлены в сторону внутреннего водного раствора, в то время как липофильные "хвосты" наружного и внутреннего слоев бислойной мембраны взаимодействуют друг с другом (подобное растворяется в подобном).
Липосомальные формы препаратов создаются специально для доставки биологически активных веществ к клеточным системам организма. Допустим, какой-нибудь медицинский препарат пептидной природы при введении в кровеносную систему не успевает достичь мелких капилляров, то есть претерпевает превращение под действием ферментов крови (например, протеаз). Или, например, каким образом сохранить (доставить в кровь) такой препарат как интерферон, являющийся пептидом, при его введении через желудочно-кишечный тракт? Поэтому возникла оригинальная идея - защитить медицинский препарат двуслойной липидной мембраной. Таким образом, основное действующее начало липосомальных препаратов должно содержаться внутри липосомы (в водном растворе). Такая липосомальная частица, мигрируя по кровеносному руслу или попадая в желудок человека и испытывая на себе действие желудочного сока и ферментов, может быть, даже постепенно "раздеваясь" и теряя бислойную мембрану, увеличивает время жизни медицинского препарата и повышает вероятность его доставки к клеточным системам организма.
Можно себе представить также ситуацию, когда липосомальный фрагмент, завершив путь по кровеносному руслу, в конечной капиллярной петле вытекает вместе с плазмой крови в межклеточную жидкость и соприкасается с клеточной мембраной. Так как двухслойная мембрана липосомальной частицы имеет сродство (аналогична) клеточной мембране, то может произойти их слияние и внутреннее содержание липосомы как бы впрыскивается внутрь клеток.
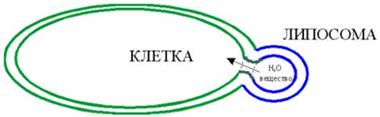
Стилизованное изображение слияния липосомальной частицы с клеткой
Естественно, что результатом взаимодействия липосомальной частицы с клеткой будет не только процесс слияния. Рассматриваются и другие возможные варианты взаимодействия: адсорбция на клеточной поверхности, обмен липидов с
8-09-2015, 20:13
