Достоверно установлена практическая необходимость использования липосомальных форм медицинских препаратов. В качестве примера можно привести запатентованную сотрудниками Государственного научного центра вирусологии и биотехнологии "Вектор" липосомальную форму препарата "Реаферон", позволяющую вводить этот генно-инженерный аналог интерферона в организм человека перорально без заметного снижения активности.
В отличие от медицинских косметические препараты наносятся только на поверхность кожи, и поэтому важнейшим вопросом является способность липосомальных частиц преодолевать трансэпидермальный барьер. Современная технология производства липосом позволяет получать частицы с размерами не ниже 100 нм. Обычно размеры липосом колеблются от 200 до 600 нм. Однако эти значения в десятки раз превышают размеры вирусов, в том числе и оболочечных, окруженных липидной мембраной, не способных проникать через неповрежденную кожу (см. выше). Поэтому трудно представить себе механизм преодоления гигантской липосомальной частицей микрокапилляров рогового и блестящего слоев эпидермиса. Разработчики липосомальных косметических препаратов полагают, что липосомальная частица обладает способностью деформировать свою структуру в процессе преодоления микрокапилляров (см. рис.15).
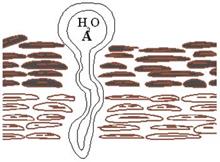
Рис15. Схематическое изображение "способности" липосомальной частицы деформировать структуру в процессе преодоления микрокапилляра
Попробуем оценить вероятность такого события. Предположим, что исходная липосомальная частица (Лисх) имеет средний диаметр около 400 нм. Объем частицы сферы при этом составит
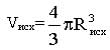
примерно 33,5·106 нм3. После деформации частицы за счет размещения её в микрокапилляре объем деформированной частицы цилиндра может быть выражен в соответствии с формулой
![]()
,где Rдеф является радиусом отверстия микрокапилляра, а L - длина цилиндра. Так как мы исходим из предположения о том, что липосомальная частица при внедрении в микрокапилляр не разрушается, то Vисх=Vдеф. Отсюда
![]()
Принимаем, что радиус микрокапилляра составляет примерно 5 нм, тогда
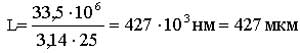
Полученное значение более чем в 20 раз превышает толщину рогового слоя и примерно в десять раз - суммарную толщину рогового и блестящего слоев эпидермиса. Это означает, что, извиваясь в виде своеобразного "червячка" (повторяя изгибы микрокапилляров), деформированная липосомальная частица (Лдеф) должна заполнить смежные микрокапилляры рогового и блестящего слоев и, при этом, часть липосомального фрагмента или останется на поверхности кожи, или проникнет в зернистый, шиповидный слои эпидермиса и далее. У нас нет фактов, которые могли бы подтвердить или опровергнуть возможность реализации такого механизма преодоления трансэпидермального барьера. Отметим, однако, что для его реализации требуется, чтобы бислойная липидная мембрана липосомы имела высокую эластичность и прочность.
Аналогичным образом рассмотрим вероятность размещения Лдеф в микрокапилляре, имеющем радиус около 5 нм с учетом толщины удлиненной частицы. Если диаметр Лдеф равен диаметру микрокапилляра с ориентировочным значением 10 нм, то на этом расстоянии необходимо разместить две бислойные липидные мембраны и при этом между ними должен остаться промежуток для размещения внутрилипосомального водного раствора и для предотвращения слипания мембран, которое, в принципе, может вести к дроблению липосомальной частицы на более мелкие фрагменты. Принимая во внимание, что фосфолипиды, образующие бислойные мембраны, имеют длинноцепочечные жирнокислотные "хвосты", состоящие из 16-22 метиленовых (СН2) фрагментов, можно ориентировочно оценить толщину бислойной мембраны. Учитывая то обстоятельство, что длина ординарной связи С-С составляет примерно 1,54 A (или 0,15 нм), а двойной связи С=С - примерно 1,42 A (или 0,14 нм) и углы между атомами углерода в жирнокислотном фрагменте равняются 109° (для насыщенных связей) и 120° (для ненасыщенных связей), толщина бислойной мембраны составит около 5-6 нм. Следует отметить условности такого рода расчетов, так как, например, ранее при обсуждении строения чешуек рогового слоя приводилась толщина однослойной мембраны, равная 12-15 нм. А ведь нам необходимо разместить в микрокапилляре с диаметром около 10 нм две такие бислойные мембраны и сохранить пространство для размещения внутрилипосомального водного раствора. Эти достаточно простые арифметические расчеты, которые, конечно, грешат некоторой неточностью, указывают, тем не менее, на возможные затруднения в объяснении механизма преодоления трансэпидермального барьера липосомальными частицами. Не затрагивая деталей этого механизма, связанных с возможностью деформации бислойной мембраны по толщине под внешним воздействием, а также экспериментально установленный факт слияния двух липидных мембран при их сближении, можно сформулировать парадокс, связанный с механизмом транспорта липосом через неповрежденную кожу.
В дискуссиях об "особом статусе" липосомальных косметических препаратов часто возникает вопрос о том, почему они нашли такое широкое распространение и почему очень известные и, несомненно, уважаемые косметологические фирмы считают своими долгом выпускать такого рода косметику
В водных системах, содержащих вещества, способные образовывать липидные мембраны, возможно два варианта ассоциации этих веществ. Один вариант связан с образованием "истинных" липосом Другой вариант ассоциации липидов в водной системе может быть связан с образованием, так называемых, наносом (nanosomes, niosomes и т.д.), которые представляют собой мельчайшие сферы, состоящие из липидов, не имеющие, в отличие от липосом, внутреннего водного резервуара и отделенные от внешней водной среды монослойной липидной мембраной Образование таких частиц, по-видимому, является энергетически оправданным, так как необходимость структурирования (снижения энтропии системы) проявляется только в организации поверхностного ламинарного монослоя, в то время как внутренние молекулы, содержащиеся в сфере, располагаются хаотично.
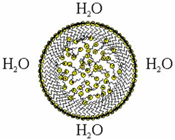
Схематическое изображение наночастицы (наносомы)
Можно полагать, что наночастицы образуются при интенсивном физическом воздействии на липосомальные структуры (например, с помощью ультразвука) и что вероятность их образование увеличивается при увеличении относительного содержания липидов (жиров) в исходной системе, предназначенной для получения везикул (пузырьков) и/или липидных сфер. На рисунке схематично представлен предполагаемый постадийный процесс образования липосом и наночастиц.
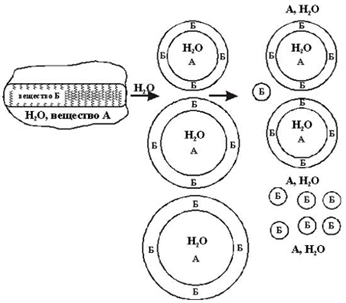
Возможная схема образования липосом и наночастиц в процессе обработки липидно-водных систем ультразвуком
Принимая такую схему, учитывающую то обстоятельство, что наночастицы могут образовываться при разрушении липосомальных частиц, а также приведенные выше рассуждения о возможных размерах липосомальных фрагментов следует предположить, что диаметр наночастиц может быть принципиально более низким.
Часто разработчики косметических препаратов объединяют липосомы и наночастицы под одним обозначением - "везикулы". Так в патенте фирмы Л`Ореаль [24] говорится о том, что везикулы обычно имеют средний диаметр между 10 и 5000 нм. Однако нам неизвестны случаи строгого доказательства того, что липосомы (собственно "везикулы" - пузырьки) имели бы размеры меньше 100 нм (обычно их диаметр не ниже 300 нм). А вот липидные сферы (наночастицы) могут иметь диаметр около 10 нм.
Основная суть цитируемого патента заключается в том, что авторы получают либо одновременно, либо в отдельности два вида частиц. Первая категория - это липосомы, предназначенные для доставки активного агента в глубокие слои кожи, а вторая категория - липосомы для доставки в поверхностные слои кожи. Для обеих категорий препаратов были определены следующие сравнительные характеристики:
- глубина проникновения активного агента;
- потенциал инкапсуляции.
Глубина проникновения активного агента определялась посредством использования органического вещества, которое находилось в свободно-радикальном состоянии и его присутствие в тех или иных слоях кожи (ухо свиньи) определялось с помощью известного метода электронного парамагнитного резонанса. Следует заметить, что вещество (N-(1-оксил-2,2,6,6-тетраметил-4-пиперидил)-N,N-диметил-N-гидроксиэтиламмоний иодид), обладало амфотерными свойствами, то есть имело сродство к полярным молекулам, например, к воде, а наличие углеводородного цикла с четырьмя метильными фрагментами могло определять его сродство к липидам. Кроме этого, биофизические исследования свидетельствуют, что чем меньше диаметр сферы, верхний слой которой образован из регулярно расположенных полярных групп, тем прочнее образующиеся в процессе сольватации на поверхности сферы ионные пары и, наоборот, для больших сфер прочность связывания полярных молекул (ионов) с поверхностью снижается.
Поэтому установленная авторами разработки предельная величина константы диффузии (>1·10-7cм2с-1) может относиться к новому состоянию системы, включающему большое количество липидных сфер (наночастиц). Такие частицы, вне всякого сомнения, более подвижны по сравнению с липосомами и их проникающая способность достаточно высока, что и фиксируется экспериментами с меткой, которая, как уже отмечалось выше, с одной стороны, обладает определенной липофильностью, а с другой стороны, способна образовывать достаточно прочную (ионную и/или водородную) связь с поверхностью сферы.
Остается объяснить приводимые авторами данные по инкапсулированию глюкозы. Степень инкапсулирования измеряется количеством раствора глюкозы, инкапсулированного в "везикулах" (это могут быть как липидные сферы, так и липосомы), измеряемого в мкл на единицу веса липидов, составляющих мембрану (или входящих в состав сфер). Ее определяют немедленно после отделения свободной глюкозы (не вошедшей в капсулы), а также спустя 24 часа после отделения. Разность между этими двумя последовательными измерениями иллюстрирует проницаемость (а скорее стабильность) капсул и может считаться их потенциалом инкапсулирования (или потенциалом стабильности). Естественно, что и абсолютные величины степени инкапсулирования (хотя при этом нужны точные данные по исходной концентрации глюкозы в обоих экспериментах), и потенциалы инкапсулирования (или потенциал стабильности для капсул малого размера) оказались более высокими, чем для капсул большего размера. А теперь рассмотрим сродство молекул глюкозы к ингредиентам, входящим в состав капсул, используемым разработчиками фирмы Л`Ореаль. В патенте представлены десять вариантов везикул, доставляющих активный агент в глубокие слои кожи (авторы называют их липосомами). В их составах содержатся триглицерилцетиловый эфир, смесь монотриглицерин-, ди- и трицетиловых эфиров, холестерин, сорбитана пальмитат, ПЭГ 8 стеарат, ПЭО5 фитостерола, дистеарат полиоксиэтилен(20)метилглюкозы, диглицерилдистеарат, моно- и дистеараты сахарозы, тетреглицерилтристеарат. Простое перечисление этих ингредиентов, даже для неподготовленного читателя, позволяет сделать вывод о том, что глюкоза, являющаяся многоатомным спиртом (полиолом) имеет высокую степень сродства с указанными ингредиентами, содержащими большое число гидроксильных групп. В отличие от этого, основной "липидной" составляющей везикул второй группы является лецитин, концентрация которого варьирует от 100 до 20% или димиристилфосфат (95%). Эти вещества, способные образовывать бислойные липидные мембраны, образуют липосомы. При этом местом локализации глюкозы может являться внутренний водный резервуар липосомы, а также ее поверхность, с полярными группами которой возможно образование нестабильных водородных связей.
Таким образом, приведенные авторами работы [24] результаты исследований не могут опровергнуть предположение о том, что в случае препаратов, способных доставить вещество в глубокие слои кожи, они имели дело с наночастицами, в структуру которых и встраивалось активное вещество (будь это радикальная метка или глюкоза). В другом варианте они имели дело с весьма нестабильными липосомальными образованиями, не способными доставить свое содержимое в нижние слои кожи.
Итак, это наночастицы - и не просто наночастицы, а системы, содержащие вещества, способствующие повышению проницаемости кожи или так называемые энхансеры. И, если внимательно взглянуть на текст патента [24], то, вообще-то говоря, вы не найдете здесь доводов в пользу того, что авторы в случае высокоэффективных препаратов имели дело действительно с наночастицами, а не с обычной кремовой композицией, содержащей указанные ингредиенты. Вот что говорят об этом сами авторы: "Везикулы первой категории, так называемые везикулы глубокого действия, обычно находятся в жидком состоянии, при комнатной температуре обычно находятся в состоянии геля"
Выводы
Как известно, липиды — гидрофобные соединения, то есть соединения, отталкивающие от себя молекулы воды; они являются одним из основных компонентов биологических клеточных мембран, создающих в организме энергетический резерв, а также способных образовывать защитные покровы. Свойства липосом и их поведение определяются прежде всего наличием у них замкнутой мембранной оболочки. Несмотря на молекулярную толщину (около 4 нм), липидный бислой отличается исключительной механической прочностью и гибкостью. Благодаря этому липосомы сохраняют целостность при различных повреждающих воздействиях, а их мембрана обладает способностью к самозалечиванию возникающих в ней структурных дефектов. Кроме того, гибкость бислоя и его текучесть придают липосомам высокую пластичность.
Для практического применения липосом и везикул исключительно важна их способность включать в себя и удерживать вещества различной природы. Круг веществ, включаемых в липосомы, необычайно широк — от неорганических ионов и низкомолекулярных органических соединений до крупных белков и нуклеиновых кислот. Первое применение липосом в научных исследованиях было связано с использованием липосом в качестве транспортного средства для доставки лечебных агентов в живую ткань. В 1971 г. была предпринята попытка замыкания в липосомах ферментов с последующим введением везикул в кровоток для коррекции метаболических нарушений в печени при гликогенозе. В дальнейшем разрабатывались липосомальные формы ряда противоопухолевых препаратов, комплексонов, антибиотиков, гормонов. Б лагодаря наличию в липосомах двухслойных мембран они могут использоваться для транспортировки как гидрофильных, так и гидрофобных лекарственных веществ. Липосомы малотоксичны и легко подвергаются биодеградации в отличие от полимерных систем с контролируемой доставкой лекарственных средств.
В настоящее время липосомальная терапия — одно из наиболее активно развивающихся направлений в фармакологии и медицине. Способность липосом включать в себя самые разные вещества практически без каких-либо ограничений в отношении их химической природы, свойств и размера молекул дает поистине уникальные возможности для решения некоторых медицинских проблем. Так, многие лекарственные препараты имеют низкий терапевтический индекс. Это означает, что концентрация, в которой они оказывают лечебное действие, мало отличается от концентрации, при которой препарат становится токсичным. В других случаях лекарственный препарат при введении в организм может быстро терять активность. Включение таких препаратов в липосомы может значительно повысить их терапевтическую эффективность, поскольку, с одной стороны, препарат, находящийся в липосоме, защищен ее мембраной от действия неблагоприятных факторов, а с другой — та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Липосома в данном случае выполняет роль хранилища, из которого препарат высвобождается постепенно, в нужных дозах и в течение требуемого промежутка времени.
С точки зрения биологической совместимости липосомы идеальны как переносчики лекарственных препаратов. Они изготавливаются из природных липидов и поэтому нетоксичны, не вызывают нежелательных иммунных реакций и биодеградируемы, то есть должны разрушаться под действием обычных ферментов, присутствующих в организме.
В настоящее время большие возможности открываются в отношении активного «адресования» липосомальных форм лекарственных веществ органу-мишени с помощью различных, в том числе физических воздействий — тепло, ионизация и т.д. Уникальной особенностью липосом является возможность доставки лекарственных препаратов внутрь клеток, с которыми они взаимодействуют путем слияния или эндоцитоза. Модифицируя мембрану липосом молекулами, обеспечивающими «узнавание» клетки или органа-мишени, можно осуществлять направленную транспортировку лекарств. Это обусловливает использование липосомальных форм препаратов для лечения внутриклеточного паразитизма (липоидный ретикулоз, кожный лейшманиоз). Очевидна перспективность применения липосомальных форм антипаразитарных препаратов также для лечения малярии и токсоплазмоза. Актуальной представляется и проблема инкапсулирования в липосомах и внутриклеточного введения нуклеиновых кислот.
В ряде лабораторий получены удовлетворительные результаты по включению нативной ДНК или РНК в липосомы, разработаны липосомальные формы противоопухолевых препаратов, таких как метотрексат, доксорубицин, винкристин, винбластин, актиномицин, L-аспарагиназа, противогрибкового препарата амфотерицин В, ряда пептидов, полиеновых антибиотиков, противовоспалительных кортикостероидных препаратов — кортизона, гидрокортизона, дексаметазона; бычьего инсулина и некоторых других препаратов.
Литература
1. Gregoriadis. G. (1995) TIBECH. 13, 527-537.
2. Yurasov V.V., Kucheryanu V.G.,. Kryzhanovsky G.N,. et al. (1996) Progress in Drug Delivery Systems. Biomedical Research Foundation, Tokyo. Eds. Sadao Hirota, 5, 171-174.
3. Kucheryanu V.G., Yurasov V.V., Kryzhanovsky G.N., et al. (1996) Progress in Drug Delivery Systems. Biomedical Research Foundation, Tokyo, Eds. Sadao Hirota, 5, 179-182.
4. Юрасов В.В., Подгорный Г.Н., Кучеряну В.Г., и др. (1996) Бюллетень эксперим. биол. мед., 122, 614-617.
5. Юрасов В.В., Кучеряну В.Г., Кудрин В.С., и др. (1997) Бюллетень эксперим. биол. мед., 123, 150-153.
6. Maeda H., Matsumura Y. (1989) Crit. Rev. Ther. Drug Carrier Syst., 6, 193-210.
7. Seymour L.V. (1992) Crit. Rev. Ther. Drug Carrier Syst. 6, 135-187.
8. Jain R.K. (1987) Cancer Metastasis Rev. 6, 559-593.
9. Huang S.K., Mayhew E., Lasic D.D., et al. (1992) Cancer Res. 52, 6774-6781.
10. Дранов А.Л., Дудниченко А.С., Бутенко К.А., Краснопольский Ю.М. (1994) Вестн. фармации, №3-4, С. 88-92.
11. Дранов А.Л., Дудниченко А.С., Мезин И.А., и др. (1996) Бюлл. экспер. биол. мед., № 8, 85-89.
12. Дудниченко А.С., Краснопольский Ю.М. (1996) Бюлл. экспер. биол. 18, 125-129.
13. Дудниченко А.С., Краснопольский Ю.М. (1996) Бюлл. экспер. биол. 18, 392-396.
14. Janoff A.S. (1992) Lab. Invest. 66, 655-658.
15. Gabizon A., Catane R., Uziely B., et al. (1994) Cancer Res. 54, 987 992.
16. Gill P.S., Espina B.M., Muggia F., et al. (1995) J. Clin. Oncol. 13, 996-1003.
17. Forssen E.A., Ross M.E. (1994) J. Lipisomes Res. 4, 481-512.
18. Northfelt D.W., Kaplan L., Russell J., et al. (1995) in Stealth Liposomes (Lasic D.D., Martin F.J., eds). 257-266. CRC Press.
19. Bogner J. R., Goebl F-D. (1995) in Stealth Liposomes (Lasic D.D., Martin F.J., eds). CRC Press. 267-278.
20. Blum G., Cevc G. (1990) Biochim. Biophys. Acta, 1029, 91-97.
21. Klibanov A.L., Maruyama K., Torchilin V.V., Huang L. (1990) FEBS Letters., 268, 235-237.
22. Senior J., Delgado C., Fisher D., et al. (1991) Biochim. Biophys. Acta. 1062, 77-82.
23. Papahadjopouluos D., Allen T.M., Gabizon A., et al. (1991) Proc. Natl. Acad. Sci. USA. 88, 11460-11464.
24. Allen T.M., Hansen C. (1991) Biochim. Biophys. Acta. 1068, 133-141.
25. Torchilin V.P., Omelyanenko V.G., Papisov M.I., et al. (1994) Biochim. Biophys. Acta, 1195, 11-20.
26. Torchilin V.P., Shtilman M.I., Trubetskoy V.S.,
8-09-2015, 20:13
