1. Основные этапы развития биотехнологии. Характеристика эры антибиотиков.
Биотехнология – это область научных исследований, с появлением которой произошел настоящий переворот во взаимоотношениях человека с живой природой. В ее основе лежит перенос единиц наследственности (генов) из одного организма в другой, осуществляемый методами генной инженерии (технология рекомбинантных ДНК). В большинстве случаев целью такого переноса является создание нового продукта или получение уже известного продукта в промышленных масштабах[1] .
Действительно, она включает на первый взгляд, совершенно не связанные между собой разделы научных знаний: микробиологию, анатомию растений и животных, биохимию, иммунологию, клеточную биологию, физиологию растений и животных, различные систематики, экологию, генетику, биофизику, математику и много других областей естествознания.
Постоянно увеличивающееся разнообразие современной биологии началось после окончания второй мировой войны, когда в биологию внедрились другие естественнонаучные дисциплины, такие как физика, химия и математика, которые сделали возможным описание жизненных процессов на новом качественном уровне - на уровне клетки и молекулярных взаимодействий.
Именно существенные успехи в фундаментальных исследованиях в области биохимии, молекулярной генетики и молекулярной биологии, достигнутые во второй половине текущего столетия, создали реальные предпосылки управления различными (пусть, возможно, и не самыми главными) механизмами жизнедеятельности клетки. Сложившаяся благоприятная ситуация в биологии явилась мощным толчком в развитии современной биотехнологии, весьма важной области практического приложения результатов фундаментальных наук. Можно с уверенностью утверждать, что биотехнология является наиболее разительным примером того, как результаты, казалось бы "чистой науки", находят применение в практической деятельности человека. Основой, обеспечивающей благоприятную ситуацию для бурного развития биотехнологии, явились революционные открытия и разработки:
Доказательства роли нуклеиновых кислот в хранении и передаче наследственной информации в биологических системах (имеются в виду индивидуальные клетки и отдельные организмы, а не их популяции);
Расшифровка универсального для всех живых организмов генетического кода;
Раскрытие механизмов регуляции функционирования генов в процессе жизни одного поколения организмов;
Совершенствование существовавших и разработка новых технологий культивирования микроорганизмов, клеток растений и животных; как логическое следствие из вышесказанного, явилось создание (возникновение) и бурное развитие методов генетической и клеточной инженерии, с помощью которых искусственно создаются новые высокопродуктивные формы организмов, пригодные для использования в промышленных масштабах.
Расшифровка генома человека.
Абсолютно новым направлением является так называемая инженерная энзимология, возникшая вследствие развития современных методов изучения структуры и синтеза белков-ферментов и выяснения механизмов функционирования и регуляции активности этих соединений (важных элементов клетки). Достижения в этой области позволяют направленно модифицировать белки различной сложности и специфичности функционирования, разрабатывать создание мощных катализаторов промышленно ценных реакций с помощью высоко стабилизированных иммобилизованных ферментов.
Все эти достижения вывели биотехнологию на новый уровень ее развития, позволяющий сознательно и целенаправленно управлять сложными клеточными процессами. Данная новая область биологических знаний и ее последние достижения уже стали крайне важными для здоровья и благополучия человека.
И все же, что ожидает биотехнологию в случае реализации всех надежд, которые на нее возлагаются? И, наконец, что же такое биотехнология и каковы ее направления деятельности?
Термин "биотехнология" был введен в 1917 г. венгерским инженером Карлом Эреки при описании процесса крупномасштабного выращивания свиней с использованием в качестве корма сахарной свеклы. По определению Эреки, биотехнология – это "все виды работ, при которых из сырьевых материалов с помощью живых организмов производятся те или иные продукты".
Биотехнология на самом деле не что иное, как название, данное набору технических приемов (подходов) и процессов, основанных на использовании для этих целей биологических объектов.
Термин биотехнология включает составляющие "биос ", "техне ", "логос " греческого происхождения (от греч. "биос " – жизнь, "техне " – искусство, мастерство, умение и "логос " – понятие, учение)[2] .
Биотехнологические направления имеют своей целью создание и практическое внедрение (т. е. практическое использование) активных веществ и лекарственных препаратов, кормовых добавок, средств защиты и т.д. Однако следует отдавать себе отчет в том, что биотехнология не является чем-то новым, ранее не известным, а представляет собой развитие и расширение набора технологических приемов, корни которых появились тысячи лет тому назад. Биотехнология включает многие традиционные процессы, давно известные и давно используемые человеком. Это пивоварение, хлебопечение, изготовление вина, производство сыра, приготовление многих восточных пряных соусов, а также разнообразные способы утилизации отходов. Во всех перечисленных процессах использовались биологические объекты (пусть даже без достаточных знаний о них), и все эти процессы на протяжении многих лет совершенствовались, правда, эмпирически. Начало этого этапа биотехнологии теряется в глубине веков, и он продолжался примерно до конца XIX в.
Работы великого французского ученого Луи Пастера (1822-1895) заложили фундамент практического использования достижений микробиологии и биохимии в традиционных биотехнологиях (пивоварение, виноделие, производство уксуса) и ознаменовали начало нового, научного периода развития биотехнологии. Для этого периода характерно развитие промышленной биотехнологии, в особенности ферментационных процессов в промышленных масштабах. Были разработаны стерильные процессы производства путем ферментации ацетона, глицерина. Интенсивно изучаются основные группы микроорганизмов – возбудителей процессов брожения, исследуются биохимические особенности данных процессов.
Вторая половина XX-го века является эрой антибиотиков, которые занимают ведущее место в современной химиотерапии бактериальных инфекций и онкологических заболеваний. Использование антибиотиков в медицине способствовало успеху борьбы с тяжелыми инфекциями и в целом прогрессу медицины, демографическим "взрывам" и увеличению продолжительности жизни.
Создание антибактериальных препаратов является одним из наиболее важных достижений ХХ века. Пенициллин, синтезированный более 60 лет назад, открыл новую эру в борьбе с инфекционными болезнями. Сегодня известно около 20 групп антибиотиков, которые продаются под 1000 торговых наименований. Без них невозможно представить себе современную медицину, благодаря им спасены миллионы человеческих жизней. Эволюция создания антибактериальных препаратов во многом отражает уровень развития общества, возможности научно технического прогресса.
Что такое антибиотики? Это вещества, избирательно подавляющие жизнедеятельность микробов. Антибактериальные средства подразделяют на природные, являющиеся продуктами жизнедеятельности микроорганизмов, и получаемые искусственным путем в результате химического синтеза, – так называемые полусинтетические. Как следует из определения, антибиотики активны только в отношении микроорганизмов и грибов. Они не действуют на вирусы. Антибиотик и микроорганизм – это две противоборствующие силы. Изобретатели антибиотиков каждый раз придумывают все более изощренные методы уничтожения микробов, а микробы, эволюционируя, создают порой уникальные, абсолютно непостижимые механизмы защиты. Пенициллины, цефалоспорины поражают микробы, нарушая синтез клеточной стенки микроорганизмов. Макролиды, тетрациклины, линкозамиды ингибируют синтез белка в рибосомах микроорганизмов. Хинолоны, фторхинолоны дезорганизуют репликацию ДНК микробной клетки, а нитрофураны - синтез ДНК. Микроорганизмы, защищаясь, способны вырабатывать ферменты, разрушающие антибиотик. Они укрепляют, по сути, «замуровывают» клеточную стенку, и антибиотик не может проникнуть внутрь. Есть микроорганизмы, которые создали нечто подобное насосу и «выкачивают» проникший в них антибиотик. А «полем боя» является человеческий организм, который реагирует и на микроб, и на антибиотик, и на их противостояние[3] .
Реакция организма зависит как от его индивидуальных особенностей (иммунитета, способности метаболизировать продукты обмена, устойчивости центральной и вегетативной нервной систем), так и от характеристики микроба, его инвазивности – умения преодолевать защитные барьеры и диссеминироваться в организме, патогенности – способности вызывать болезнь. Таким образом, лечение инфекционного заболевания антибиотиками – сложная задача, и, решая ее, нужно с большой ответственностью подходить к выбору антибактериальных препаратов.
В настоящее время, приступая к созданию антибиотика, ученые ставят перед собой задачу: создать продукт, влияние которого будет распространяться на максимально большой пласт различных патогенов. Однако в почете те антибактериальные средства, которые, действуя на многие патогены, в отношении некоторых из них все же более агрессивны. Например, разработаны препараты, избирательно действующие на резистентные, устойчивые микроорганизмы, но при этом они уничтожают и другие патогены.
2. Ферментация – главная стадия любого биотехнологического процесса. Глубинная и поверхностная ферментация.
Процесс культивации микроорганизмов – ферментация – начинается с того момента, когда заранее подготовленный посевной материал вводится в реактор. Размножение культуры микроорганизма характеризуется четырьмя временными фазами[4] : лаг-фаза; экспоненциальная; стационарная; вымирание.
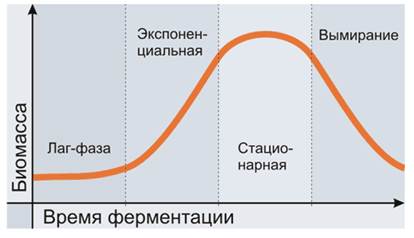
Во время лаг-фазы метаболизм клеток направлен на то, чтобы синтезировать ферменты для размножения в конкретной среде. Длительность лаг-фазы может быть разной для одной и той же культуры и среды, так как на неё влияет множество факторов. Например, сколько в посевном материале было нерастущих клеток.
Экспоненциальная фаза – это период роста, когда происходит деление клеток с экспоненциальным ростом численности популяции. Этот период ограничен во времени количеством питательной среды. Питательные вещества кончаются или рост клеток замедляется из-за выделения токсичного метаболита.
Рост прекращается и наступает так называемая стационарная фаза. Метаболизм продолжается и может начаться выделение вторичных метаболитов. Во многих случаях целью является получение не биомассы, а именно вторичных метаболитов, так как они могут использоваться для получения ценных продуктов и препаратов. В этих случаях ферментация целенаправленно удерживается в стационарной фазе.
Если продолжать фермениацию дальше, клетки постепенно будут терять активность, т.е. вымирать.
По характеру подкормки процессы культивирования бывают трёх видов:
периодический;
подкормочный;
непрерывный.

В периодическом процессе реактор заполняется свежей питательной средой, потом в него вводится посевной материал. По окончании ферментации содержимое выводится на стадию выделения, реактор моется и стерилизуется, и всё начинается снова.
В подкормочном процессе непрерывно или порциями в реактор вводится свежая питательная среда. Скорость ввода обычно определяется скоростью роста или биосинтеза. Когда реактор наполняется, его частично или полностью опорожняют. Процесс завершается или продолжается.
В непрерывном процессе культивационная жидкость выводится из реактора непрерывно. Такой процесс может протекать очень долго, и его длительность обычно определяется производственной необходимостью и техническими факторами.
Наиболее распространена ферментация с подкармливанием, её чаще всего применяют для биопродуктов. В этом случае устраняются недостатки периодического процесса путём небольших технических изменений.
Непрерывные процессы чаще всего применяются при производстве биохимикатов в больших количествах. Эти процессы самые экономичные, но для их реализации нужны значительные технические преобразования и более глубокое понимание кинетики данной ферментации.
Стадия ферментации является основной стадией в биотехнологическом процессе, так как в ее ходе происходит взаимодействие продуцента с субстратом и образование целевых продуктов (биомасс, эндо- и экзопродуктов). Эта стадия осуществляется в биохимическом реакторе (ферментере) и может быть организована в зависимости от особенностей используемого продуцента и требований к типу и качеству конечного продукта различными способами. Ферментация может проходить в строго асептических условиях и без соблюдения правил стерильности (так называемая «незащищенная» ферментация); на жидких и на твердых средах; анаэробно и аэробно. Аэробная ферментация, в свою очередь, может протекать поверхностно или глубинно (во всей толще питательной среды).
Глубинная ферментация проводится в аппаратах емкостью 50 м3 с заполнением на 70–75 %. В качестве посевного материала используют мицелий, подрощенный также в условиях глубинной культуры. В производственном аппарате, куда подрощенный мицелий передается по стерильной посевной линии, питательная среда содержит 12–15 % сахаров. Ферментацию проводят при 31–32° при непрерывном перемешивании. В ходе процесса кислотообразования (5–7 суток) реализуют интенсивный режим аэрации (до 800–1000 м3/ч) с дробным добавлением сахаров, 2–3 подкормки. Выход лимонной кислоты составляет от 5 до 12 %, остаточная концентрация сахаров – 0.2–1.5 %, доля цитрата – 80–98 % от суммы всех органических кислот.
Получить производные антибиотиков можно с помощью как химического, так и биологического синтеза. Известен и комбинированный способ получения препаратов. В этом случае ядро молекулы антибиотика формируется при биосинтезе с помощью соответствующих микроорганизмов-продуцентов, а «достройка» молекулы осуществляется методом химического синтеза. Полученные этим способом антибиотики называются полусинтетическими. Так были получены и нашли широкое применение в клинике весьма эффективные полусинтетические пенициллины (метициллин, оксациллин, ампициллин, карбенициллин) и цефалоспорины (цефалотин, цефалоридин) с новыми по сравнению с природными антибиотиками ценными терапевтическими свойствами.
Все эти данные, накопленные в процессе становления и развития науки об антибиотиках, потребовали уточнения термина «антибиотики». В настоящее время антибиотиками следует называть химические соединения, образуемые различными микроорганизмами в процессе их жизнедеятельности, а также производные этих соединений, обладающие способностью в незначительных концентрациях избирательно подавлять рост микроорганизмов или вызывать их гибель. Вполне вероятно, что и эта формулировка с дальнейшим прогрессом антибиотической науки будет уточняться.
В первые годы после открытия антибиотиков их получали с использованием метода поверхностной ферментации. Этот метод заключался в том, что продуцент выращивали на поверхности питательной среды в плоских бутылях (матрацах). Чтобы получить сколько-нибудь заметные количества антибиотика, требовались тысячи матрацев, каждый из которых после слива культуралыюй жидкости необходимо было мыть, стерилизовать, заполнять свежей средой, засевать продуцентом и инкубировать в термостатах. Малопроизводительный способ поверхностной ферментации (поверхностного биосинтеза) не мог удовлетворить потребностей в антибиотиках. В связи с этим был разработан новый высокопроизводительный метод глубинного культивирования (глубинной ферментации) микроорганизмов – продуцентов антибиотиков. Это позволило в короткий срок создать и развить новую отрасль промышленности, выпускающую антибиотики в больших количествах.
Метод глубинного культивирования отличается от предыдущего тем, что микроорганизмы-продуценты выращивают не на поверхности питательной среды, а во всей ее толще. Выращивание продуцентов ведут в специальных чанах (ферментаторах), емкость которых может превышать 50 м3. Ферментаторы снабжены приспособлениями для продувания воздуха через питательную среду и мешалками. Развитие микроорганизмов-продуцентов в ферментаторах происходит при непрерывном перемешивании питательной среды и подаче кислорода (воздуха).
При глубинном выращивании во много раз по сравнению с выращиванием продуцента на поверхности среды увеличивается накопление биомассы (из расчета на единицу объема питательной среды), а значит, и возрастает содержание антибиотика в каждом миллилитре культуральной жидкости, т. е. повышается ее антибиотическая активность.
3.Генетическая инженерия. Ферментный синтез генов на основе изолированной матричной РНК.
Генетическая инженерия – направление исследований в молекулярной биологии и генетике, конечной целью которых является получение с помощью лабораторных приемов организмов с новыми, в т.ч. не встречающимися в природе, комбинациями наследственных свойств[5] .
В основе генетической инженерии лежат достижения молекулярной биологии и прежде всего установление универсальности генетического кода (у всех организмов включение одних и тех же аминокислот в строящуюся полипептидную цепь белка кодируется одними и теми же последовательностями трех нуклеотидов в цепи ДНК). Возможность получения и направленного использования фрагментов нуклеиновых кислот, выделения отдельных участков полинуклеотидной цепи с точностью до одного нуклеотида и осуществления in vitro синтеза нуклеиновых кислот с новыми сочетаниями нуклеотидных звеньев, появилась у генетической инженерии благодаря успехам энзимологии.
Изменение наследственных свойств организма с помощью генетической инженерии состоит в конструировании из различных фрагментов ДНК нового генетического материала, введении этого материала в организм реципиента, создании условий для функционирования введенного генетического материала и его стабильного наследования. Гены или фрагменты ДНК могут быть получены путем химического синтеза. Однако этот процесс трудоемок и требует знания последовательности нуклеотидов, составляющих ген. Более эффективен метод синтеза структурного гена на информационной РНК (иРНК) как на матрице с помощью фермента РНК-зависимой ДНК-полимеразы (обратной транскриптазы). Однако структурные гены в организме составляют функциональный комплекс с регуляторными элементами, нуклеотидные последовательности которых не воспроизводятся в молекуле иРНК. Поэтому указанный способ не позволяет осуществить синтез структурной и регуляторной области гена в совокупности, т.е. функционирующего гена в целом.
Методы получения целого функционирующего гена были впервые разработаны на бактериальных клетках. Их основой является способность некоторых плазмид – небольших молекул ДНК, способных реплицироваться независимо от бактериальной хромосомы, – внедряться в хромосому бактериальной клетки, а затем спонтанно или под воздействием индуцирующих агентов, например УФ-излучения, снова переходить в цитоплазму, захватывая при этом прилегающие гены хромосомы клетки-хозяина. В цитоплазме эти гены реплицируются (размножаются) в составе захвативших их плазмид. Фрагмент генетического материала хромосомы бактериальной клетки может быть отделен от плазмиды. Использование плазмид позволяет получать в изолированном виде практически любые бактериальные гены.
Успеху генетической инженерии способствовала разработка техники объединения генов, выделенных из различных источников, в одну молекулу ДНК. Решающим в конструировании таких гибридных, или рекомбинантных, молекул in vitro явилось обнаружение и получение особых ферментов – рестриктаз, которые сейчас служат основным инструментом Г. и. Рестриктаза «разрезает» молекулу ДНК в участке (сайте), строго определенном для каждой конкретной рестриктазы. К середине 80-х гг. XX в. в мировой коллекции рестриктаз насчитывалось более 400 ферментов, «узнающих» около 100 различных по структуре участков в молекулах ДНК. С помощью рестриктаз стало возможным выделение практически любого гена в виде одного или нескольких фрагментов ДНК.
Появилась возможность снабжать синтезированные, «сконструированные» и природные гены различными регуляторными нуклеотидными последовательностями, заменять, вставлять, удалять нуклеотиды в строго заданных участках гена, укорачивать или достраивать его. Для создания гибридных (рекомбинантных) молекул ДНК полученные фрагменты соединяют с ДНК вектора. С этой целью используют фермент, соединяющий фрагменты ДНК. Функциональную полноценность гибридной молекулы ДНК определяют с помощью ее переноса в клетку-реципиент по последующему размножению в ней (амплификации) и функционированию. Перенос чужеродного генетического материала в реципиентные клетки и его размножение в них обеспечивает векторная часть гибридной
29-04-2015, 05:15
