ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Кафедра фармацевтической технологии с курсом биотехнологии
Курсовая работа
по аптечной технологии на тему:
«Биофармацевтическая оценка мягких лекарственных форм»
Уфа - 2008
Содержание
Введение
Определение биодоступности
Биофармацевтические аспекты мазей
Схема структуры кожи человека
Определение степени высвобождения лекарственных веществ
- методы invitro (метод равновесного диализа через полупроницаемую мембрану в модельную среду)
- методы invivo
Факторы, от которых частично или полностью зависит эффективность мази
Совершенствование мазей как лекарственной формы
- ректальные мази
- сухие концентраты мазей
- концентраты на основе бентонитов и других набухающих веществ
- дерматологические пленки
- мазевые карандаши
Трансдермальные терапевтические системы
Глазные терапевтические системы
Выводы
Список литературы.
Введение
Мягкие лекарственные формы (МЛФ) – это мази, пластыри, горчичники, суппозитории, медицинские карандаши, пилюли, желатиновые капсулы. Все они имеют мягкую консистенцию, однако относятся к разным дисперсным системам. Например, мази, пластырные массы, горчичная паста, суппозитории, медицинские карандаши (за исключением ляписных) являются системами с упруговязгопластичной средой. Пилюли же изготавливаются из пластичной массы и подсыхают только при хранении, приобретая твердую консистенцию.
В настоящее время удельный вес МЛФ в рецептуре аптек составляет около 10 – 15 %, так как большинство готовых препаратов этой группы изготавливается фармацевтической промышленностью (в основном это пластыри, горчичники, медицинские карандаши, капсулы и капсулированные лекарства).
Цель и задачи курсовой работы:
1. определить биодоступность МЛФ;
2. подчеркнуть методы исследования высвобождения лекарственных веществ из МЛФ;
3. выделить факторы, определяющие эффективность МЛФ.
Биодоступность лекарственного вещества
Биодоступность лекарственного вещества (ЛВ) - количество достигшего плазмы крови неизменного ЛВ по отношению к количеству исходной дозы. При энтеральном введении биодоступности в связи с потерями вещества меньше, чем при парентеральном введении. За биодоступность в 100% принимают величину препарата в системный кровоток при внутривенном введении.
Различают абсолютную и относительную биодоступности.
Абсолютная биодоступность – это величина, характеризующая долю поглощенного препарата при внесосудистом введинии по отношению к его количеству после внутривеннго ведения препарата.
Относительная биодоступность – это величина, определяющая относительную степень ЛВ из испытуемого препарата по отношению к всасыванию ЛВ из препаратов сравнения.
Сходная биодоступность (биоэквивалентность) – это величина, характеризующая соотношение эффективности различных препаратов, содержащих одно вещество в одной фазе.
Критерием оценки степени влияния отдельных или суммы фармацевтических факторов на активность лекарственного средства является тестомологическая (физиологическая) доступность препаратов. Биологическая доступность фактически характеризует качество лекарства. Мерой биологической доступности (БД) служит отношение (в процентах) количества всасывающегося лекарственного вещества, назначенного в исследуемой лекарственной форме (S), к количеству того же лекарственного вещества, назначенного в той же дозе, но в виде стандартной лекарственной формы (S1). Биологическая доступность может быть определена по следующей формуле:
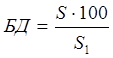 (1 )
(1 )
Биофармацевтические аспекты мазей. Схема структуры кожи человека.
Кожа – сложный орган, который выполняет следующие функции: защитную, терморегуляции, секреторную и потоотделения, всасывания и, и благодаря наличию рецепторов, носителя ощущений. Кожа взрослого человека имеет общую площадь около 1,5 м2 и состоит их трех слоев (рис. 1):
- эпидермис (подкожница);
- собственно кожа (дерма);
- подкожная жировая клетчатка.
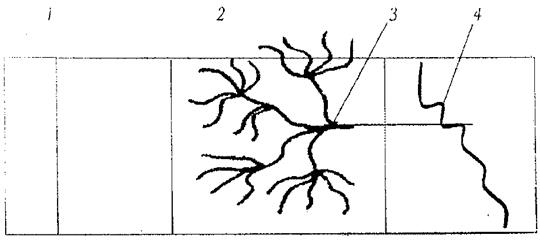
ЭпидермисДерма Подкожная клетчатка
Рис. 1. Схема строения кожи человека:
1- роговой слой; 2 – капиллярный слой; 3 – сеть капилляров; 4 – кровеносный сосуд
Подкожница (эпидермис) состоит из постоянно меняющихся пяти слоев клеток. Представляет собой полупроницаемую мембрану, лишенную кровеносных сосудов.
Наружный слой подкожницы – роговой – состоит из кератинизированных клеток и пронизан протоками потовых и сальных желез, волосяными фолликулами. Эти клетки физиологически пассивны, выполняют защитные функции и представляют собой основной барьер для попадания ЛВ и микроорганизмов в организм человека. Толщина первых двух слоев около 4 мм.
Дерма состоит из эластичных волокон, пронизанных кровеносными, лимфатическими сосудами и нервными окончаниями. В дерму также открываются протоки различных желез (потовых, сальных). Через дерму хорошо всасываются жирорастворимые вещества, которые иногда могут оказывать токсические эффекты (резорцин, цинка сульфат, кислота борная, кислота салициловая, хлороформ).
Подкожная клетчатка состоит из пучков соединительной ткани с зернами подкожного жира (си. рис. 1).
Пути проникновения ЛВ через кожу. Всасывание ЛВ происходит через эпидермис, сальные и потовые железы и волосяные луковицы (рис. 2). Количество всасываемого вещества зависит от площади нанесения мази и толщины кожи. Всасывание может быть усилено интенсивным втиранием мази и зависит от состояния кожи, наличия заболевания и величины рН. У здоровых людей значение рН составляет от 5,5 до 6,5 – 7,0. При воспалительных процессах рН кожи снижается. Количество всасываемого ЛВ увеличивается с повышением рН.

Рис. 2. Пути проникновения лекарственных веществ через кожу:
А – трансдермальный: 1 – межклеточный; 2 – трансцеллюлярный;
Б – через поры: 3 – трансгладулярный (через стенки фолликул и протоки сальных и потовых желез); 4 - трансфолликулярный
Качество мази определяется многими показателями, в том числе способностью мазевых основ высвобождать ЛВ и скоростью всасывания ЛВ. Процесс всасывания складывается из следующих стадий:
- растворение ЛВ в основе;
- диффузия ЛВ в границах нанесения слоя мази;
- проникновение ЛВ в кожу.
Рассчитать количество всосавшегося ЛВ можно по формуле:
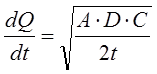 (2)
(2)
где Q – количество всосавшегося вещества за определенное время t; D – константа диффузии; А – концентрация вещества; С – растворимость ЛВ в основе (определяется invitroи invivo).
Зная строение кожи человека, пути и этапы проникновения ЛВ через неё, можно:
- облегчить определение рациональных дозировок ЛВ для использования их в лечебной практике (с помощью экспериментальных данных, полученных методами invitro и invivo);
- ускорить направленный поиск новых препаратов с желаемыми закономерностями распределения в организме, а в некоторых случаях и с более высокой или более широкой активностью;
- обосновать применение фармацевтических факторов в производстве лекарств.
Определение степени высвобождения лекарственных веществ
Этот критерий оценки качества мазей должен стать основным при стандартизации и бракераже мазей. Разработаны методики определения invitroи invivo, имеются данные о большом количестве прописей с разными ЛВ и различными основами.
Методы invitro
Техническое выполнение экспериментов invitro может быть различно и определяется главным образом свойствами включенных препаратов.
Прямая диффузия. В этом случае проба мази должна находиться в непосредственном контакте со средой, в которую диффундирует ЛВ.
Диффузия через мембрану. Суть метода заключается в том, что исследуемая мазь отделена от водной среды полупроницаемой мембраной. Это целлофан или липоидные мембраны животного происхождения, например яичная оболочка, отрезок кишки, кожа животного. Среды для диализа тс же, что и в первом случае, т. с. водные растворы или вода.
Аппаратурное оформление этих исследований может быть различным. В последние годы появилось много установок, максимально приближающих условия опыта к условиям живого организма. Чаще всего это двухкамерные установки, разделенные мембранами или мембранными системами. В одной из камер находится мазь, в другой - среда для диализа. Несмотря на конструктивные различия, установки подчинены одному принципу и отражают одинаковые зависимости.
М – доле равновесного диализа через полупроницаемую мембрану в модельную среду можно изучить влияние:
- природы мазевой основы;
- концентрации ЛВ в мази;
- степени дисперсности ЛВ.
Исследование влияния фармацевтических факторов на высвобождение ЛВ из суспензионных мазей проводят на мазях-моделях, приготовленных на различных основах (вазелин; вазелин 9 частей, ланолин 1 часть, свиной жир; абсорбционная основа ХНИХФИ; эмульсионная основа В/М и М/В и др.) с сульфаниламидными препаратами (стрептоцид, норсульфазол, сульфацил-Na) в различной концентрации (1, 5, 10 %). ЛВ должны быть в двух формах извлечения:
- размер частиц 1 – 10 мкм;
- размер частиц не более 100 – 120 мкм.
Диализная среда подбирается с учетом физико-химических свойств лекарственных препаратов:
- для сульфацила Na – вода;
- для стрептоцида – 0,1 н. HCl
2,0 г. Мази (точная навеска) наносят на целлофановую пленку, которую затем неподвижно укрепляют на конце диализной трубки резинкой-обхваткой.

Рис. 3. Схема устройства для определения скорости высвобождения лекарственного вещества путем диализа через пленку:
1 – трубка для диализа, 2 – целлофановая пленка, 3 – пипетка, 4 - термометр
Опыт проводят в трехкратном повторении на трех навесках мази одного образца.
Определение содержания сульфаниламидных препаратов в диализате. Для количественного определения лекарственного препарата в диализате используют метод ультрафиолетовой спектрофотометрии. Из литературных источников известно, что растворы изучаемых сульфаниламидных препаратов подчиняются закону Бугера-Ламберта-Бера в довольно широком диапазоне концентраций. УФ-спектры СА препаратов имеют максимальные поглощения в области длин волн от 250 до 261 нм.
Определение содержания ЛВ в диализате проводится после проведения соответствующих разведений. 5 ml диализата вносят в мерную колбу вместимостью 25 или 50 мл. и доводят соответствующей диализной средой до метки, перемешивают. Параллельно проводят «слепой опыт» по измерению оптической плотности мазевых основ в УФ-области спектра, где наблюдается максимальное поглощение препаратами. 0,5 г. (точная навеска) мазевой основы в бюксе, осторожно расплавляют на водяной бане и извлекают соответствующим растворителем в мерную колбу вместимостью 100 мл (раствор А). 2 мл. раствора А помещают в мерную колбу вместимостью 100 мл. и вновь разводят соответствующим растворителем (раствор Б). 5 мл. раствора Б переносят в мерную колбу вместимостью 50 мл. и измеряют оптическую плотность полученного раствора Д0 при длинах волн от 225 – 290 нм. В кювете с толщиной слоя равным 10 мм., применяя в качестве стандартного нулевого раствора соответствующий растворитель.
Количество высвободившегося лекарственного препарата и обнаруженного в диализате в процентах (С) рассчитывают по формуле:
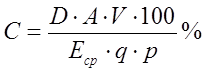 , (3)
, (3)
где D – оптическая плотность диализата; А – разведение отобранной пробы, V – объем (общий) диализной среды, мл; Еср – удельный показатель поглощения; q – объем диализата, взятый д/анализа, мл; р – количество лекарственного препарата в навеске мази, мг
Методы invivo
В отличие от методов in vitro эти методы позволяют дать оценку сразу двум процессам: способности мазевой основы освобождать активные компоненты и степень резорбции последних через кожу.
Методы in vivo могут быть классифицированы следующим образом.
1. Определение резорбированного количества препаратов по разнице между нанесенной пробой и невсосавшейся частью. Подобная оценка допустима на коже как животного,- так и человека. Определенное количество мази наносят и равномерно растирают на строго ограниченном участке кожи, используя шаблон. На этот участок с помощью манжеты оказывают давление 100 мм рт. ст. Пробу повторяют до тех пор, пока наложенные на испытуемую область диски фильтровальной бумаги перестанут воспринимать мазь. В них определяют количество нерезорбировавшегося препарата. Количество препарата, проникшего в кожу, устанавливают по разнице.
2. Гистологические исследования позволяют определить с помощью микроскопа, какого слоя кожи достиг препарат. Мазь наносят на де-пилированный участок кожи животного, затем после его забоя делают гистологические срезы. Они могут быть продольными (для определения глубины проникновения) или поперечными (для оценки области распространения мази).
3. Определение после локального нанесения препаратов, разорбировавшихся в крови, органах и тканях, выделениях или выдыхаемом воздухе.
4. Регистрация биологических или токсических реакций, вызываемых данным препаратом (реакция зрачка, изменение болевых ощущений, сердечного ритма, наступление судорог или летального исхода и т. д.).
5. Радиоизотопный метод с применением меченых препаратов.
Как методы in vitro, так и методы in vivo дают относительные результаты. Если к первым нужно подходить критически на основании того, что они не учитывают физиологических функций кожи, то и вторые дают лишь приближенные результаты. Кожа человека как по проявлению функций, так и по структуре существенно отличается от кожи животных. Окончательную оценку мази можно получить лишь в условиях клиники.
Качество и сохранность МЛФ определяется её упаковкой и условиями хранения. Определение целостности упаковки является последним этапом контроля качества лекарств. Эффективность же во многом зависит от таких факторов, как:
1) стабильность;
2) подлинность;
3) однородность;
4) содержание лекарственных веществ;
5) степень дисперсности;
6) структурно-механические свойства (консистенции);
7) рН мази.
Факторы, от которых зависит эффективность мази:
1) Стабильность. Она определяется неизменностью содержания ЛВ (в пределах установленного допуска), структурных свойств и скорости высвобождения ЛВ.
2) Определение подлинности. Проводится визуально по внешнему виду и органолептическим признакам (запах и др.), зависящим от свойств входящих в мазь лекарственных веществ и от использованных мазевых основ.
3) Определение однородности. Берут четыре пробы мазей по 0,02- 0,03 г, помещая их по две на предметное стекло. Покрывают вторым предметным стеклом и плотно прижимают до образования пятен диаметром около 2 см. При рассматривании полученных пятен невооруженным глазом (на расстоянии около 30 см от глаза) в трех из четырех проб не должно обнаруживаться видимых частиц.
4) Содержание лекарственных веществ. Количество лекарственных веществ в мазях определяют по методикам, приведенным в частных фармакопейных статьях на испытуемую мазь.
5) Определение дисперсности частиц. В связи с возрастающими требованиями к качеству суспензионных мазей во многих зарубежных фар-макопеях приведены такие нормы: в фармакопее Германии - не более 60 мкм, а в глазных мазях не более 50 мкм, Венгрии - в глазных мазях не более 20 мкм, Чехии - не более 30 мкм, а в глазных мазях не более 10 мкм, США - в глазных мазях не более 50 мкм. Методы определения степени дисперсности, принятые зарубежными фармакопеями - микроскопические и ситовые.
И. Л. Муравьев и В. Д. Кузьмин (1967) разработали методику определения размера частиц в мягких лекарственных формах также с помощью окулярного микрометра микроскопа. Предлагается в мазях допускать не более 5% частиц крупнее 50 мкм. Отбор проб производят специальными микрошпателямн в матрицы, вмещающие 3 мг лекарства. Все пробы лекарства не превышают 20-30 мг. Общая площадь просмотра равна 20 мм2. На этой площади для мазей, содержащих до 10% твердой фазы, не должно быть больше 40 частиц крупнее 50 мкм. В мазях с меньшей концентрацией должно наблюдаться меньше 40 частиц. При анализе пасты разбавляют до содержания твердой фазы не более 10%.
6) Определение структурно-механических свойств (консистенции).
Консистенция мазей и мазевых основ требует объективной оценки, поскольку влияет на процессы их приготовления и расфасовки, намазы-ваемость мазей и высвобождение из них лекарственных веществ.
Одним из главных факторов, от которых зависит консистенция, является предельное напряжение сдвига. Предельное напряжение сдвига мазей характеризует их способность оказывать некоторое сопротивление при размазывании, способность выдавливаться из туб, дозаторов и т. д.
Предельное напряжение сдвига называют также точкой течения, подразумевая под этим напряжение, необходимое для начала течения системы (для необратимой деформации ее). Чем выше значение этой величины, тем труднее мазь намазывается. Это важная характеристика мазей и мазевых основ, поскольку она определяет удобство применения мазей.
Другой важной реологической характеристикой мазей и мазевых основ является пластическая вязкость. Ее определяют на ротационном вискозиметре Воларовича модели РВ-8,
7) Определение рН мазей. Необходимо для контроля за поведением лекарственных веществ и основы во время хранения. Сдвиг рН свидетельствует об изменении физико-химических свойств.
Совершенствование мазей как лекарственной формы
При всех положительных свойствах мазей существуют такие дерматологические состояния, когда применение мазей становится нежелательным или вообще неприемлемым. Это относится, в частности, к их нанесению на кожные или слизистые покровы с нарушенной целостностью, когда возникает требование не только стерильности, но и необходимости дозирования сильнодействующих препаратов. К другим случаям необходимого совершенствования формы можно отнести негигиеничность и неудобство нанесения мазей, неудобство транспортировки и длительность приготовления. Наконец, следует отметить применение ректальных и защитных мазей, что требует особых технологических решений.
Ректальные мази
В настоящее время ректальные мази используют с целью воздействия на локальные процессы в прямой кишке, облегчения дефекации и реже для резорбтивного действия. Эти мази обычно являются комбинированными и готовятся на гидрофобных основах. Технология приготовления ректальных мазей не отличается от технологии других мазей на гидрофобных основах.
В качестве отечественных основ предложены сплав гидрированного рафинированного китового жира с различными количествами соевого лецитина и сплав частично гидрированного подсолнечного масла с 10% соевого лецитина.
Положительными качествами ректальных мазей являются:
- простота изготовления;
- доступность основы;
- нежность самой формы.
Основным недостатком является:
- сравнительная сложность дозировки. Отпускаются ректальные мази в тубах с наконечниками.
Введение лекарств для общего воздействия на организм в виде ректальных мазей перспективно, так как при этом лекарственные вещества легко и быстро всасываются.
Сухие концентраты мазей
мазь лекарственный мембрана кожа
При приготовлении сухих концентратов мазей в качестве основы используют порошковидные вещества, легко набухающие в воде и образующие при добавлении ее массы мазеобразной консистенции.
Концентраты на основе бентонитов и других набухающих веществ
С этой целью удобно использовать порошок алтейного корня, бентонитовые глины, гидрат окиси алюминия, фитостерин. Например, по рецепту следующего типа:
Recipe: Ichthyoli20,0
Pulveris radicis Althaeae 10 ,0
Bentoniti 70,0
Misce ut fiat pulveris.
Da. Signa.
Технология приготовления
Ихтиол тщательно смешивают с порошком алтейного корня. Полученную массу продолжают уплотнять бентонитом. В итоге получается совершенно сухой порошок, который для достижения большей однородности можно просеять. Если к концентрату примешать равное количество воды, то порошок алтейного корня начнет ослизняться, а бентонит набухает. Получится мазь (паста) на нежирной основе, хорошо намазывающаяся и легко смывающаяся водой. На коже она засыхает, не требуя дополнительной повязки. Указанные концентраты мазей имеют еще одну положительную сторону; они с успехом могут быть использованы в качестве присыпок, причем благодаря высушивающему и дренирующему действию их можно наносить на влажные поверхности при умеренной эксудации (в отличие от обычных присыпок).
Концентраты на основе мыла
Для получения сухих концентратов мазей может быть успешно использовано медицинское (натриевое) мыло, иногда непосредственно выполняющее роль лекарственного средства. Обоснованием для его выбора послужили свойства,
8-09-2015, 20:11
