Основными методами хирургической профилактики являются тромбоэктомия, перевязка магистральных вен (бедренной вены ниже устья глубокой вены бедра), пликация нижней полой вены и имплантация кава-фильтров. В настоящее время наиболее широко используется чрескожная имплантация кава-фильтров, показаниями к которой являются [26]:
- противопоказания к антикоагулянтной терапии или тяжелые геморрагические осложнения при ее применении;
- рецидив ТЭЛА или проксимальное распространение флеботромбоза на фоне адекватной антикоагулянтной терапии;
- тромбоэмболэктомия из легочной артерии;
- протяженный "флотирующий" тромб в илеокавальном венозном сегменте;
- ТГВ/ТЭЛА у больных с низким кардиопульмональным резервом и тяжелой легочной гипертензией;
- высокий риск развития ТГВ/ТЭЛА (большие хирургические вмешательства, переломы костей и позвоночника) у больных, ранее перенесших ТЭЛА;
- ТЭЛА у беременных как дополнение к терапии гепарином или при противопоказаниях к применению антикоагулянтов;
- безуспешность ранее использованных методов лечения ТГВ/ТЭЛА;
- тромбэндартерэктомия у больных с постэмболической легочной гипертензией;
- ТГВ/ТЭЛА у больных, перенесших трансплантацию почки или сердца.
| Таблица 2. Классификация больных по степени риска развития тромбоза глубоких вен и тромбоэмболии легочной артерии |
| Высокий риск |
Хирургия: - общехирургическая или урологическая операция у больных старше 40 лет с недавно перенесенным ТГВ/ТЭЛА; - операции на органах брюшной полости и малого таза при злокачественных опухолях; - большие ортопедические операции на нижних конечностях |
Нехирургические заболевания: - инсульт; - застойная сердечная недостаточность; - заболевания на фоне тромбоэмболии |
| Умеренный риск |
Хирургия: - общехирургические операции у больных старше 40 лет продолжительностью 30 мин и более |
Нехирургические заболевания: - все иммобилизованные больные с "активными" заболеваниями (риск повышается при инфекционных и злокачественных заболеваниях, а также при наличии других факторов риска) |
| Низкий риск |
Хирургия: - неосложненные операции у больных моложе 40 лет с дополнительными факторами риска; - малые операции (продолжительностью менее 30 мин); - у больных старше 40 лет без дополнительных факторов риска |
Нехирургические заболевания: - все иммобилизованные больные с "активными" заболеваниями (риск повышается при инфекционных и злокачественных заболеваниях) |
| Таблица 3. Частота (в %) тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА) у больных с различной степенью риска | ||||
| Степень риска | Риск ТГВ/ТЭЛА (по объективным тестам) | |||
| тромбоз вен голени | проксимальный флеботромбоз | клиническая ТЭЛА | смертельная ТЭЛА | |
| Высокая | 40-80 | 10-30 | 5-10 | 1-5 |
| Умеренная | 10-40 | 2-10 | 1-8 | 0,1-0,7 |
| Низкая | <10 | <1 | <1 | <0,01 |
Противопоказаниями к имплантации кава-фильтра являются: тяжелая коагулопатия с риском кровотечения; обструктивный тромбоз той части вены, в которую имплантируется кава-фильтр; септическая эмболизация и септикопиемия.
При септической тромбоэмболии кава-фильтр не препятствует происхождению мелких бактериальных эмболов, поэтому в этих случаях прибегают к перевязке нижней полой вены. При септическом тромбофлебите малого таза, кроме того, перевязывают левую яичниковую вену.
Техника чрескожной имплантации кава-фильтров различных конструкций (зонтичный Мобин-Уддина, Гринфильда, Амплатца, "птичье гнездо", "тюльпан Гюнтера", РЭПТЭЛА, "песочные часы") имеет много общего. Имплантация кава-фильтров производится в рентгенооперационной.
Для оценки состояния нижней полой вены и получения информации об эмбологенности тромба вначале производится ретро- или антеградная илеокавография. Выбор доступа (ретроградный - яремный, подключичный; антеградный - бедренный) зависит от предполагаемой локализации тромба: проведение катетера через тромбированные вены чревато фрагментацией тромба с развитием ТЭЛА.
Кава-фильтр имплантируют тотчас ниже устьев почечных вен. При низком положении кава-фильтра образовавшееся между ним и устьями почечных вен "мертвое" пространство повышает риск тромбообразования и ТЭЛА.
После имплантации кава-фильтра проводится контрольная рентгенография для контроля его месторасположения. В течение 2 сут больной находится на постельном режиме; на 5-6 дней назначаются антибиотики, проводится лечение гепарином.
В постимплантационном периоде может наблюдаться ряд осложнений: изменение ориентации фильтра, его смещение в правые отделы сердца, легочную артерию и другие вены, деформация и фрагментация фильтра, окклюзия нижней полой вены [20].
Противоэмболические кава-фильтры надежно предотвращают ТЭЛА, частота развития послеоперационной эмболии не превышает 1,2%. Возникновение ее объясняют рядом причин: ошибочной имплантацией кава-фильтра в притоке нижней полой вены; неправильной его фиксацией или смещением; образованием тромбов на поверхности фильтра, а также между фильтром и почечными венами; тромбозом расширенных паракавальных коллатералей [26].
Профилактика
Для предотвращения послеоперационного венозного тромбоза предложены различные физические (механические) и фармакологические средства. К первой группе относят разные способы ускорения венозного кровотока, что препятствует одному из важнейших факторов в генезе тромбообразования: застою крови в венах нижних конечностей. Венозный застой предотвращают ранняя активизация пациентов в послеоперационном периоде, эластическая компрессия нижних конечностей (предпочтительнее использование с этой целью специальных эластических гольфов и чулок, обеспечивающих максимальное давление на уровне лодыжек с постепенным его снижением в проксимальном направлении); прерывистая пневмокомпрессия ног с помощью специальных компрессора и манжет, разделенных на несколько камер, в которые попеременно подается воздух; "ножная педаль", позволяющая добиваться пассивного сокращения икроножных мышц.
В числе общих мер, которые также могут сыграть профилактическую роль следует упомянуть: обеспечение адекватной гидратации, использование нормоволемической гемодилюции (оптимальная величина Ht перед началом вмешательства - 27-29%), применение максимально щадящей техники оперативного вмешательства, лечение дыхательной и циркуляторной недостаточности.
Фармакологические средства, используемые с целью профилактики ТГВ, представлены низкомолекулярными декстранами (реополиглюкин, реомакродекс), дезагрегантами (в основном, аспирин), обычным нефракционированным гепарином (НФГ) и низкомолекулярными гепаринами (НМГ), а также непрямыми антикоагулянтами.
Эффективность указанных способов профилактики различна. Поэтому в клинических условиях должны быть рекомендованы такие мероприятия, действенность и безопасность которых доказаны. С другой стороны, способы профилактики следует выбирать, сообразуясь со степенью риска послеоперационных венозных тромбоэмболических осложнений (табл.). Кроме того, использование различных мер должно быть экономически оправдано.
| Степени риска | Способы профилактики |
| Низкая | - Ранняя активизация больных* - Эластическая компрессия нижних конечностей* |
| Умеренная | - НМГ (Клексан 20 мг) ґ 1 раз в день п/к или - НФГ 5000 ед. ґ 2-3 раза в день п/к или - длительная прерывистая пневмокомпрессия ног |
| Высокая | - НМГ (Клексан 40 мг) ґ 1 раз в день п/к или - НФГ 5000 - 7500 ед. ґ 3-4 раза в день п/к - Методы ускорения венозного кровотока |
| Особые случаи | - Лечебные дозы НМГ или НФГ - Парциальная окклюзия нижней полой вены (имплантация фильтра, пликация). |
Литература
1. Sasahara А.А., Sharma J. V. R.K., Barsamian E.M. et al. Pulmonary throm-boembolism, diagnosis and treatment. JAMA 1983;249:2945-2949.
2. Morpurgo M., Schmid C. The spectrum of pulmonary embolism. Clini-copathologic correlation. Chest 1995; 107:Suppl:18S-20S.
3. Rich S. Тромбоэмболия легочной артерии. В кн.: Кардиология в таблицах и схемах. Под ред. М. Фрида, С. Грайнс: Пер. с англ. М: Практика 1996; 538-548.
4. Khan M.G., Palmer L.B. Pulmonary embolism. In: Pulmonary disease diagnosis and therapy. A practical approach. Eds. M.G. Khan, J.P. Lynch. Baltimore:Williams and Wilkins 1997;585-601.
5. Anderson F.A., Wheeler H.B., Goldberg R.J. et al. A population based perspective of the hospital incidence and case-fatality rats of deep vein thrombosis and pulmonary embolism. Arch Intern Med 1991;151:933-938.
6. Яковлев В. Б. Проблема тромбоэмболии легочной артерии, пути ее решения в многопрофильном клиническом стационаре. Военмеджурн 1994; 10: 25-32.
7. Planes A., Vochelle N., Darman J. Y. et al. Risk of deep-venous thrombosis after hospital discharge in patients having undergane total hip replacement, double-blide randomised comparison of enoxaparin versus placebo. Lancet 1996;348: 244- 248.
8. Макаров О.В., Озолиня Л.А., Пархоменко Т.В., Керчелаева С.Б. Профилактика тромбоэмболических осложнений в акушерской практике. Росс мед журн 1998;1: 28-32.
9. Dahlback В. Factor V gene mutation causing inherited resistance to-activated protein С as a basis for venous thromboembolism. J Int Med 1995;237:221-227.
10. Bergqvist D., Lindblad В. Incidence of venous thromoembolism. Eds. D.Bergqvist, A.J. Comerota, A.N. Nicolaides, J.H. Scurr. London - Los Angeles -Nicosia: Med Orion Publishing Company 1994;3-16.
11. Alexander J.K. Тромбоэмболия легочной артерии (ТЭЛА). В кн.:Руководство по медицине. Диагностика и терапия: Пер. с англ. Под ред. Р. Беркоу, Э.Флетчера. М:Мир 1997;1:460-465.
12. The PIOPED investigators value of the ventilation-perfusion scan in acute pulmonary embolism. JAMA 1990;263:2753-2759.
13. Greenspan R.H. Pulmonary angiography and the diagnosis of pulmonary embolism. Progress Cardiovasc Dis 1994;37:93-106.
14. Синицын В.Е., Веселова Т.Н., Пустовитова Т.С. и др. Диагностика двустороннего тромбоза легочной артерии с помощью электронно-лучевой томографии. Кардиология 1998;9:94-96.
15. Remy-Jardin М., Remy J., Wattinne L. et al. Central thromboembolism: diagnosis with spiral volumetric CT with single breath-hold technique-comparison with pulmonary angiography. Radiology 1992;185:381-387.
16. Janssen M.C.H., Wallersheim H., Novacova J.R.O. et al. Диагностика тромбоза глубоких вен. Общий обзор. Росc мед журн 1996;1:11- 23.
17. Douketis J.D., Kearon C., Bates Sh. et al. Risk of fatal pulmonary embolism in patients with treated venous thromboembolism. JAMA 1998;279:458-462.
18. Meyer G., Brenot F., Pacouret G. et al. Subcutaneus LMWH fragmin versus intravenous infarctiunated heparin in treatment of acute non massive pulmonary embolism: an open randomised pilot study. Thromb Haemost 1995; 74:1432-1435.
19. Thery C., Simonneau G., Meyer G. et al. Randomized trial of subcuta-neus LMWH CV 216 (fraxiparine) comparted with intravenous in-fractionated heparin in the curative treatment of submassive pulmonary embolism. A dose ranging study. Circulation 1992; 85:1380-1389.
20. Савельев В.С., Яблоков Е.Г., Кириенко А.И. Массивная эмболия легочных артерий. М: Медицина 1990;336.
21. Goldhaber S.Z., Haire W.D., Feldstein M.L. et al. Alteplase versus heparin in acute pulmonary embolism, randomizes trial assessing right-ventricuiar function and pulmonary perfusion. Lancet 1993;341:507- 511.
22. Alpert J.S., Dalen J. Эмболиялегочнойартерии. В кн.: Клиническая кардиология. Руководство для врачей. Под ред. Р.К. Шланта, Р.В. Александера: Пер. с англ. М-Санкт-Петербург: Изд. Бином - Невский Диалект 1998;287-302.
23. Carson J.L., Kelley M.A., Duff A. et al. The clinical course of pulmonary embolism. N Engl J Med 1992; 326: 1240-1245.
24. Thromboembolic Risk Factors (THRIFT) Consensus Group. Risk of and prophylaxis for venous thromboembolism in hospital patients.BMJ 1992;305:567-574.
25. Clagett G.P., Anderson F.A., Heit J. et al. Prevention of venous thromboembolism. Chest 1995;108: Suppl 4:312S-334S.
26. Bergqvist D. The role of vena caval interruption in patients with venous thromboembolism. Progr Cardiovasc Dis 1994;37:25-37.
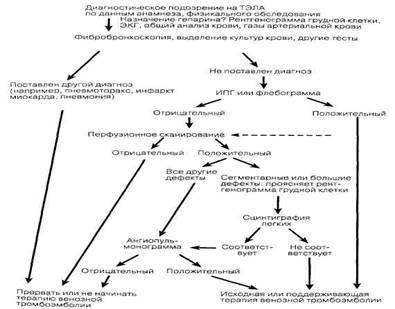 Приложение: Алгоритм действий при тромбоэмболии легочной артерии (ТЭЛА)
Приложение: Алгоритм действий при тромбоэмболии легочной артерии (ТЭЛА)
Диагностика:
Врач может думать о ТЭЛА при наличии у больного следующих симптомов:
внезапное появление одышки;
снижение АД, коллапс;
тахикардия, аритмия;
цианоз верхней половины туловища, набухание шейных вен,
загрудинные боли, боли в эпигастральной области;
кашель, кровохарканье, повышение температуры тела;
беспокойство, тревога, страх;
несоответствие выраженности одышки скудной аускультативной картине в легких;
акцент и расщепление второго тона над легочной артерией;
наличие в анамнезе сведений, указывающих на возможность развития ТЭЛА (варикозная болезнь, прием кортикостероидов, склонность к гиперкоагуляции; состояние после продолжительной болезни или хирургического вмешательства);
ЭКГ-признаки острого легочного сердца. Диагностическое значение имеет появление острых изменений в сравнении с ранее выполнявшимися ЭКГ. Следует учитывать, что иногда, даже при массивной ТЭЛА, на ЭКГ могут отсутствовать специфичные для нее симптомы.
Дифференциальная диагностика: в большинстве случаев проводится с инфарктом миокарда, острой сердечной недостаточностью (отек легких, кардиогенный шок), спонтанным пневмотораксом.
Меры интенсивной терапии можно условно разделить на 2 группы:
Поддержание жизни (включая, если необходимо, сердечно-легочную реанимацию);
Устранение и профилактика вторичных реакций на эмбол.
1.Поддержание жизни.
При молниеносной форме, нередко требуется стандартный комплекс сердечно-легочной реанимации: непрямой массаж сердца, введение адреналина и других необходимых медикаментов; обеспечение проходимости дыхательных путей, ИВЛ; электрическая дефибрилляция сердца.
Даже при самой массивной ТЭЛА, массаж сердца может оказаться эффективным, т.е. иногда способствует фрагментации эмбола и смещению его в более дистальные отделы легочного артериального русла.
2. Устранение вторичных реакций .
купирование болевого синдрома (ненаркотические и наркотические анальгетики);
устранение вазо-вазального внутрилегочного рефлекса: эуфиллин 2,4%-10-20 мл, нитроглицерин сублингвально и в/в, но-шпа, дроперидол;
ингаляция кислорода, ИВЛ по показаниям;
антикоагулянтная терапия: гепарин 10000 √15000 ЕД в/в; фраксипарин 0,6 мл;
антитромботическая терапия: реополиглюкин 400,0 мл + трентал 5,0 мл; никотиновая кислота, компламин, ксантинола никотинат;
устранение бронхиолоспазма √ алупент 1,0 в/в;
поддержание гемодинамики √ норадреналин, мезатон.
Примечание: объем инфузионной терапии не более 600-800 мл в сутки. Применение тромболитических средств (фибринолизин, стрептаза, урокиназа) возможно только в условиях специализированного отделения.
При условии транспортабельности больного, обязательна госпитализация в отделение интенсивной терапии.
Рис. Алгоритм диагностики тромбоэмболии легочной артерии. Условные обозначения: ИПГ — импедансная плетизмография. (Воспроизведено из: MoserK. V.: НРШ-13).
Неотложная помощь
А. 1. Немедленное проведение закрытого массажа сердца с частотой 80-90 компрессий в 1 мин; более эффективен метод активной компрессии-декомпрессии с помощью кардиопампа.
2. ИВЛ доступным способом (соотношение массажных движений и вдувании воздуха 5 : 1, а при работе одного реанимирующего - 15 : 2), обеспечить проходимость дыхательных путей (запрокинуть голову, выдвинуть нижнюю челюсть, ввести воздуховод, по показаниям - санировать дыхательные пути):
- использовать 100% кислород;
- интубировать трахею (процесс интубации не должен быть более 30-40 с);
- не прерывать массаж сердца и ИВЛ более чем на 30 с.
3. При фибрилляции желудочков и невозможности немедленной дефибрилляции:
- прекардиальный удар;
- при отсутствии эффекта продолжить сердечно-легочную реанимацию, как можно быстрее обеспечить возможность проведения дефибрилляции.
4. Катетеризировать центральную или периферическую вену.
5. Адреналин по 1 мг каждые 3-5 мин проведения сердечно-легочной реанимации.
6. Как можно раньше - дефибрилляция 200 Дж;
- при отсутствии эффекта - дефибрилляция 300 Дж;
- при отсутствии эффекта - дефибрилляция 360 Дж;
- при отсутствии эффекта - действовать в соответствии с п. 7.
7. Действовать по схеме: лекарство внутривенно - массаж сердца и ИВЛ, через 30-60 с:
- дефибрилляция 360 Дж;
- лидокаин 1,5 мг/кг - дефибрилляция 360 Дж;
- при отсутствии эффекта - через 3-5 мин повторить инъекцию лидокаина в той же дозе - дефибрилляция 360 Дж;
- при отсутствии эффекта - орнид 5 мг/кг - дефибрилляция 360 Дж;
- при отсутствии эффекта - через 5 мин повторить инъекцию орнида в дозе 10 мг/кг - дефибрилляция 360 Дж;
- при отсутствии эффекта - новокаинамид 1 г (до 17 мг/кг) - дефибрилляция 360 Дж;
- при отсутствии эффекта - магния сульфат 2 г - дефибрилляция 360 Дж;
8. При асистолии:
- если невозможно точно оценить электрическую активность сердца (не исключить атоническую стадию фибрилляции желудочков, не подключить быстро электрокардиограф или кардиомонитор и т. п.), то действовать по пп. 1-7;
- если асистолия подтверждена в двух отведениях ЭКГ - выполнить пп.1, 2, 4, 5;
- при отсутствии эффекта вводить атропин через 3-5 мин по 1 мг до наступления эффекта или общей дозы 0,04 мг/кг;
- произвести электрокардиостимуляцию как можно раньше;
- устранить возможную причину асистолии (гипоксия, гипо- или гиперкалиемия, ацидоз, передозировка лекарств и др.);
- может быть эффективно введение 240-480 мг эуфиллина.
9. При электромеханической диссоциации:
- выполнить мероприятия в соответствии с пп. 1, 2, 4, 5;
- установить и корректировать возможную причину (массивная ТЭЛА - см. соответствующий стандарт, тампонада сердца - перикардиоцентез, гиповолемия - инфузионная терапия и т. д.).
10. Мониторировать жизненно важные функции (кардиомонитор, пульсоксиметр).
11. Госпитализировать после возможной стабилизации состояния.
12. После фибрилляции желудочков - специальные меры по профилактике рецидивов (см. "Острый инфаркт миокарда").
Сердечно-легочную реанимацию можно прекратить если:
- при ее проведении выяснилось, что она не показана;
- наблюдаются стойкая асистолия, не поддающаяся медикаментозному воздействию или многократные эпизоды асистолии;
- при использовании всех доступных методов нет признаков эффективности СЛР в течение 30 мин.
Сердечно-легочную реанимацию можно не начинать:
- в терминальной стадии неизлечимого заболевания (если бесперспективность СЛР заранее зафиксирована документально);
- если с момента прекращения кровообращения прошло больше 30 мин;
- при предварительно документированном отказе больного от сердечно-легочной реанимации,
Основные опасности и осложнения:
- гипоксическая кома, энцефалопатия;
- дыхательный и метаболический ацидоз;
- после дефибрилляции - асистолия, продолжающаяся или рецидивирующая фибрилляция желудочков, ожог кожи;
- при ИВЛ - переполнение желудка воздухом, регургитация, аспирация желудочного содержимого;
- при интубации трахеи - ларинго- и бронхоспазм, регургитация, повреждение слизистых оболочек, зубов, пищевода;
- при закрытом массаже сердца - перелом грудины, ребер, повреждение легких, напряженный пневмоторакс;
- при пункции подключичной вены - кровотечение, пункция подключичной артерии, лимфатического протока, воздушная эмболия, напряженный пневмоторакс;
- при внутрисердечной инъекции - введение лекарственных препаратов в миокард, повреждение коронарных артерий, гемотампонада, ранение легкого, пневмоторакс.
Примечание
Все лекарственные средства во время сердечно-легочной реанимации необходимо вводить внутривенно быстро. При использовании периферической вены препараты вводить в 20 мл изотонического раствора натрия хлорида.
При отсутствии доступа к вене адреналин, атропин, лидокаин (увеличив рекомендуемую дозу в 1,5-3 раза) вводить в трахею (через интубационную трубку или щитовидно-перстневидную мембрану) в 10 мл изотонического раствора натрия хлорида.
Внутрисердечные инъекции (тонкой иглой, при строгом соблюдении техники) допустимы только в исключительных случаях, при невозможности использовать другие пути введения лекарственных средств.
Натрия гидрокарбонат по 1 ммоль/кг (3 мл 4% раствора на 1 кг массы тела), затем по 0,5 ммоль/кг каждые 5-10 мин применять при длительной
8-09-2015, 21:20
