В отличие от сомнительных ассоциаций с DR2 в сельской Камбоджи (Goldfeld 1998) была найдена четкая ассоциация HLA-DQB1*0503 с туберкулезом (р=0,005), ассоциаций с аллелями DR2 и TNF-α обнаружено не было. Исследование было проведено в двух стадиях с отдельными группами пациентов. Во время первой стадии исследования было проверено большое количество аллелей, но ассоциации была обнаружена только с HLA-DRB1*0503. Во время второй стадии исследования проверялся только этот подтип HLA. Кроме того, контролем служили пациенты того же госпиталя, только с незначительными болезнями, поэтому они, скорее всего, являлись представителями той же популяции. Поскольку в данной популяции туберкулез широко распространен, аллель DQ связан не с восприимчивостью к инфекции, а с развитием клинических стадий болезни (Goldfeld 1998).
Ассоциация специфической аллели HLA-DQB1*503 с прогрессивным туберкулезом особенно интересна в связи с тем, что DQB1*503 аллель кодирует изменения в аминокислотной позиции 57 β-цепочки (β57), которая влияет на связывание антигена в кармане Р9 молекулы DQ.
DQB1*503 аллель, которая является частью DQ1 серологической специфичности, кодирует отрицательно заряженную аспарагиновую кислоту в β57 вместо обычной незаряженной и гидрофобной аминокислоты валина. МНС-ограниченная презентация пептидов макрофагами, инфицированными микобактериями может быть изменена у пациентов, которые экспрессируют этот специфический Р9 карман. Отрицательно заряженный Р9-связывающий карман может связывать антигены туберкулезных бактерий менее эффективно или выявляется слабый иммуногенетический ответ.
В последующих исследованиях прогрессирование туберкулеза было связано с гомозиготностью других аллелей HLA-DQB с аспарагиновой кислотой в позиции 57: DQB1*0301, 0303; DQB1*04 (-0401, 0402); DQB1*0503; DQB1*0601,-0602,-0603. По сравнению с аллелью HLAβ 57-Ala презентация пептида ESAT-6 HLAβ 57-Asp приводит к меньшей продукции IFN-γ CD4+ т-клетками у пациентов с туберкулезом (Delgado 2006).41 аллель HLA-DQB1*0503 был найден среди пациентов с туберкулезом, но аллель не был найден ни у одного из 107 туберкулин-положительных контрольных людей. Этот аллель не ассоциирован с туберкулезом в других популяциях, поэтому считается специфичным для жителей Камбоджи. Однако исследование пациентов в вендской популяции в Южной Африке (Lombard 2006) показало ассоциацию туберкулеза с другими β 57-Asp гаплотипами, идентифицированными в исследовании на пациентах из Камбоджи, DRB1*1302-DQB1*0602, DRB1*1302-DQB1*0603, DRB1*1101-1121-DQB1*0301-0304 и DRB1*1101-1121-DQB1*05. Семь других исследований также доказали ассоциации некоторых из этих гаплотипов с восприимчивостью к туберкулезу (Dubaniewicz 2000, Dubaniewicz 2005, Goldfeld 1998, Kim 2005, Pospelova 2005, Teran-Escandon 1999, Wang 2001), тогда как три других исследования показали защитный эффект гаплотипов (Dubaniewicz 2005, Vejbaesya 2002, Wang 2001).
Было предположено (Lombard 2006), что данные гаплотипы, увеличивающие восприимчивость к туберкулезу, поддерживаются в популяциях, так как часть этих аллелей имеет защитный эффект против малярии (DRB1*1302-DQB1*0501) (Hill 1991), хронического гепатита B (HLA-DRB1*1302) (Thursz 1995) (Hill 2001, Wang 2003) и хронического гепатита C (DRB1*1101 и DQB1*0301) (Hong 2005) [39]. Возможно, что гетерозиготность по этим аллелям HLA может иметь защитный эффект против малярии, туберкулеза и хронических гепатитов для африканских популяций. Наоборот, хотя аллель HLA-DQβ-57-Asp и ассоциирован с восприимчивостью к туберкулезу, он также является протективным для аутоиммунного диабета 1 типа. Поэтому у европейцев, имеющих аллель HLA-DQβ-57-Ala (HLA-DQ2 и - DQ8) вместе с устойчивостью к туберкулезу имеется и восприимчивость к развитию аутоиммунного диабета 1 типа (Delgado 2006).
Молекулярные основы предрасположенности к туберкулезу пока изучены недостаточно. Связь исследованных аллельных вариантов с заболеванием и их клинические проявления слишком слабы, их роль в функциональных нарушениях обоснована недостоверно. Таким образом, молекулярные основы генетического контроля предрасположенности к туберкулезу в больших популяциях остаются пока достаточно туманными.
Вместе с тем существуют четкие причинно-следственные отношения между редкими менделирующими иммунодефицитами по Т-клеткам или фагоцитам и тяжелыми формами туберкулеза. Пациенты с такими заболеваниями в значительной степени чувствительны к инфекции не только M. tuberculosis, но и другими микроорганизмами. Недавно был описан и исследован менделирующий синдром восприимчивости к микобактериалыюй инфекции (OMIM - 209950). Люди с этим синдромом исключительно чувствительны не только к патогенным штаммам, но и к слабовирулентным видам микобактерий, таким как свободноживущие нетуберкулезные формы и BCG. При исследовании этого синдрома обнаружены мутации в генах, связанных с противоинфекционным иммунитетом: IFNG, IFGR1, - 2, TNFA, IL12B, IL12RB1 (интерферон-гамма, два его рецептора, фактор некроза опухолей альфа, ИЛ-12 и бета-1 субъединица его рецептора) (Altare 1998).
На основании имеющихся на сегодняшний день данных сформулировано предположение о непрерывном спектре генетического контроля предрасположенности к туберкулезу у человека: моногенные формы - варианты с эффектом главного гена; олигогенные формы - полигенная подверженность. Может привести к успеху изучение редких менделирующих дефектов иммунитета у отдельных пациентов с тяжелыми нераспространенными клиническими фенотипами, ведущих эффектов в отдельных семьях и в популяциях, лишь недавно столкнувшихся с микобактериальной инфекцией, а также широко распространенных полиморфизмов в популяциях с длительной историей экспозиции М. tuberculosis. Возможно, на всех трех уровнях генетического контроля участвует один ген, имеющий редкие мутации, ответственные за менделирующие тяжёлые фенотипы, относительно редкие варианты, обусловливающие основной эффект, и распространенные в популяциях полиморфизмы, в умеренной степени определяющие риск развития заболевания. Поиск такого гена (генов) - на сегодняшний день актуальная задача. Кроме того, важным представляется изучение функционального полиморфизма известных генов-кандидатов туберкулеза в популяциях различного этнического состава с разной частотой заболевания.
1.4 Ассоциация HLA II класса с микобактериозами в русской популяции
Группой ученых во главе с Л.В. Сароянц, М.Н. Болдыревой, И.А. Гуськовой было исследовано распределение частот аллелей локусов HLAII класса (DRB1, DQA1, DQB1) и гаплотипов у 113 больных лепрой и 51 больного туберкулезом легких русской национальности, проживающих в Астраханской области. Установлено достоверное повышение частоты встречаемости гаплотипа DRB1-16-DQA1-0102-DQB1-0502/04 при лепре и туберкулезе. Риск возникновения туберкулеза легких ассоциировался с наличием в генотипе гаплотипа DRB1-17-DQA1-0501-DQB1-0201. На основании полученных результатов сделан вывод, что присутствие специфических аллелей генов HLAII класса и их гаплотипов при указанных заболеваниях свидетельствует об их участии в патогенезе данных микобактериозов.
Тяжесть микобактериальных заболеваний скорее связана с Т-клеточным ответом на Mycobacterium leprae и Mycobacterium tuberculosis, чем с непосредственным воздействием бактерий. Поскольку молекулы HLA являются продуктами генов иммунного ответа, значительный полиморфизм в этих генах, возможно, ведет к различиям в восприимчивости и (или) устойчивости к инфекции.
Верификация генетических факторов, обусловливающих предрасположенность или устойчивость к лепре и туберкулезу, имеет большое значение для формирования групп лиц с повышенным риском развития этих заболеваний, что особенно актуально для эндемичных по данным инфекциям регионов. Успехи последних десятилетий в молекулярной генетике позволили перейти на новый уровень прогноза развития указанных болезней.
У больных туберкулезом и у больных лепрой установлена положительная ассоциация с HLA-DRB1-16-специфичностью. В то же, время повышение частоты встречаемости DRB1-17, DQB1-0201 и - 0303 характерно для больных туберкулезом, а DRB1-15, DQA1-0102 - для больных лепрой. У больных туберкулезом установлена отрицательная ассоциация с аллелем DQB1-0301 (таблица 3).
При анализе распределения частот гаплотипов обнаружено достоверное увеличение частоты встречаемости гаплотипа DRBl-16-DQA1-0102-DQB1-0502/04 (р < 0,05) в обеих группах больных.
Кроме того, у больных туберкулезом достоверней чаще по сравнению как с контролем, так и с больными лепрой встречался гаплотип DRB1-17-DQA1-0501-DQB1-0201 (р < 0,01); RR = 3,5. У больных лепрой и туберкулезом с низкой частотой определялся гаплотип DRB1-11-DQA1-0501-DQB1-0301 (таблица 4), однако статистически значимыми различия были только у больных лепрой (р < 0,05).
Таким образом, полученные результаты подтверждают вовлеченность в процессы возникновения и развития лепры и туберкулеза генетических факторов, ассоциированных с аллелями DRB1, DQA1 и DQB1 комплекса HLA. В последние годы стало известно, что полиморфизм системы HLA характерен для каждой конкретной группы населения, что оказывает определяющее влияние на биологическую стабильность данной группы.
Молекула МНС приобретает стабильную форму и соответствующую трехмерную конфигурацию только после того, как в связывающий сайт ее складки встраивается пептид. Пептидное связывание и последующий запуск иммунных реакции решающим образом зависят от аллельных вариантов молекулы HLA. Анализ последовательностей показал, что по одному аминокислотному варианту можно различать продукты DRB1-1501 от DRB1-1502 и DRB1-1601 от DRB1-1602. Можно полагать, что специфичность DRB1-16 или ее аллельные варианты избирательно нацелены на презентацию общих патогенных пептидов Mycobacterium leprae и Mycobacterium tuberculosis Т-клеткам. В то же время выявление DRB1-17-специфичности у больных туберкулезом, вероятно, свидетельствует о наличии патогенных мотивов у HLA-аллеля, стимулирующего Т-клеточные клоны, которые приводят к формированию ответной иммунной реакции, обусловливающей патогенез данного заболевания. Гаплотип DRB1-16-DQA1-0102-DQB1-0502/04 имеет низкую частоту встречаемости во многих популяциях. Так, у здоровых индусов он находится в пределах 4-5% с повышением, хотя и недостоверным (возможно, из-за малого числа наблюдений), у больных лепрой и туберкулезом. В русской популяции эти различия оказались статистически значимыми. Весьма вероятно, что пептиды, принадлежащие Mycobacterium leprae и Mycobacterium tuberculosis, связываются с конкретными эпитопами аллельных вариантов HLA-DRB1-генов и стимулируют Т-клеточные клоны, которые приводят к запуску иммунных ответных реакций, лежащих в основе патогенеза указанных микобактериозов. Возможно, ассоциации с DRB1-16-специфичностью или с ее аллельными вариантами свидетельствуют о предрасположенности к микобактериозам, наличие же в генотипе человека DRB1-17-специфичности (особенно гаплотипа DRB1-17-DQA1-0501-DQB1-0201) увеличивает риск развития туберкулезной инфекции в русской популяции.
Установление молекулярных механизмов распознавания антигенов является необходимой базой для дальнейшей коррекции силы иммунного ответа индивидуума в отношении любого антигенного воздействия. Прогресс на этом пути очевиден, так как уже сейчас показано, что замена всего лишь единственной аминокислоты в последовательности антигенсвязывающего участка молекулы гистосовместимости может приводить к развитию толерантности. Такого рода подходы открывают новые перспективы в борьбе с различными заболеваниями, в том числе с туберкулезом и лепрой.
II. Собственные исследования
2.1 Материалы и методы исследования
2.1.1 Контингент обследуемых лиц
Иммуногенетическое типирование проводилось среди русской этнической группы, постоянно проживающей в Челябинской области. Исследование включает 51 больного туберкулезом, находящегося на стационарном лечении в ГУЗ "Противотуберкулезный диспансер № 3", представителей социально благополучных слоев населения, имеющих родственников русской национальности в трех поколениях. Группу сравнения составили 202 случайно выбранных донора Областной станции переливания крови (г. Челябинск) русской национальности.
2.1.2 Иммуногенетическое типирование
Работа выполнена на базе зональной лаборатории иммуногенетического типирования тканей ОГУП "Челябинской областной станции переливания крови" г. Челябинск.
Генотипирование проводилось методом полимеразной цепной реакции с аллель специфическими праймерами (PCR-SSP) с помощью наборов реагентов, предложенных "НФП ДНК-Технология" (Москва). Идентификацию аллелей HLA II класса проводили методом амплификации с использованием 19 смесей праймеров для DRB1 локуса, 26 для DQB1 локуса и 12 смесей праймеров для DQA1 локуса. Для ПЦР использовался термоциклер МС-2 ("ДНК-технология", Москва, Россия).
Постановка реакции:
Для постановки используется ДНК, выделенная из венозной крови по стандартной методике (разрушение клеток и экстракция ДНК) путем последовательной обработки клеток лизирующим буфером.
В каждую пробирку, содержащую ДНК-pol, дезоксинуклеозид-трифосфаты, хлорид магния, оптимизированную буферную систему для ПЦР вносится по 10 мкл ПЦР растворителя.
Растворенная смесь с помощью автоматического дозатора раскапывается в пробирки по 5 мкл.
В каждую пробирку под масло добавляется по 2,5 мкл определенного праймера и 2,5 мкл раствора выделенной ДНК.
Для проведения амплификации используются последовательно связанные программы, приведенные для амплификатора типа МС-2, запрограммированного на объем 10 мкл. Обычно при проведении ПЦР выполняется 20-35 циклов, каждый из которых состоит из трех стадий: денатурации, отжига и элонгации.
Детекция результатов проводится с помощью гельэлектрофореза в 3% агарозном геле. Для этого в готовые пластины геля в лунки вносится по 5 мкл пробы. Затем пластинка помещается в ванночку и проводится электрофорез в течение 10 мин.
Учет результатов проводится визуально с помощью трансиллюминатора. При этом агарозный гель достается из кюветы и помещается на стекло трансиллюминатора. Продукты реакции амплификации выглядят в виде светящихся полос, наблюдаемых визуально в УФ-свете трансиллюминатора. Результаты фиксируются посредством фотографирования или видеосъемки геля при использовании УФ-фильтров и заносятся в протокол [28].
2.1.3 Методы статистической обработки
В плане наследования антигенов гистосовместимости человеческая популяция является панмиктической и подчиняется закону Харди - Вайнберга, выражающейся формулой наследования для системы с двумя признаками:
p2 + 2рq + q2 = 1,которая отражает количество гомо - и гетерозиготных по соответствующему гену индивидов в выборке.
Часть антигенов рассчитывается как процентное (долевое) соотношение индивидуумов, несущих антигены к общему числу обследованных, а частота гена по указанной выше формуле после ее преобразования:
p2x + 2px (1 - px) + (1 - px) 2 = 1; но так как,
p2x + 2px (1 - px) = Ax,
1 - px = ![]() и
и
px = 1 - ![]() ,
,
где Px - частота гена;
Аx - частота антигена.
Определенная по формуле частота гена должна быть проверена путем сравнения наблюдаемого в выборке распределения гомо - и гетерозиготных индивидуумов с теоретически рассчитанной в соответствии с законом Харди-Вайнберга.
Достоверность различий в частоте встречаемости антигенов у больных туберкулезом и здоровых людей русской национальности, проживающих в Челябинской области, рассчитывается согласно критерию Пирсона:
 ,
,
где N - это число обследованных в двух сравниваемых группах;
а - число индивидуумов несущих исследуемый антиген среди больных туберкулезом;
в - число индивидуумов не несущих исследуемый антиген среди больных туберкулезом;
с - число индивидуумов несущих исследуемый антиген среди здоровых русских;
d - число индивидуумов, не несущих исследуемый антиген среди здоровых русских.
Важным элементом популяционного анализа являются гаметные ассоциации, которые учитывают разницу в теоретически определенной ассоциации между 2-я антигенами разных локусов и истинной ассоциацией, встречающейся в популяции. К необходимости введения данного показателя приводит рассуждение: если бы аллели исследуемых локусов встречались независимо друг от друга, часть их ассоциаций на хромосоме (гаплотип) определялась бы произведением Р1×Р2, где Р1 и Р2 - частота соответствующих генов. Однако в популяции частота отдельных аллелей встречаются более часто или наоборот, более редко, чем это следует из теоретического расчета, то есть данные гены находятся в состоянии неравновесного сцепления (linkage disequilibrium), которое измеряется величиной Δ, отражающее превышение или дефицит гаплотипа в популяции по сравнению с произведением частот двух генов.
Величина Δ подсчитывается из ''сетки'' 2×2 по формуле (P. Mattiusi 1970г)
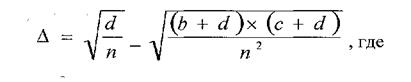
n - число обследованных в выборке
b - число индивидуумов несущих X и не несущих Y
с - число индивидуумов несущих Y, но не несущих X
d - число индивидуумов не несущих ни X ни Y.
Приведенная формула входит составной частью в формулу, используемую для определения частоты гаплотипа в панмиктической популяции
H XY = (PX × PY ) + Δ X,Y ,
где РX и РY - равны частоте соответствующих генов
ΔX,Y - гаметная ассоциация между генами соответствующими генами.
Для определения частоты трехлокусных гаплотипов методом максимального правдоподобия (maximum-liekelihood) использовалась компьютерная программа "Арлекин", версия 3.1
2.2 Результаты собственных исследований
2.2.1 Анализ распределения частот генов и антигенов HLAII класса у больных туберкулезом представителей русской национальности, проживающих в Челябинской области
В результате проведенного исследования были выявлены основные черты иммуногенетического профиля HLA локусов DR, DQB, DQA у больных туберкулезом русской национальности (рисунок 6, приложения). Анализ распределения аллелей данных локусов представлен в таблице 5.
Таблица 5. Распределение частот генов и антигенов HLAII класса
у больных туберкулезом
| HLA | Больные туберкулезом | ||
| N = 51 | Ax% | Рx% | |
| DR 1 | 14 | 27,45 | 0,15 |
| DR 3 | 8 | 15,69 | 0,08 |
| DR 4 | 12 | 23,53 | 0,13 |
| DR 7 | 15 | 29,41 | 0,16 |
| DR 8 | 3 | 5,88 | 0,03 |
| DR 9 | 2 | 3,92 | 0,02 |
| DR 10 | 0 | 0 | 0,00 |
| DR 11 | 9 | 17,65 | 0,09 |
| DR 12 | 1 | 1,96 | 0,01 |
| DR 13 | 11 | 21,57 | 0,11 |
| DR 14 | 2 | 3,92 | 0,02 |
| DR 15 | 12 | 23,53 | 0,13 |
| DR 16 | 7 | 13,73 | 0,07 |
| DQA 101 | 16 | 31,38 | 0,17 |
| DQA 102 | 19 | 37,25 | 0,21 |
| DQA 103 | 8 | 15,67 | 0,08 |
| DQA 201 | 15 | 29,41 | 0,16 |
| DQA 301 | 14 | 27,45 | 0,15 |
| DQA 401 | 3 | 5,88 | 0,03 |
| DQA 501 | 20 | 39,21 | 0,22 |
| DQA 601 | 0 | 0 | 0,00 |
| DQB 201 | 20 | 39,22 | 0,22 |
| DQB 301 | 15 | 29,41 | 0,16 |
| DQB 302 | 9 | 17,65 | 0,09 |
| DQB 303 | 4 | 7,84 | 0,04 |
| DQB 401/2 | 3 | 5,88 | 0,03 |
| DQB 501 | 13 | 25,49 | 0,14 |
| DQB 502/4 | 7 | 13,73 | 0,07 |
| DQB 503 | 2 | 3,92 | 0,02 |
| DQB 602/8 | 19 | 37,25 | 0,21 |
| DQB 601 | 1 | 1,96 | 0,01 |
Как видно из таблицы, для больных туберкулезом характерна относительно высокая частота антигенов DR 1 (27,45%), DR 7 (29,41%). С низкой частотой встречались DR 8 (5,88%), DR 9 (3,92%), DR 12 (1,96%), DR 14 (3,92%). Антиген DR 10 у больных туберкулезом обнаружен не был.
Самыми распространенными аллелями локуса HLA DQA у больных туберкулезом являются DQA 101 (31,37%), DQA 102 (37,25%), DQA 501 (39,22%). Наиболее низкие частоты имеет DQA 401 (5,88%).
Среди аллелей локуса HLA DQB у больных туберкулезом Челябинской области преобладающими являются DQB 201 (39,21%), DQB 602/8 (37,25%), DQB 501 (25,49%). Редкими являются аллели DQB 303 (7,84%), DQB 401/2 (5,88%), DQB 503 (3,92%), DQB 601 (1,96%). В целом такое распределение типично для большинства популяций европеоидной расы.
2.2.2 Анализ распределения частот генов и антигенов HLAII класса в популяции русских Челябинской области
В результате проведенного исследования были выявлены основные черты иммуногенетического профиля HLA локусов DR, DQB, DQA у здоровых доноров областной станции переливания крови русской национальности, проживающих в Челябинской области. Анализ распределения аллелей данных локусов представлен в таблице 6.
Таблица 6. Распределение частот генов и антигенов HLAII класса
у здоровых русских, проживающих в Челябинской области
| HLA | Здоровые русские | ||
| N = 202 | Ax% | Рx% | |
| DR
8-09-2015, 20:04 Разделы сайта | |||
