Ці субодиниці клітинної стінки є характерним елементом поверхні більшості грамнегативних бактерій [15].
За розміром і періодичністю розташування виявлені відростки відповідають трубчастим відросткам, детально описаним на поверхні елементарних тілець збудника міненгопневмонії. Трубчасті відростки завдовжки 35-40 нм і діаметром 5-6 нм проходять, згідно моделі Matsumoto [16], через отвори в клітинній стінці - «розетки» - і кріпляться до цитоплазматичної мембрани у області В-структур - своєрідних вп'ячування цієї мембрани.
Кільцеподібні структури на поверхні елементарних тілець відповідають «розеткам». Модель Matsumoto була побудована на підставі вивчення за допомогою різних методів (негативного контрастування, заморожування - труять, спеціальних обробок ультратонких зрізів очищених препаратів елементарних тілець [16].
Трубчасті відростки є і у ретикулярних тілець [15]. У збудника менінгопневмонії їх діаметр 10-13 нм. Розміри розеток: зовнішній діаметр 17-18 нм, внутрішній 14-15 нм. Максимальне число їх спостерігається через 10 г після зараження L-клітин ( приблизно 45), а за тим поступово зменшувалося до 20 через 20 г після зараження. Розетки на клітинній стінці розташовуються або 1-2 групами, або безладно по всій поверхні (особливо для ранніх ретикулярних тілець).
Роль описаних відростків в прикріпленні хламідій поки встановити не вдалося, але на думку Matsumoto вони можуть служити своєрідним каналом, що зв'язує цитоплазми хламідій і клітини-хазяїна для транспорту метаболітів [13]. Можливо відростки елементарних тілець схожі до фімбрій бактерій.
Отже поверхня клітинної стінки хламідій утворена округлими субодиницями діаметром 4 нм, виявлені відростки і кільцеподібні структури, через які вони проходять, і розташовані вони в гексагональній упаковці.
4. Характеристика метаболізму та життєвий цикл хламідій
4.1 Характеристика метаболізму хламідій
Як вже згадувалось, хламідії, як енергетичні паразити живих епітеліальних клітин, використовують для свого метаболізму їх АТФ. В даний час аналіз генома показав, що хламідії здатні синтезувати АТФ, хоч і в незначних кількостях, шляхом гліколізу і розщеплювання глікогену [4].
Як було виявлено Weiss і співавт. (1964), у хламідій спостерігається анаеробний метаболізм глюкози, що проходить по шляху пептозофосфату і одного з гліколітичних шляхів. Тобто, при додаванні кофакторів яких вони потребують, хламідії можуть метаболізавати глюкозу, а також піровиноградну і глутамінову кислоти [7].
Ця активність здійснюється на низькому рівні і за цих умов приводить до втрати АТФ і НАД. Система транспорту електронів відсутній, хоча обидві частинки містять цитохром С-редуктазу. Макромолекулярний синтез клітин хазяїна гальмується хламідіями, і високоенергетичні субстанції кліток хазяїна переходять на синтез протеїнів і ліпідів хламідій. Таким чином, забезпечення мікроорганізму метаболітами здійснюється в основному за рахунок життєдіяльності клітин хазяїна. Деякі з цих метаболітів (ізолейцин) можуть бути інгібіторами зростання хламідій і, ймовірно, можуть мати відношення до латентної течії при хламідіозі [Hatch, 1975] [2].
Як яскравий приклад метаболічної активності хламідій і впливу на метаболізм клітин хазяїна є дослідження Харківського ПІІ дерматології і венерології на споживання глюкози клітинами [17]. Досліди проводили на зараженій культурі клітин L-929. Утилізація глюкози інфікованою культурою достовірно вище протягом всього процесу культивування. Оскільки в інфікованій культурі інтенсивне зростання кліток не відбувається, можна припустити, що збільшення споживання глюкози кліткою пов'язано з цитоплазматичним включенням, що розвивається, тобто хламідійною інфекцією [18]. Через 5 г після зараження, коли фагосома з елементарних тілець (ET) переміщається в пластинчастий комплекс і ЕТ перетворюється на ретикулярні тільця (РT) через проміжні тільця (PT), споживання глюкози клітками культури більш ніж в 7 разів вище, норми. Можливо, в цей період активізуються біосинтетичні процеси клітини-хазяїна, продукти яких будуть використані збудником на побудову включення.
Згідно з літературними даними [19], починаючи з 10-12 г після впровадження збудника і до 36 г РT, зазнає 10-11 поділень, при цьому утворюється пул кліток, що є цитоплазматичним включенням. Звичайно цей процес закінчується до 24 г. Можливо, достовірне зниження споживання глюкози інфікованою клітиною, яке більш ніж в 4 рази вище в порівнянні з нормою, в цей період пов'язано з уповільненням її метаболічній активності при швидкому зростанні морфологічних структур збудника.
Можна припустити, що перетворення метаболічно активних РT в неактивні ЕТ, як правило, що завершується до 48 г, супроводжується розкріпаченням власних метаболічних процесів, клітини, і, як наслідок, спостерігається тенденція до збільшення споживання глюкози [18].
До 72 г цикл розвитку хламідій завершується. При мікроскопуванні препаратів спостерігали зрілі бочкоподібні включення збудника, що займають практично весь об'єм клітини. Значна частина моношару зруйнована, вміст глюкози в середовищі збільшений. І не дивлячись на це, споживання глюкози інфікованою клітиною в цей період в 3 рази вищий, норми.
Таким чином встановлено, що споживання глюкози інфікованою кліткою впродовж всього циклу розвитку збудника достовірно вищий, ніж у нормі. Спостерігаються певні кореляційні залежності між стадіями розвитку збудника і споживанням глюкози інфікованою кліткою.
Також проводилися дослідження синтезу білка в клітинах хазяїна по активності трансаміназ. Активність аланіномінотрансферази (AлT), аспартатаминотранферази (AсT) визначали по методу С. Райтмана, С. Френкеля (1957).
Так, до 24 г активність обох трансфераз у сфері культивування нормальних клітин достовірно збільшилася (AсT - в 4 рази, АлТ-в 8 разів) і залишилася на досягнутому рівні весь період, що залишився. Можна припустити, що інтенсифікація діяльності ферментів до 24 г культивування пов'язана з посиленим утворенням амінокислот в ході реакцій трансамінування, які використовуються як субстрат при синтезі білкових молекул в культурі, що активно ділиться (експоненціальна фаза зростання). До 72 г розвиток клітин в культурі виходить на плато. Крім того, спостерігається деяка тенденція до зниження активності ферментів [17].
Через 24 г після інфікування не було відмічено достовірних відмінностей між активністю ферментів в середовищі культивування нормальних клітин і в середовищі культивування інфікованих клітин, тоді як у всіх інших часових інтервалах активність ферментів в середовищі культивування інфікованих клітин була достовірно вища. Відносно низька активність ферментів в середовищі інкубації інфікованої культури клітин через 24 г може свідчити, про те, що амінокислоти інтенсивно включаються в синтез білка, і немає сенсу здійснювати ширше їх використання для інших цілей [18]. Разом з тим в період від 24 до 48 г культивування активність AлT і AсT збільшувалася майже в 2 рази, причому в цей період вона вища, ніж в нормі, відповідно в 2,9 і 3,5 рази. Це може бути пов'язане з інтенсифікацією процесу глюконеогенезу в інфікованій культурі. Дійсно, згідно з літературними даними [19]. саме у цей період завершується ділення РT, починається їх перетворення в ЕТ, а при мікроскопуванні в інфікованих клітках виявили гранули глікогену. Іншою причиною такого швидкого зростання активності ферментів в середовищі може бути збільшення проникності мембран інфікованої клітки.
До 72 г активність AлT зростає ще в 2,1 рази, в цей період вона вища, ніж в нормі, в 6,7 рази, AсT, відповідно, - в 5,6 рази. У цей період закінчується цикл розвитку хламідій, клітини руйнуються і росте вміст ферменту і середовища [17].
Таким чином, виявлені достовірні відмінності у ферментативній активності клітин нормальної і інфікованої культур. Показано, що активність ферментів в середовищі культивування інфікованих кліток збільшується в процесі дослідження, що корелює з циклом розвитку збудника [17].
Деякі факти, виявлені в ході дослідження, не знайшли свого пояснення у зв'язку з тим, що хламідії в процесі пристосування до внутріклітинного паразитизму виробили унікальні структури і біосинтетичні механізми, що не мають аналогів у інших бактерій. Не пояснений той факт, що у хламідій не виявлений висококонсервативний ген Ftsz, абсолютно необхідний для клітинного ділення всіх прокаріот, оскільки він відповідальний за утворення клітинної перегородки під час ділення клітки. У хламідії відсутній пептидоглікан - компонент клітинної стінки існує як у грампозитивних, так і у грамнегативних бактерій, але при цьому в геномі містяться гени, що кодують білки, які необхідні для його повного синтезу. Передбачається, що пептидоглікан, що синтезуються, або пептидогліконовий компонент мають інші функції, відмінні від інших бактерій [4].
4.2 Життєвий цикл хламідій всередині зараженої клітини
Зрілою формою збудника хламідіозу є спороподібне ЕТ з діаметром 250-300 нм, що володіє інфекційністю і обмеженою метаболічною активністю.
Ретикулярні тільця утворюються в процесі розмноження мікроорганізму всередині клітини-хазяїна, є попередником нового покоління ЕТ і є вегетативною формою хламідії. У протилежність ЕТ - вельми лабільні, неінфекційні і володіють вираженою метаболічною активністю. Проміжні тільця утворюються на двох стадіях циклу розвитку хламідій: на ранній, при перетворенні ЕТ в РT, і на пізніше, при реорганізації РT в ЕТ .
Цикл розмноження хламідій - облігатних внутріклітинних паразитів - реалізується при їх взаємодії з чутливою клітиною-хазяїном.
Схематично і спрощено основні морфологічні етапи цього циклу представлені на (рис.4.2.1). Інфекційні ЕТ адсорбуються на поверхні клітини, яка потім поглинає їх шляхом ендоцитозу. Доля фагоцитованих ЕТ на цьому першому критичному етапі взаємодії з клітиною-хазяїном може скластися двояко:
• EТ гине під впливом лізосомної активності клітини-хазяїна
• ЕТ зберігає життєздатність і вступає в цикл розвитку [5].
Рисунок 4.2.1 - Схема циклу розвитку хламідій в чутливій клітині: (Шаткін А.А., Мавров І.І., 1983) [5]
Хламідії здатні якимсь чином стимулювати специфічний фагоцитоз, що дає очевидні переваги облігатному внутріклітинному паразиту. Проникнення елементарних тілець в клітину супроводжується руйнуванням оболонок, внаслідок чого відбувається розм'якшення клітинних стінок. Присутність інфекційних частинок у фагосомі не супроводжується розщеплюванням лізосом, як при звичайному фагоцитозі. Цей процес управляється самими хламідіями, оскільки показано, що якщо в результаті фагоцитозу захоплюються хламідії, убиті нагріванням, то злиття лізосом не відбувається [Friis, 1972]. Неспеціалізовані клітини (не здібні до активного фагоцитозу) стимулюються хламідіями так, щоб вони їх захоплювали [Byrne, Moulder, 1978] [2].
Можна виділити 4 основних шляхи, по яких можуть реалізуватися подальші етапи взаємодії хламідій з клітиною-хазяїном (Шаткін А.А., Мавров І.І., 1983) [19]:
· Деструкція хламідії в фаголізосомній системі клітини-хазяїна
· Продуктивний цикл розвитку хламідій - репродукція
· L-подібна трансформація хламідій
· Персистенція хламідій.
Через 4-6 годин після зараження ЕТ [5], елементарні тільця розташовуються у вакуолі, оточеною деріватною мембраною, що захищає їх від дії лізоцимів. На відміну від вірусів хламідії не мають екліпсо-фази []. Деструкції, що далі не піддалися, в сприятливих умовах функціонування клітки-господаря, вступають в цикл розвитку, який протікає по відомій схемі: ЕТ реорганізуються у вегетативну форму - РT (через ПT); РT вступають в клітинний цикл, діляться бінарно (всього 8-12 циклів); дочірні РT перетворяться в ПT і далі в ЕТ- інфекційні форми нового покоління мікроорганізму. Цикл розвитку звичайно займає 48-72 години.
Вегетативну стадію в циклі розвитку хламідії, зокрема ділення і реорганізацію РT, можна розглядати як другий критичний етап взаємодії паразита і хазяїна. РT високочутливі до несприятливих екзогенних (наприклад, антибактеріальні препарати) і ендогенних дій, які можуть зумовити загибель паразита, що розмножується. В той же час антибіотики практично не діють на інфекційні ЕТ [20].
За несприятливих умов, на етапі функціонування РT, в цитоплазматичному включенні можуть бути виявлені аномальні форми хламідій з різними дефектами клітинної стінки. Ці утворення, морфологічно схожі з L-формами бактерій, закономірно утворюються під впливом тих, що традиційних трансформують агентів - Пеніциліну і ін. (Matsumoto A. et al., 1970). L-подібна трансформація хламідії може бути основою одного з механізмів, що індукують виникнення персистентної хламідійної інфекції, при безсимптомному перебігу яких спостерігається тривале перебування хламідій в клітині-хазяїна (Шаткін А.А., Попов В.Л., 1986).
Персистенція хламідій може спостерігатися при всіх відомих хламідіозах і у ряді випадків має надійне мікробіологічне підтвердження. Проте знання про цей шлях взаємодії паразита з хазяїном вкрай обмежені [5]. Схематично цей шлях з боку господаря може бути пов'язаний з нездатністю забезпечити відтворення паразита необхідними метаболітами і / або використанням обмежених механізмів захисту, здатних лише інгібірувати розмноження, але не елімінувати патогенний агент. Як і інші шляхи взаємодії, персистенція хламідій поза сумнівом контролюється імунною системою. Відомо, що лімфоцити від імунних тварин оберігають персистентно інфіковані макрофаги від активації хламідійної інфекції. Відома і активна течія і генералізує локалізованих експериментальних хламідійних інфекцій у іммуносупресованих тварин. Активний розвиток цього напряму досліджень є одним з актуальних завдань хламідіологів [2].
В процесі взаємодії з хламідією клітина-хазяїн піддається дії її чинників патогенності, що викликають різні порушення життєдіяльності клітки. При продуктивному циклі розвитку хламідій в клітині-хазяїна послідовно пригнічуються життєві функції, що приводять до її загибелі і руйнування. Цей результат, як правило, наступає в період завершення циклу розвитку хламідій. Суть подій, що протікають в клітині-хазяїна при L-подібній трансформації і персистенції хламідій, залишається нерозкритою. Функціонально в цих ситуаціях реалізується часовий збалансований стан, результат якого теоретично може бути на користь кожного із співчленів цієї системи.
Доля паразита і клітина-хазяїна при різних шляхах взаємодії в умовах природної інфекції багато в чому залежить від подій, що протікають на рівні макроорганізму. У цих умовах виявляються особливості паразитизму хламідій, характерні для внутріклітинних прокаріотів:
• Здатність індукувати фагоцитоз
• Протистояти деструктивній дії клітини- хазяїна
• Розмножуватися в клітині- хазяїна і тривалий час не викликати фатальних патологічних зміні
• У несприятливих умовах переживати або гинути під впливом клітини- хазяїна або екзогенних чинників [5].
4.3 Процес виходу хламідій із інфікованої клітини
На кінцевих стадіях циклу розвитку внутрішньо цитоплазматичне включення може займати велику частину цитоплазми клітини-хазяїна. За цим слідує вихід нових елементарних тілець. На підставі досліджень інституту мікробіології і епідеміології ім. Н. Ф. Гамалєї в Москві вивчені процеси виходу хламідій з клітини.[21]
Незаражені L-клітини мають ветереноподібну або округлу форму (рис.4.3.1-а, б):
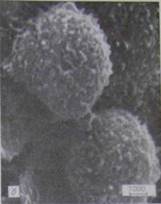
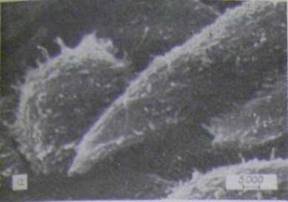
Рисунок 4.3.1 - Форма незаражених клітин: а - веретеноподібна, б -округла [21]
Їхня поверхня була рівномірно покрита мікроворсинками. У культурі, інфікованій хламідіями, через 24 і 48 г після спряження на поверхні клітин, також спостерігали адсорбований, жовтуватий матеріал. Хламідій на поверхні клітин через 24 г ідентифікувати не вдавалося.
Інфіковані хламідіями клітини через 48 г після зараження були в основному округлими, структура їх поверхні була змінена - вона характеризувалася невеликою кількістю мікроворсинок і значною складчастістю (див. рис. 4.3.2 - в,г).
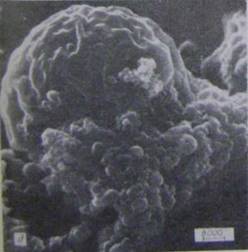
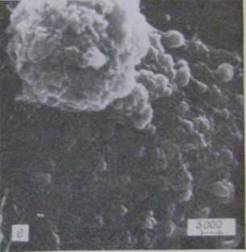
Рисунок 4.3.2 - Інфіковані хламідіями клітини: г, д [21]
У цих культурах спостерігали два способи виділених хламідій в зовнішнє середовище: 1-й - шляхом активного викиду, мабуть, при локальному розриві клітини-хазяїна (див. малюнок в);при цьомувміст включення викидався на досить значну відстань і міг потрапляти на поверхню сусідніх клітин; 2-й - шляхом спокійнішого «виверження» з розриву в плазмалемі (див. рис. 4.3.3 - е);
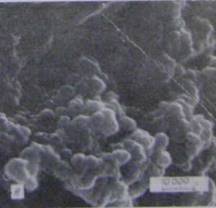 Рисунок 4.3.3 - Виверження хламідій із розриву в плазма лемі: е [21]
Рисунок 4.3.3 - Виверження хламідій із розриву в плазма лемі: е [21]
При цьому розриви мали неправильну форму. У виділених масах знаходилися структури, за розміром що відповідали ретикулярним і елементарним тільцям. Елементарні тільця були завжди округлої форми, а ретикулярні (вегетативні форми) могли мати вигини або навіть трохи химерну форму (див. малюнок 2-г), що, мабуть, свідчило про пластичність останніх. Деякі ретикулярні тільця мали пальцевидні виростки, що розташовувалися уздовж поверхні (див. малюнок, г, стрілка), ймовірно, відповідають виростам клітинної стінки, що спостерігається в ультратонких зрізах [5]. Вегетативні форми могли бути об'єднані в групи по 3 - «тріади» (див. рисунок е). Зустрічалися також подовжені вегетативні форми із стисненням (борозною) в середній частині, що, мабуть, свідчило про їх ділення (див. рисунок е).
Аналізуючи результати досліджень, можна зробити такі виводи:
1. При спостереженні в скануючому електронному мікроскопі виявлені два способи виходу хламідій з інфікованих кліток шляхом активного викиду, мабуть, при локальному розриві клітини-хазяїна і шляхом спокійнішого "виверження" з розриву в плазмалемі.
2. Елементарні тільця хламідій, що вийшли з клітини, мали сферичну форму, ретикулярні - нерегулярно-сферичну: з заглибленнями і пальцевидними виростами [21].
5. Епідеміологія хламідіозів
Хламідії, мабуть, є найбільш поширеними з патогенних бактерійних мікроорганізмів. Вони можуть бути причиною різноманітних захворювань приблизно 200 видів теплокровних тварин, а також риби, амфібій, молюсків і членистоногих. Головні господарі хламідій серед хребетних -людина, інші ссавці, птахи [7].
C. psittaci об'єднує первинні патогени тварин - збудники зоонозних хламідіозів (орнітоз птахів; аборти, пневмонії, гастроентерити, артрити, офтальмії, енцефаліт ссавців і ін.), що передаються людині. Елементарні тільця C. psittaci містяться у фекаліях, сечі, виділеннях з сечостатевих органів, м'ясі і молоці хворих тварин. Описані одиничні випадки передачі інфекції від хворої людини здоровому в лікарняних умовах (Покровській В.І. і співавт., 1982). Повітряно-краплинне інфікування хламідіями при орнутозі наочно продемонстровано випадками групових заражень від качок і курчат-бройлерів (Терськіх І.І., Дєвкіна Н.В., 1990).
С. рпеumоniaе - новий вигляд хламідії, офіційно визнаний в 1989 р. (Grayston J. et al., 1989). Він об'єднує первинні патогени людини - збудники респіраторної патології. Провідна форма захворювання -дрібнокрокова, або інтерстиційна, пневмонія - вперше виявлена у Фінляндії [4].
Захворювання передається повітряно-краплинним, хоча епідеміологія цієї інфекції підлягає подальшому вивченню. Хламідійні пневмонії зустрічаються в різних кліматичних зонах: від Фінляндії до Тайваню [8]. Можливо, що саме цей вид хламідії викликав в 1983 р. в Ленінграді гостру пневмонію у осіб, що не мали професійного контакту з птахами і сільськогосподарськими тваринами (Ільін І.І. і співавт., 1993). Недавно одержані відомості про
8-09-2015, 23:16
