На правах рукописи
ЕФРАТОВА Елена Сергеевна
ПАТОГЕНЕТИЧЕСКОЕ ЗНАЧЕНИЕ СУБПОПУЛЯЦИЙ
ЛИМФОЦИТОВ ПРИ ГЕМОРРАГИЧЕСКОЙ
ЛИХОРАДКЕ С ПОЧЕЧНЫМ СИНДРОМОМ
14.00.10 – Инфекционные болезни
14.00.36 – Аллергология и иммунология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата
медицинских наук
Санкт-Петербург - 1998
Работа выполнена в Самарском Государственном Медицинском
Университете
Научный руководитель:
доктор медицинских наук, профессор Рощупкин В.И.
Официальные оппоненты:
доктор медицинских наук, профессор Подлевский А.Ф.
доктор биологических наук Полевщиков А.В.
Ведущая организация: Санкт-Петербургский государственный медицинский университет имени академика И.П.Павлова.
Защита диссертации состоится “_______________” 1998 года в “___” часов на заседании диссертационного совета Д 106.03.05 в Военно-медицинской академии (194044, Санкт-Петербург, ул. Лебедева, д.6)
С диссертацией можно ознакомиться в фундаментальной библиотеке Военно-медицинской академии.
Автореферат разослан “___” _______________ 1998 года
Ученый секретарь диссертационного совета Ляшенко
доктор медицинских наук, профессор Юрий Иванович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ. Борьба с вирусными инфекциями входит в разряд одной из наиболее актуальных проблем современной медицины. Особую категорию данных заболеваний составляют зоонозные инфекции, имеющие определенные ареалы распространения в дикой природе. К их числу относится геморрагическая лихорадка с почечным синдромом (ГЛПС) - эндемичное для Средневолжского региона заболевание, вызываемое представителями рода хантавирусов и проявляющееся у человека в форме остро протекающей инфекции с признаками острой почечной недостаточности (ОПН) и выраженных геморрагических проявлений (В.И.Рощупкин, А.А.Суздальцев, 1990). Учитывая возможность тяжелого течения заболевания, поражающего наиболее трудоспособную возрастную категорию населения, трудности проведения интенсивной терапии при коррекции тяжелой почечной недостаточности, неоднозначный подход к целесообразности глюкокортикостероидной терапии, выбранная тема исследований является актуальной.
Основополагающими в генезе ОПН при ГЛПС в настоящее время признаны иммунопатологические механизмы (В.И.Рощупкин, 1969; А.А.Суздальцев, Л.Н.Еланская, Л.Н.Новомлинцева, 1988; E.J.Joiken, J.Lahdevirta, J.Collan, 1978). Механизмы почечной недостаточности при ГЛПС В.И.Рощупкин (1968 г.) в своей гипотезе аутоиммунного повреждения объяснил как проявления гуморального иммунного ответа, направленного против продуктов деструкции тканей, развивающейся под действием вируса. Данные о значении гуморального типа иммунного реагирования при ГЛПС подтверждаются результатами исследования В-системы лимфоцитов, дающей значительную динамику в ходе указанной инфекции (О.А.Алексеев, 1990; Ф.С.Жарская, 1987; R.M.Lewis, H.W.Lee, A.F.See et al., 1991). Сведения о состоянии Т-клеточного ответа при ГЛПС весьма скудны и подчас исследования проводились недостаточно совершенными методами (Л.Н.Новомлинцева, 1984; Ф.С.Жарская, О.А.Конева, 1985; Q.Gao, X.N.Wang, 1989; C.Huang, B.Jin, M.Wang et al., 1994). Имеются в научной литературе и сведения о роли отдельных субпопуляций лимфоцитов/макрофагов крови в иммунном ответе при ГЛПС (Г.А.Мавзютова, 1996; M.Linderholm, L.Bjermer, P.Juto et al, 1993; A.Markotic, S.Rabatic, A.Gagro et al., 1998). Однако патогенетическое влияние данных клеток на продолжительность и тяжесть течения инфекционного процесса, зависимость от периода заболевания не нашло в них достаточного отражения, что подчеркивает актуальность проведенного нами исследования.
В данной работе основным объектом изучения служат лимфоидно-макрофагальные клетки крови больных ГЛПС, а выполнена она с точки зрения клинико-лабораторного иммунологического исследования. Это научное направление - клиническая иммунология - чрезвычайно бурно развивается в последние годы и у нас в стране и за рубежом. Его актуальность подтверждается большим монографическим материалом, подчеркивается в работах ведущих иммунологов последних лет (Р.В.Петров с соавт., 1982, Р.И.Сепиашвили с соавт., 1997, J.Brostoff et al., 1994, I.Roitt et al., 1996).
Определенную значимость проблеме придают методические подходы к ее выполнению. В последние годы разработаны довольно точные и высокоспецифичные методы определения количественного состава субпопуляций лимфоцитов/макрофагов в крови больных с различными заболеваниями иммунопатологического генеза (Р.М.Хаитов с соавт., 1986, 1995, А.Н.Чередеев, Л.В.Ковальчук, 1997). Иммунодиагностическое значение использования подобных современных методик при вирусных инфекциях, в частности, ГЛПС, делает работу актуальной в методическом плане.
ЦЕЛЬ РАБОТЫ. Определить иммунодиагностическую и прогностическую значимость динамики изменений со стороны субпопуляционного состава лимфоцитов/макрофагов в крови больных ГЛПС в соответствии с периодами заболевания, степенью его тяжести и применением глюкокортикостероидных препаратов.
ЗАДАЧИ ИССЛЕДОВАНИЯ:
1. Провести группировку клинических, клинико-лабораторных и биохимических признаков у больных ГЛПС в соответствии с периодами и фазами заболевания, степенью тяжести и применением глюкокортикостероидных препаратов.
2. Определить общий характер изменений со стороны субпопуляций лимфоцитов/макрофагов крови при ГЛПС, а также возможность влияния пола и возраста больных на иммунологические показатели.
3. Определить динамику иммунологических сдвигов, их специфичность при ГЛПС и соответствие клиническим признакам при легкой, среднетяжелой (с применением и без применения кортикостероидных препаратов) и тяжелой (с применением и без применения кортикостероидных препаратов) формах заболевания.
4. Подтвердить иммунодиагностическую значимость выявленных изменений при ГЛПС в зависимости от периода, степени тяжести заболевания и особенностей лечения.
5. Определить прогностические критерии динамики изменений иммунного статуса для развития неблагоприятных и осложненных форм течения ГЛПС.
НАУЧНАЯ НОВИЗНА. - Впервые проведено изучение субпопуляционного состава лимфоцитов/макрофагов в крови больных ГЛПС путем детального анализа его соответствия отдельным периодам в течении заболевания; определены закономерности динамики иммунологических сдвигов;
- установлена зависимость динамики иммунологических сдвигов от степени тяжести заболевания;
- выявлены варианты иммунологической перестройки организма больного при ГЛПС в соответствии с особенностями индивидуального иммунного реагирования;
- определены специфические для ГЛПС иммунодиагностические признаки;
- разработаны иммунодиагностические критерии оценки патогенеза ГЛПС у больных с разной степенью тяжести заболевания и формой иммунного реагирования;
- разработаны иммунопрогностические критерии неблагоприятного течения и развития осложненных форм ГЛПС;
- разработаны иммунологические показания и противопоказания для назначения кортикостероидных препаратов при тяжелых формах ГЛПС.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ.
1. Обосновано использование в лабораторной диагностике при ГЛПС методов определения субпопуляционного состава лимфоцитов/макрофагов в крови больных.
2. Установлены иммунодиагностические критерии развития инфекционного процесса при ГЛПС в соответствии с периодами, фазами и степенью тяжести заболевания.
3. Определены критерии дифференциальной диагностики ОПН вирусного и токсического генеза.
4. Разработаны схемы иммунопатогенеза для легкого, среднетяжелого и тяжелого течения ГЛПС.
5. Выявлены иммунологические показания и противопоказания для назначения кортикостероидных препаратов при тяжелых формах ГЛПС.
Положения, выносимые на защиту:
1. Количественный состав и динамика изменений со стороны субпопуляций лимфоцитов/макрофагов в крови больных ГЛПС могут служить диагностическим и прогностическим критерием развития различных клинических форм ГЛПС.
2. Оценка количественного состава и динамики изменений субпопуляционного состава лимфоцитов/макрофагов крови при ГЛПС требует учета индивидуальных особенностей иммунного реагирования организма больного.
3. Оценка количественного состава и динамики изменений со стороны субпопуляций лимфоцитов/макрофагов в крови больных ГЛПС помогает в выработке показаний и противопоказаний к назначению кортикостероидных препаратов.
РЕАЛИЗАЦИЯ И АПРОБАЦИЯ РАБОТЫ
По теме диссертации опубликовано 13 работ, все в центральной печати. Материалы исследований были доложены на заседании Областной ассоциации инфекционистов (Самара, 1997г.), на 1-ой и 2-ой Национальных конференциях Российской Ассоциации Аллергологов и Клинических иммунологов (Москва, 1997, 1998), на итоговой научной конференции профессорско- преподавательского состава военно-медицинского факультета СамГМУ (Самара, 1997г.), итоговой годичной конференции центральной научно-исследовательской лаборатории СамГМУ (Самара, 1997г.), на III (Израиль, 1997) и IV (Сочи, 1998) Международном конгрессах по иммунореабилитологии, на II республиканской научно-практической конференции (Ижевск, 1998).
Материалы работы включены в учебный материал для преподавания курса инфекционных болезней и микробиологии с иммунологией и вирусологией на соответствующих кафедрах Самарского государственного медицинского университета (СамГМУ). Иммунодиагностические и прогностические критерии, разработанные по ходу выполнения работы, используются в практике клиники инфекционных болезней СамГМУ и Самарского областного диагностического центра.
Первичная апробация диссертации проведена на совместном заседании кафедры инфекционных болезней, микробиологии с курсом клинической иммунологии и вирусологии СамГМУ.
ОБЪЕМ И СТРУКТУРА РАБОТЫ
Диссертация представлена на 177 страницах машинописного текста и состоит из введения; обзора литературы; главы, посвященной материалам и методам исследования; 3 глав собственных наблюдений; главы обсуждения полученных результатов; выводов; практических рекомендаций и указателя литературы. Работа иллюстрирована 27 таблицами, 60 рисунками. Указатель литературы включает 207 источников, из них 99 отечественных и 108 иностранных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
Всего обследовано 180 человек. Под наблюдением находилось 125 больных ГЛПС в возрасте от 15 до 68 лет. Большинство больных (76%) входили в возрастную группу до 45 лет. Среди обследованного контингента преобладали мужчины (83%). Отдельную группу составляли 11 пациентов с почечной недостаточностью неинфекционной (токсической) природы (группа сопоставления). В нее вошли больные с ОПН, развившейся вследствие интоксикации суррогатами алкоголя и наркотическими веществами, лекарственными препаратами и другими токсическими продуктами. В контрольную группу входили 44 клинически здоровых донора соответствующих возрастных групп.
Диагноз ГЛПС ставился на основании характерной клинической картины заболевания с учетом данных эпиданамнеза и лабораторных исследований. Серологическое подтверждение диагноза ГЛПС с помощью РНИФ в парных сыворотках проведено выборочно у 70 больных (56%).
Заболевание протекало в легкой форме в 35% случаев, в среднетяжелой – в 35% и тяжелой – в 30%. У 12% больных среднетяжелой формой и у 22% больных тяжелой формой в состав комплексной терапии входили глюкокортикостероидные препараты. Показаниями к назначению кортикостероидов (КС) при ГЛПС считалось течение заболевания с угрозой развития выраженной почечной недостаточности, затянувшимся олигурическим периодом, развитием инфекционно-токсического шока или выраженными менингоэнцефалитическими проявлениями (Г.С.Ковальский, Т.В.Ковальская, 1965, В.И.Рощупкин, А.А.Суздальцев, 1995).
При характеристике отдельных периодов болезни мы руководствовались классификацией В.И.Рощупкина (1970), согласно которой в течении болезни выделялись следующие периоды: начальный (1-3 день болезни), олигурический (с 2-4 по 8-11 день болезни), полиурический (с 7-13 по 15-22 день болезни) и реконвалесценции (до 30-35 дня с начала болезни). Согласно упомянутой классификации, в олигурическом периоде выделялась первая фаза (температура тела высокая, почечные проявления умеренно выражены) и вторая, когда температура тела чаще всего снижалась, а проявления почечного синдрома достигали максимума. Продолжительность первой (лихорадочной) фазы - со 2-3 по 6-7 дни болезни, второй (безлихорадочной) – до 10-11 дня болезни. В полиурическом периоде выделялась первая фаза, сопровождавшаяся высоким уровнем мочевины и креатинина сыворотки крови, и вторую (с 13-14 до 19-22 дня болезни), когда в большинстве случаев нормализовался уровень мочевины и креатинина, а выраженная полиурия еще сохранялась.
Оценка степени тяжести заболевания проводилась с учетом клинических и биохимических критериев (В.И.Рощупкин, 1969, Г.С.Ковальский, 1970). Для тяжелой формы ГЛПС характерны были высокая степень уремии (мочевина выше 19 ммоль/л, креатинин выше 300 мкмоль/л), снижение суточного диуреза менее 300 мл в сутки, геморрагические проявления в виде кровотечений и гематом различной локализации, макрогематурии, геморрагической сыпи (В.И.Рощупкин, 1969; J.V.Pether, G.Lloyd, 1993; B.Settergren, P.Juto, B.Trollfors et al., 1989). Нельзя не отметить, что существует ряд клинических признаков, уже в ранние сроки болезни предвещающих развитие тяжелых форм ГЛПС. К ним относятся мучительные боли в пояснице и животе; резкое снижение остроты зрения на фоне сильной головной боли, сухости во рту и жажды; упорная рвота; выраженный геморрагический синдром (А.А.Суздальцев, 1992), неврологическая симптоматика (O.A.Alexeyev, V.G.Morozov, 1995). Тахикардия и артериальная гипертензия (В.И.Рощупкин, А.А.Суздальцев, 1990) являются также прогностически неблагоприятными. Из лабораторных показателей тяжести заболевания следует отметить выраженный лейкоцитоз, массивную протеинурию, ранние проявления уремии (А.А.Суздальцев, 1992; B.Settergren, P.Juto, B.Trollfors et al., 1989). Среднетяжелая форма характеризовалась умеренными проявлениями уремии (мочевина от 8,5 до 19 ммоль/л, креатинин от 135 до 300 мкмоль/л) и геморрагического синдрома, диурез находился в пределах от 300 до 900 мл в сутки. Легкой форме соответствовали нормальные показатели мочевины и креатинина, отсутствие геморрагических проявлений, незначительное снижение суточного диуреза. У всех больных велось динамическое наблюдение за изменениями показателей общего анализа крови и мочи, суточного диуреза, проводились пробы по Зимницкому и Нечипоренко. В процессе наблюдения за больными особое внимание обращалось на наличие остаточных явлений в период реконвалесценции в виде стойкой артериальной гипертензии, затянувшейся гематурии, астеновегетативных проявлений и других клинических и лабораторных признаков.
Уровень мочевины в сыворотке крови изучался с помощью цветной реакции с диацетилмонооксином (В.В.Меньшиков с соавт., 1987, C.L.Crocker, 1967, W.Marsh et al., 1965), определение же креатинина в сыворотке крови проводилось по цветной реакции Яффе (В.В.Меньшиков с соавт., 1987, R.Richerich, 1969).
Все находившиеся под наблюдением лица были подвергнуты иммунологическому тестированию. С этой целью общепринятым методом центрифугирования в градиенте плотности фиколл-верографина (Pharmacia chemical, Uppsala, Sweden) проводилось выделение фракции лимфоцитов/макрофагов из периферической крови. Изучение субпопуляционного состава лимфоцитов крови объектов исследования осуществлялось иммуноферментным методом при помощи диагностического набора “Комплект моноклональных антител (МКА) для оценки иммунного статуса человека иммуноферментным методом” (НПО “Диагнотех”). Были использованы следующие МКА: DT-anti-CD3 (специфичность - зрелые Т-клетки); DT-anti-CD4 (Т-хелперы/индукторы); DT-anti-CD8 (супрессорные/цитотоксические Т-клетки); DT-anti-CD16 (NK-клетки, гранулоциты, макрофаги); DT-anti-CD22 (В-лимфоциты); DT-anti-HLA-DR (специфичность - мономорфная детерминанта антигенов гистосовместимости II класса). В качестве коньюгата использовался антимышиный иммуноглобулин, меченный ферментом пероксидазой.
Математическая и статистическая обработка полученных данных проводилась на персональном компьютере IBM AT с помощью пакета программ Microsoft Excel и пакета статистических программ SPSS, а также оригинальных авторских программ. С целью комплексной оценки субпопуляционного состава лимфоцитов/макрофагов крови был применен корреляционный и системный многофакторный анализ (М.В.Углова, Б.А.Углов, 1987).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Показатели субпопуляционного состава лимфоцитов/ макрофагов крови при ГЛПС.
В процессе проведения исследований было детально проанализировано содержание основных субпопуляций лимфоцитов/ макрофагов в крови больных ГЛПС, причем анализ показателей иммунного статуса осуществлялся в строгом соответствии с клиническими данными: учитывались степень тяжести, периоды и фазы заболевания, проведение гормонотерапии (последняя не использовалась при легком течении данной инфекции).
Динамика общего количества лимфоцитов и моноцитов в крови больных показала относительно малую диагностическую значимость данных показателей при ГЛПС. Было также установлено отсутствие достоверной половой и возрастной зависимости динамики иммунологических параметров при данном заболевании.
Более информативным оказался анализ содержания отдельных субпопуляций среди лимфоидно-макрофагальных клеток крови больных ГЛПС.
Динамика показателей для CD3-субпопуляции зависела от степени тяжести и периода развития ГЛПС. При легком течении ГЛПС изменений со стороны CD3- субпопуляции не наблюдалось. При среднетяжелом течении заболевания в олигурический период регистрировалось достоверное снижение показателя только в первую фазу (в 1,2 раза), если не применялись КС-препараты, и в обе фазы (в 1,3 раза) - на фоне КС-терапии. При тяжелом течении ГЛПС число CD3+-лимфоцитов уменьшалось во вторую фазу независимо от применения гормонов (в 1,3 раза).
CD4-субпопуляция в наибольшей степени проявляла зависимость от периода инфекционного процесса при ГЛПС. Снижение количества Т-хелперных клеток наблюдалось в олигурию при всех вариантах клинического течения данного заболевания. Наиболее значительным (в 1,2-1,8 раза) оно было при среднетяжелых формах. Переход заболевания в стадию полиурии сопровождался повышением этого параметра до нормальных цифр в большинстве случаев легких форм заболевания, при среднетяжелом течении последний оставался сниженным до окончания полиурического периода. Варианты тяжелого течения ГЛПС сочетались с низким количеством CD4+-клеток только в условиях гормонотерапии, тогда как у больных, не подвергавшихся КС-терапии, переход в стадию реконвалесценции характеризовался повышением содержания Т-хелперов в крови в 1,3 раза.
Величина падения уровня CD8+-клеток проявлялась по-разному при заболеваниях различной степени тяжести. Так, при легких и среднетяжелых вариантах течения изменения корригировались во вторую фазу полиурии. При тяжелых формах они были характерны, в основном, для олигурии (в 1,5 раза), а в стадию реконвалесценции в 1,6 раза превышали нормативы. Особенно четко эти изменения отмечались у пациентов в отсутствие гормонотерапии.
Средние показатели числа CD22+-клеток (неактивированных В-лимфоцитов) давали отклонение от нормальных величин, примерно соответствующее динамике предыдущего показателя. Отличие заключалось в некотором запаздывании нормализации данных при легком и среднетяжелом течении ГЛПС, в то время как при тяжелых формах заболевания содержание СD22-позитивных клеток соответствовало таковому в контрольной группе уже во вторую фазу полиурического периода.
Способность клеток лимфоидно-макрофагального ряда к экспрессии CD16 маркера также снижалась при ГЛПС на протяжении олигурического и полиурического периодов при всех формах заболевания, кроме тяжелого течения, когда, начиная со второй фазы полиурии, этот показатель превышал по значениям таковой у здоровых лиц в 1,7-2,3 раза.
Динамика содержания HLA-DR+-клеток в крови при ГЛПС в значительной мере повторяла изменения со стороны СD16-субпопуляции.
Учитывая тот факт, что содержание отдельных лимфоидно-макрофагальных клеток крови менялось в ходе ГЛПС в зависимости от стадии заболевания, степени тяжести инфекционного процесса и введения в схему лечения КС - препаратов, нами был проведен поиск такого принципа классификации данных, который в сочетании с корреляционным анализом результатов позволил бы более детально охарактеризовать участие отдельных CD- субпопуляций в реализации иммунного ответа. С этой целью нами была произведена оценка статистической значимости каждого из показателей содержания CD-субпопуляций в крови больных ГЛПС. В олигурический период заболевания отрицательную корреляцию с характерными биохимическими признаками ГЛПС – ростом уровня мочевины и креатинина сыворотки крови, проявил только один иммунологический показатель – число CD22+-клеток в крови больных. В результате этой и других серий статистических исследований было решено провести группировку показателей содержания CD-субпопуляций в крови больных ГЛПС соответственно трем интервалам значений для CD22+-клеток по шкале распределения частот: низкое (<21%), умеренное (21-32%) и высокое (>32%) содержание CD22+-лимфоцитов. Поскольку CD22-маркер экспрессируется только неактивированными В-клетками, за исходную гипотезу было принято предположение о том, что низкое содержание CD22+-лимфоцитов свидетельствует о выраженной активации этих клеток в ходе иммунного процесса, а высокое, наоборот, об их депрессивном состоянии.
![]()

![]()
![]()
 Анализ соотношения иммунологических показателей при легком течении ГЛПС.
Анализ соотношения иммунологических показателей при легком течении ГЛПС.

![]()
![]()
![]()

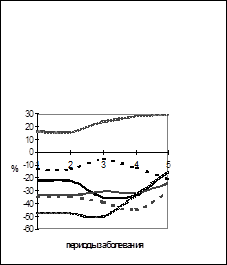 При легком течении ГЛПС (Рис.1) группировка данных в соответствии с количеством CD22+-клеток выявила гораздо больше различий между показателями, чем было зарегистрировано по всей совокупности данных. Высоких
При легком течении ГЛПС (Рис.1) группировка данных в соответствии с количеством CD22+-клеток выявила гораздо больше различий между показателями, чем было зарегистрировано по всей совокупности данных. Высоких
8-09-2015, 21:41
