Відставання СФВікКС найбільше було виражено в пацієнтів, які хворiють на ХП протягом 4-6 років, у порівнянні з групами, що мають більш-менш тривалі терміни хвороби (Р<0,01). Це свідчило про те, що в дітей із ХП у перші 6 років хвороби темпи розвитку КТ зменшувалися в зв'язку з перебігом патологічного ренального процесу, однак при більш тривалому терміну ХП на тлі збільшення віку і подальшого біологічного розвитку стан КТ поліпшувався.
Показник (ФКВ-НКВ), що характеризує темп кісткового формування, достовірно (Р<0,05) був нижче в дітей з обструктивною формою ХП, які раніше отримували тільки консервативну терапію, у порівнянні з хворими, котрі мали в анамнезі хірургічну корекцію зміненої уродинаміки. Спостерігалася тенденція до відставання темпів кісткового розвитку у дітей з обструктивними формами ХП стосовно необструктивних, а також у пацієнтів з рецидивуючим характером перебігу мікробно-запального процесу в нирках у порівнянні з латентним.
Також нами виявлені достовірні позитивні кореляційні залежності між рівнем ФР і показниками КВ (r=0,7, P<0,001), це ще раз підтверджувало високу значимість КВ в оцінці загального біологічного розвитку дитини.
Отримані дані при проведенні ультразвукової остеоденситометрії свідчили про достовірне зниження середніх значень усіх кісткових характеристик у дітей із ХП у порівнянні з дітьми КГ і ГП (Р<0,001 (ІМ, ШПУ); Р<0,05 (ШОУ)), що свідчило про виражені структурні зміни КТ, зменшення щільності, пружності та еластичності кістки, що призводять до зниження її міцності і підвищенню ризику розвитку ускладнень (кісткових переломів) у хворих на ХП. Зниження інтегрального показника, що характеризує всі СФВКТ - ІМ (%) - спостерігалося у 37,4 % дітей із ХП, при цьому у 5,4 % пацієнтів воно характеризувалося як остеопоротичне. Зниження ІМ спостерігалося від -1 до -29 %.
Виразність порушень СФВКТ у дітей із ХП залежала від календарного віку дитини, про що свідчили виявлені прямі кореляційні зв'язки. Параметр ШОУ характеризуючи мінеральний компонент кістки, мав більш тісний статистичний зв'язок з віком (r=0,47, P<0,001), ніж показник ШПУ (r=0,31, P<0,001), який визначає білково-органічну складову КТ. Параметр ІМ залежав від календарного віку (r=0,46, P<0,001) і найбільш часто його зниження відзначалось у пацієнтів у віці 9 - 10 років (у 60 - 57,2 % хворих), а також у 12 і 16 років (у 48,9 і 46,2 % дітей).
Вікова динаміка ІМ у дітей із ХП мала сходоподібний графік, внаслідок періодів відсутності річного збільшення показника з 9, 11 і 14 років, і періодів значного його приросту на рік – з 10, 12 і 15 років; тоді як у дітей ГП даний параметр характеризувався плавним і рівномірним збільшенням з віком (рис. 1).
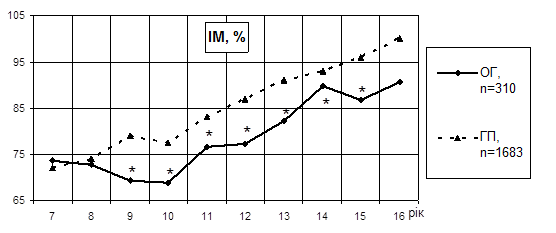
Рис. 1. Вікова динаміка індексу міцності в дітей із хронічним пієлонефритом, n=310
Примітка: * - Р<0,001 достовірність відмінності при порівнянні ОГ з дітьми ГП.
Найбільш низький рівень ШОУ в дітей із ХП, стосовно ГП, спостерігався в 10 і 15 років, що свідчило про виражене порушення архітектоніки КТ і підвищеної її крихкості. Крива вікових значень параметра ШПУ в хворих на ХП відрізнялася від відповідного графіка ГП низьким рівнем (Р<0,05). На наш погляд, у дітей із ХП, на тлі погіршення показників СФВКТ стосовно дітей ГП, сполучення найбільш низьких значень ШОУ і ШПУ у віці 10, 12 і 15 років, може призводити в них до підвищеного ризику розвитку переломів.
Нами відзначено, що при однаковій поширеності зниженого показника ІМ серед дівчаток (38,5 %) і хлопчиків (34,5 %) в ОГ хворих, вікова динаміка параметрів СФВКТ мала статеві особливості. У хлопчиків у 13 років усі показники СФВКТ були достовірно нижче (Р<0,05), ніж у дівчаток. А в дівчаток у порівнянні з хлопчиками достовірне погіршення СФВКТ спостерігалося в 10 (зниження ШПУ) і 11 (зменшення ШОУ) років (Р<0,05), а також у 16 років. Це свідчить про те, що в хлопчиків ризик розвитку переломів вище в 13 років, а в дівчаток – у 10-11 і 16 років.
Отримані дані вказували на те, що найбільші зміни СФВКТ у дітей із ХП спостерігалися в періоди інтенсивного росту і статевого дозрівання дитини.
Серед хлопчиків інтегральний параметр ІМ найбільш тісно корелював з віком (r=0,49, Р<0,001), тобто був більш жорстко (генетично) детермінований і, отже, можна було очікувати меншу його коректованість У дівчаток показник ІМ найбільш сильно статистично залежав від маси тіла, яка більш лабільна (r=0,54, P<0,001), за рахунок позитивної кореляції показника ШОУ з масою, (r=0,65, P<0,001), що свідчило про кращу можливість лікування ОП в дівчаток із ХП.
Виявлено, що в хворих на ХП дітей остеопенія виявляється в 2 рази частіше за наявності обструкції в сечових шляхах. У цієї категорії дітей спостерігалися достовірно менші значення всіх параметрів СФВКТ у порівнянні з пацієнтами, якi не мають порушень уродинаміки (Р<0,05). Відзначено, що серед пацієнтів з обструктивним ХП за наявності в анамнезі хірургічної корекції обструкції сечових шляхів, ОП зустрічалася на 4,7% рідше, ніж у дітей, котрі хворіють обструктивною формою ХП і лікувалися тільки консервативно. Більш високі антропометричні показники (маси тіла, ОГК, ІМТ) серед перших свідчили про кращий ФР у них у порівнянні з останніми, а також про наявність передумов для нормалізації процесів кісткового формування.
Відзначено, що при однаковій частоті виявлення остеопенії серед дітей, що мають різний характер перебігу ХП, латентний мікробно-запальний процес у нирках збільшує виразність змін у кістках, підвищуючи ризик зниження ІМ, що характерний для остеопорозу, у 1,6 рази.
Залежно від тривалості захворювання найчастіше ОП зустрічалася в дітей, які хворіють на ХП протягом 4-6 років (у 43,4 % пацієнтів). У цій групі дітей середнє значення всіх денситометричних показників (ІМ, ШОУ (Р<0,05), ШПУ) були нижче, ніж у хворих на ХП протягом 1-3 років, що пояснюється несприятливим впливом на кісткове формування хронічного мікробно-запального ренального процесу. Поліпшення СФВКТ у дітей із тривалістю ХП 7 і більш років можна пояснити тим, що до цього терміну захворювання хворим була вже проведена хірургічна корекція порушень уродинаміки, також активізувалися вікові адаптаційно-компенсаторні механізми.
При аналізі результатів остеоденситометрії відповідно до клініко-анамнестичних даних виявлено, що наявність в анамнезі в дітей, котрі хворіють на ХП, кісткових переломів, викликаних невеликою травмою чи падінням з висоти свого зросту, підвищувало в них ризик порушення СФВКТ у 2 рази.
Виявлені прямі кореляційні зв'язки між показниками антропометрії і параметрами, що характеризують СФВКТ (ІМ, (r=0,42-0,51, P<0,001); ШОУ (r=0,49-0,61, P<0,001); ШПУ (r=0,23-0,29, P<0,001)), найбільш тісний – між значеннями ШОУ і маси тіла (r=0,61, P<0,001), вказували на взаємозв'язок ступеня ФР і станом КТ. У хворих на ХП дітей з відставанням ФР середньоарифметичні показники СФВКТ були нижче, ніж у пацієнтів із середнім (ІМ (Р<0,05); ШОУ (Р<0,001)) і з підвищеним ФР (ШОУ (Р<0,05). Наявність у хворих на ХП дітей низького чи нижче середнього рівня ФР підвищувало частоту остеопенії в 1,5 рази, а остеопорозу – у 1,9 рази.
Вивчення фосфорно-кальцієвого гомеостазу в дітей із ХП показало, що всі середньостатистичні біохімічні і функціональні показники мінерального обміну не виходили за межі вікової норми, крім параметра TmPі/ШГФ (1,53±0,52 ммоль/л.кл.ф-та), що визначає максимальну здатність проксимальних ниркових канальців реабсорбувати фосфати сечі, який серед дітей ОГ був вище норми і рівня дітей КГ (1,13±0,89 ммоль/л.кл.ф-та, Р<0,05).
У 42,3 % дітей із ХП був виявлен низький вміст у сироватці крові Саі , а в 24,5 % пацієнтів – низький вміст Рнеорг . Середній рівень цих макроелементів у сироватці крові в хворих був достовірно нижче (1,07±0,14 і 1,30±0,35 ммоль/л; Р<0,05), ніж у дітей КГ (1,15±0,17 і 1,63±0,56 ммоль/л). Також у хворих, стосовно КГ, спостерігалося зниження (Р<0,05) виведення Са і Р з сечею (1,84±2,02; 6,82±5,69 ммоль/л). На тлі збільшення середніх значень ШГФ і КР у хворих на ХП, у порівнянні з дітьми КГ (Р<0,05), що свідчило про підвищене функціональне навантаження нирок, відзначався високий рівень в2МГ у сечі (0,06±0,08 мкг/мол) – маркера ураження проксимальних канальців. При цьому знижений рівень кліренсів Са і Р і співвідношення Са/Кр сечі (0,14±0,23) по відношенню до КГ вказувало на недостатню абсорбцію кальцію і фосфору у кишечнику хворих на ХП, що було виражено в пацієнтів з ОП, при зниженому ФР і у дівчаток.
Достовірні позитивні кореляційні зв'язки (r=0,2, Р<0,05) рівня Са в сечі з усіма показниками біологічного розвитку: календарним віком, параметрами ФР (зростом, масою і ІМТ), а також характеристиками КВ (СФВікКС і (ФКВ-НКВ)) і СФВКТ (ІМ, ШОУ; r=0,2; 0,3; Р<0,05), – свідчили про високу значимість цього показника для оцінки рівня напруженості процесів росту.
Слабка прямо пропорційна залежність усіх СФВКТ від значення Са/Кр у сечі (r=0,2, Р<0,05) – показника, що відображає рівень кісткового обміну, вказувала на зниження та уповільнення кісткового обороту в дітей із ХП. Також про помірне зниження мінералізації кісток свідчила тенденція до зменшення середнього рівня активності ЛФ у сироватці крові в хворих з ОП, при порівнянні з пацієнтами без змін СФВКТ (3887±1479 і 4140±1876 (нмоль/с)∙л-1 ).
Виявлено достовірні (Р<0,05) негативні залежності рівня активності ЛФ від календарного віку (r=-0,32), антропометричних показників: зростом і масою (r=-0,19; 0,22), а також СФВікКС (r=-0,24), що вказувало на зниження інтенсивності процесів кісткового формування при збільшеннi біологічного віку.
У 5,8 % дітей із ХП рівень показника СаЧР у сироватці крові був вище, ніж 4,44 ммоль2/л2 (верхня межа норми), при цьому виявлення ОП збільшувалося в 2 рази і спостерігалося в 66,7 % таких пацієнтів, а частота анамнестичних переломів кісток – у 1,6 рази, що необхідно враховувати при виборі коригуючої терапії ОП.
У дітей із ХП середній рівень КТр, що склав 52,12±30,45 пг/мл, був нижче (Р<0,05), ніж у дітей КГ на 41,3%, і достовірно був менше в пацієнтів з наявністю обструкції в сечових шляхах, при рецидивуючому перебігу ХП, у дівчаток і в молодшому віці. Виявлено сильні позитивні кореляційні зв'язки рівня КТр зі значеннями маси тіла (r=0,8; P<0,05). Вміст ПТГ у сироватці крові хворих на ХП достовірно не відрізнявся від дітей КГ, дорівнював 40,68±9,69 пг/мл, і не залежав від особливостей основного захворювання, статі, однак достовірно збільшувався з віком.
Середній рівень КТн у дітей із ХП дорівнював 4,52±7,98 пг/мл, і був (Р<0,05) нижче, ніж у дітей КГ на 80,6% чи в 5 разів, що було виражено в хворих з обструктивною формою ХП, при тривалому перебігу захворювання та у молодших дітей. Був виявлений прямий зв'язок рівня КТн зі ступенем ФР дитини (r=0,7; P<0,01). Серед дівчаток відзначалася сильна зворотня залежність рівнів КТн і ГР (r=-0,88; P<0,05).
У дітей із ХП спостерігалося зниження середнього вмісту ГР (1,32±1,33 мМЕ/л) на 65,8 % від рівня КГ і на 34 % від норми, більш виражене у пацієнтів з ОП, при необструктивному ХП і тривалому перебігу захворювання. Відзначено достовірне, однак не досягаюче норми, підвищення рівня ГР у дітей із ХП у віці 10 - 12 років (Р<0,05) у порівнянні з іншими віком.
Описані відхилення рівнів кальційрегулюючих гормонів у дітей із ХП свідчили про змінену гормональну регуляцію мінерального обміну і дисгармонійну їхню участь в загальних адаптаційно-компенсаторних механізмах організму.
Вивчення маркерів кісткового ремоделювання показало, що середньоарифметичний рівень ОК у сироватці крові хворих на ХП був на 22 % нижче (Р<0,05), ніж у дітей КГ, і дорівнював 91,26±24,18 нг/мл. Це свідчило про уповільнення остеосинтезу внаслідок зниженої остеобластичної активності в дітей із ХП, більш виражене в пацієнтів з наявністю обструкції сечових шляхів, при латентному і тривалому перебігу ХП, у дівчаток і дітей зі зниженим ФР. У пацієнтів у віці 10 - 12 років відзначалося збільшення середнього рівня ОК у порівнянні з хворими інших віків (Р<0,05), що відзеркалювало посилення процесів кісткового утворення, характерне для даного вікового періоду. Нами виявлені прямопропорційні залежності (P<0,05) рівня ОК зі значеннями Сса (r=0,8), КТн (r=0,6) і показника ШОУ (r=0,5), що свідчать про спряженість процесів остеосинтезу і кісткової резорбції, а також про те, що рівень ОК відображує швидкість утворення кістки.
Середнє значення показника ДПД/Кр сечі в хворих ОГ було в нормі, складаючи 4,65±3,72 нмольДПД/ммольКр, і не відрізнялося від рівня дітей КГ. Однак у пацієнтів з ОП даний параметр був достовірно вище (Р<0,05), ніж у дітей ОГ і хворих з нормальними СФВКТ, що вказувало на перевагу в них процесів кісткової резорбції. Це підтверджувалося негативним взаємозв'язком показника ДПД/Кр сечі зі значеннями ІМ, ШОУ і ШПУ (r=-0,8; -0,7; -0,7; P<0,01), а також параметрами, що характеризують КВ: СФВікКС і (ФКВ-НКВ) (r=-0,8; -0,7; P<0,01). Були відзначені важливі прямі взаємозв'язки рівня ДПД/Кр сечi із вмістом КТр у сироватці крові (r=0,97; P<0,001) і з показником RP (r=0,6; P<0,05), а також сильний зворотний зв'язок ДПД/Кр сечі з рівнем в2МГ у сечі (r=-0,7; P<0,001), що відображає механізми впливу КТр на організм, зокрема, на КТ та нирки, а також вплив стану канальцевих функцій на рівень КТр.
Достовірне підвищення рівня ДПД/Кр сечі, що свідчить про посилення кісткової резорбції, спостерігалося у хворих на обструктивний ХП, з рецидивуючим і тривалим перебігом захворювання, серед дівчаток і дітей зі зниженим рівнем ФР. Останнє ілюструвалося зворотніми залежностями рівня ДПД/Кр сечі зі всіма антропометричними параметрами: зростом, масою тіла, ОГК (r=-0,8; -0,8; -0,6; P<0,01), ІМТ (r=-0,6; P<0,05), а також календарним віком (r=-0,8; P<0,01).
Виявлені зміни фосфорно-кальцієвого обміну і кісткового метаболізму дозволили скласти схему розвитку порушень СФВКТ у дітей із ХП, основною ланкою якої є дефіцит КТр у сполученні з дефіцитом КТн, та обґрунтувати введення в стандартний комплекс реабілітації дітей із ХП заходів, що коригують ОП.
Нами були проведені аналіз динаміки і порівняльна оцінка показників мінерального обміну в 70 дітей із ХП на етапі СКЛ – 1, 2, 3 групи і 34 пацієнтів на амбулаторному етапі реабілітації – 4 і 5 групи, що отримували з метою патогенетичної корекції вторинної ОП препарат "Вітрум Кальціум + вітамін D3 " та комбінацію антигомотоксичних препаратів "Солідаго композітум С" і "Остеобіос" за схемами; а також у 22 амбулаторних хворих на ХП з остеопенією, без її лікування (ГП).
У результаті стандартного комплексу СКЛ у хворих дітей на ХП відзначалася позитивна динаміка СФВКТ за рахунок збільшення показника ШОУ, що було виражено в пацієнтів з ОП (1 гр), на нашу думку, внаслідок більш лабільного стану кісткового метаболізму. Застосування комбінації антигомотоксичних препаратів як на тлі СКЛ, так і самостійно, мало аналогічний ефект від впливу на СФВКТ (3 і 5 гр).
Призначення "Вітрум Кальціум + вітамін D3 " на СКЛ у хворих з ОП (2 гр) призводило тільки до збільшення ШПУ, що було зв'язано з поліпшенням еластичності КТ, не впливаючи на її міцність. Однак у цій групі спостерігалося подальше поступове збільшення рівня кісткових показників, що через 3 місяці спостереження призвело до достовірного підвищення ІМ. Застосування даного комбінованого препарату амбулаторно (4 гр), на наш погляд, мало несприятливий ефект, що виражався в значному підвищенні рівня ІМ, який надалі різко знижувався і ставав нижче, ніж був спочатку.
Аналіз віддалених результатів також показав, що для продовження позитивного ефекту впливу антигомотоксичного лікування ОП в дітей із ХП (3 і 5 гр) доцільно через 3 місяці після закінчення корекції проводити повторні курси.
ВИСНОВКИ
У роботі представлене теоретичне узагальнення і рішення актуальної наукової задачі щодо вивчення структурно-функціонального стану кісткової тканини в дітей із ХП і оптимізації їхньої реабілітаційного лікування.
1. У дітей, хворих на хронічний пієлонефрит, дисгармонійний фізичний розвиток відзначався в 33,5 % хворих, у 40,6 % пацієнтів індекс маси тіла був менше вікової норми, що на тлі зниженого кісткового віку та уповільнених темпів розвитку кісткової системи свідчило про відставання хворих у біологічному розвитку, що було більш виражене у віці 10 - 12 років, у дівчаток, при тривалості захворювання більше 3 років, при нездійсненій хірургічній корекції обструкції сечових шляхів і в пацієнтів зі зниженим фізичним розвитком.
2. Дослідження структурно-функціональних властивостей кісткової тканини в дітей, хворих на хронічний пієлонефрит, характеризувалося зниженням основних денситометричних параметрів – індексу міцності кісткової тканини, широкополосного ослаблення ультразвуку, швидкості поширення ультразвуку, більш виражене в дівчаток, у віці 10 - 12 і 15 років, у хворих з обструктивною формою хвороби, латентним перебігом патологічного процесу, тривалістю основного захворювання більше 3 років, за наявності в дитини кісткових переломів в анамнезі, а також при зниженому рівні фізичного розвитку.
3. Дослідження стану фосфорно-кальцієвого обміну в дітей із хронічним пієлонефритом виявило низький вміст у сироватці крові іонізованого кальцію і фосфору неорганічного, достовірне зниження виведення кальцію і фосфатів із сечею, які на тлі збільшення швидкості гломерулярної фільтрації, канальцевої реабсорбції
8-09-2015, 20:14
