 |
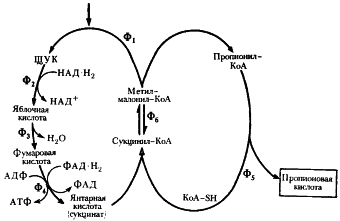
| Рис. 54. Превращение пировиноградной кислоты в пропионовую при пропионовокислом брожении: Ф1 — метилмалонил-КоА-карбоксилтрансфераза; Ф2 — малатдегидрогеназа; Ф3 — фумараза: Ф4 — фумаратредуктаза; Ф5 — КоА-трансфераза; Ф6 — метилмалонил-КоА-мутаза (по Daglev, Nicholson. 1973; Rose. 1971) |
Впервые гетеротрофная ассимиляция углекислоты была обнаружена в 1936 г. X. Вудом и К. Веркманом (Н. Wood, C. Werkman) при изучении сбраживания глицерина пропионовыми бактериями. Карбоксилирование пирувата, приводящее к образованию щавелевоуксусной кислоты, получило название реакции Вуда — Веркмана. У эубактерий обнаружены различные реакции карбоксилирования пирувата или его фосфорилированного производного. Показано, что реакции карбоксилирования имеют место у всех гетеротрофных прокариот, а также в клетках всех эукариотных организмов, включая высшие растения и животных. Кроме того, в больших масштабах в природе реакции связывания CO2 осуществляются автотрофными. организмами в процессе хемо- и фотосинтеза.
В пропионовокислом брожении мы имеем дело с реализацией третьей возможности превращения пирувата — его карбоксилированием, приводящим к возникновению нового акцептора водорода — ЩУК. Восстановление пировиноградной кислоты в пропионовую у пропионовокислых бактерий протекает следующим образом (рис. 54). Пировиноградная кислота карбоксилируется в реакции, катализируемой биотинзависимым ферментом, у которого биотин выполняет функцию переносчика CO2 . Донором CO2 -группы служит метилмалонил-КоА. В результате реакции транскарбоксилирования образуются ЩУК и пропионил-КоА:
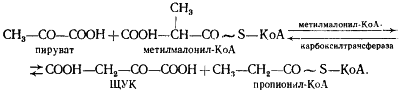
Рассмотрим теперь дальнейшую судьбу каждого из двух продуктов реакции, а также вопрос о происхождении одного из субстратов реакции — метилмалонил-КоА. (Основным источником пировиноградной кислоты служит процесс гликолитического расщепления гексоз или окислительные превращения, если в качестве субстрата брожения используют, например, диоксиацетон или глицерин.)
ЩУК в результате трех ферментативных этапов (аналогичных реакциям 6, 7, 8 цикла трикарбоновых кислот, см. рис. 92) превращается в янтарную кислоту:

Следующая реакция заключается в переносе КоА-группы с пропионил-КоА на янтарную кислоту (сукцинат), в результате чего образуется сукцинил-КоА и пропионовая кислота:

Образовавшаяся пропионовая кислота выводится из процесса и накапливается вне клетки. Сукцинил-КоА превращается в метилмалонил-КоА:
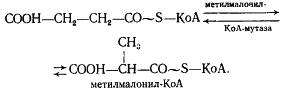
В состав кофермента метилмалонил-КоА-мутазы входит витамин B12 . Перегруппировки типа, указанного в приведенном выше уравнении, характерны для реакций, катализируемых ферментами, содержащими витамин B12 . В описанной выше реакции происходящие перемещения атомов в молекуле сводятся к двум типам: изменению углерод-углеродных связей и перераспределению водорода между углеродными атомами (рис. 55). Реакция, катализируемая мутазой, — ключевая в пропионовокислом брожении, так как в ней подготавливается субстрат, являющийся предшественником пропионовой кислоты.
Из схемы, представленной на рис. 54, можно видеть, что образование пропионовой кислоты из пировиноградной — результат взаимосвязанного функционирования двух циклов: цикла переноса одноуглеродного фрагмента и цикла переноса кофермента А.
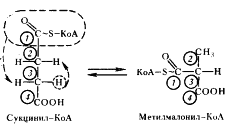 |
| Рис. 55. Механизм реакции, катализируемой метилмалонил-КоА-мутазой. Цифрами в кружочках пронумерованы атомы углерода |
Кофермент А, принимающий активное участие в пропионовокислом брожении, относится к группе мононуклеотидов. Он содержит аденин, Д -рибозу, пирофосфатную группу и пептидоподобное соединение, в состав которого входит пантотеновая кислота — еще один витамин группы В. Функция кофермента А заключается в переносе ацильных групп (RCO~). Ацильная форма КоА представляет собой тиоэфир. Тиоэфирная связь, образующаяся между карбоксильной группой кислоты и тиоловой группой КоА, является высокоэнергетической.
Итак, разобранный выше поток реакций приводит к синтезу пропионовой кислоты. Однако пропионовокислое брожение — более сложный процесс, поскольку наряду с пропионовой кислотой в качестве продуктов брожения образуются уксусная, янтарная кислоты и CO2 . В схеме, изображенной на рис. 54, янтарная кислота образуется как промежуточное соединение на пути, ведущем к синтезу пропионата; но она может накапливаться в среде и как конечный продукт. К образованию сукцината, количество которого зависит от содержания CO2 в среде, ведет последовательность реакций, начинающаяся с карбоксилирования ФЕП (рис. 56), в которой остаток фосфорной кислоты ФЕП переносится на неорганический фосфат, что приводит к образованию пирофосфата:
ФЕП + CO2 + ФН ® ЩУК + пирофосфат.
Дальнейшие превращения ЩУК до янтарной кислоты аналогичны реакциям 2 — 4, изображенным на рис. 54.
Многие пропионовые бактерии сбраживают глюкозу так, что на каждую молекулу пирувата, окисленную до уксусной кислоты и CO2 , приходятся 2 молекулы пирувата, восстановленные до пропионовой кислоты. Путь превращения пирувата, приводящий к образованию уксусной кислоты и CO2 , представлен на рис. 56. На этом пути имеют место окислительно-восстановительные реакции, идущие с вовлечением новых молекул НАД+ . Пируват подвергается окислительному декарбоксилированию с участием кофермента А:

Процесс катализируется пируватдегидрогеназным комплексом и практически необратим. В результате образуется ацетил-КоА, содержащий высокоэнергетическую тиоэфирную связь, ацетильная группа с которого переносится на неорганический фосфат, что приводит к образованию ацетилфосфата и регенерированию кофермента А:
![]()
 |
| Рис. 56. Пути образования янтарной, уксусной кислот и CO2 пропионовыми бактериями: Ф1 — ФЕП-карбокситрансфосфорилаза; Ф2 — пируватдегидрогеназа; Ф3 — фосфотрансацетилаза; Ф4 — ацетаткиназа |
В этой реакции энергия, заключенная в тиоэфирной связи, реализуется в виде высокоэнергетической фосфатной связи ацетилфосфата.
И наконец, ацетилфосфат донирует фосфатную группу на АДФ с образованием АТФ и уксусной кислоты:
![]()
Итак, на участке от пирувата до ацетата образуется 1 молекула НАД-H2 и 1 молекула АТФ. Энергетическое значение для пропионовых бактерий этого участка метаболического пути очевидно и не требует обсуждения.
Кроме основных продуктов в разных количествах в культуральной жидкости пропионовых бактерий обнаружены молочная, муравьиная, изовалериановая кислоты, этиловый и пропиловый спирты, уксусный и пропионовый альдегиды, ацетоин, диацетил. Состав конечных продуктов брожения зависит от культуры бактерий, состава среды и условий культивирования. Это касается как видов накапливаемых продуктов, так и количественных соотношений между ними.
Теоретически пропионовое брожение должно приводить к образованию 4 молекул АТФ при сбраживании 1,5 молекулы глюкозы. Однако было обнаружено, что выход энергии несколько выше. Источником дополнительных молекул АТФ, возможно, является этап восстановления фумаровой кислоты до янтарной, катализируемый фумаратредуктазой (см. рис. 54). Получены экспериментальные данные в пользу того, что восстановление фумарата до сукцината — процесс, в результате которого некоторые первично анаэробные эубактерии могут синтезировать АТФ по механизму фосфорилирования, сопряженного с переносом электронов. Показано, что фумаратредуктаза связана с мембраной и образует комплекс с переносчиком электронов хиноном. В составе комплекса обнаружен цитохром b. Фумаратредуктазная система найдена у пропионовых бактерий. Этой системе придается большое значение в эволюции как, возможно, первому шагу на пути создания многокомпонентных электронтранспортных цепей у эубактерий (см. гл. 15).
Энергетическая эффективность пропионовокислого брожения связана также с выработкой пропионовыми бактериями новых метаболических способностей: реакций транскарбоксилирования и перегруппировки, участия в процессе КоА-производных. Образование дикарбоновой кислоты из пировиноградной с использованием механизма транскарбоксилирования вместо прямого карбоксилирования пирувата позволяет избежать дополнительных энергетических затрат на этом этапе брожения. Все это вместе взятое позволяет рассматривать пропионовокислое брожение как более совершенный из рассмотренных до сих пор способов получения энергии в анаэробных условиях.
ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
В эту группу, объединяемую в род Propionibacterium , входят грамположительные, неподвижные, не образующие спор палочковидные бактерии, размножающиеся бинарным делением. В зависимости от условий культивирования и цикла развития форма клетки может меняться до кокковидной, изогнутой или булавовидной. Типовой вид — P. freudenreichii .
Большинство пропионовокислых бактерий — аэротолерантные анаэробы, получающие энергию в процессе брожения, основным продуктом которого является пропионовая кислота. Аэротолерантность их обусловлена наличием полностью сформированной ферментной системы защиты от токсических форм кислорода (супероксидный анион, перекись водорода). У пропионовокислых бактерий обнаружены супероксиддисмутазная, каталазная и пероксидазная активности. Внутри группы отношение к O2 различно. Некоторые виды могут расти в аэробных условиях.
Брожение не исчерпывает всех возможностей получения энергии этой группой эубактерий. Хотя гликолитическое расщепление глюкозы с образованием в качестве обязательного промежуточного соединения пировиноградной кислоты является основным путем разложения глюкозы, кроме этого пути в группе пропионовых бактерий обнаружен окислительный пентозофосфатный путь, реакции ЦТК, активное "флавиновое дыхание" и окислительное фосфорилирование, сопряженное с электрон-транспортной системой. Вклад каждого из этих путей в общий энергетический метаболизм зависит как от вида бактерий, так и от конкретных внешних условий. Эволюция пропионовых бактерий определенно шла по пути приспособления к аэробным условиям. У некоторых видов обнаружен "эффект Пастера": в присутствии кислорода воздуха происходит переключение с брожения на дыхание. Пропионовые бактерии могут синтезировать гемсодержащие белки. В их клетках обнаружены цитохромы.
Важную роль в аэробном метаболизме пропионовых бактерий играет "флавиновое дыхание", которому приписывают основную связь этих бактерий с молекулярным кислородом. В процессе "флавинового дыхания" происходит перенос двух электронов с флавопротеинов на O2 , сопровождающийся образованием перекиси водорода, которая разлагается бактериальной каталазой и пероксидазой. Однако "флавиновое дыхание" не связано с получением клеткой энергии. Транспорт электронов в дыхательной цепи некоторых пропионовых бактерий сопровождается образованием АТФ, что может указывать на подключение к этому процессу цитохромов, однако эффективность окислительного фосфорилирования низка. Последнее, вероятно, объясняется несовершенством механизмов сопряжения. В то время как в аэробных условиях конечным акцептором электронов с НАД-H2 является O2 , в анаэробных условиях им может быть нитрат, фумарат.
Таким образом, в группе пропионовых бактерий мы впервые при рассмотрении эубактериальных форм сталкиваемся с большим разнообразием энергетических возможностей. В целом у пропионовых бактерий достаточно четко просматриваются две тенденции: с одной стороны, усовершенствование основного анаэробного способа получения энергии, с другой — попытки приспособления и, более того, рационального использования молекулярного кислорода.
Конструктивный метаболизм пропионовых бактерий претерпел дальнейшую эволюцию в сторону большей независимости от органических соединений внешней среды. Пропионовые бактерии характеризуются хорошо развитыми биосинтетическими способностями и могут расти на простой синтетической среде с аммонийным азотом в качестве единственного источника азота при добавлении к среде пантотеновой кислоты и биотина, а для некоторых видов и тиамина. У ряда пропионовых бактерий обнаружена способность к азотфиксации.
Местообитание пропионовых бактерий — кишечный тракт жвачных животных, молоко, твердые сыры, в приготовлении которых они принимают участие. После молочнокислого брожения, когда лактоза превращена в молочную кислоту, начинают размножаться Пропионовые бактерии, сбраживающие молочную кислоту с образованием уксусной и пропионовой кислот. Эти кислоты придают сырам специфический острый вкус. Пропионовые бактерии используют в микробиологической промышленности в качестве продуцентов витамина B12 .
МАСЛЯНОКИСЛОЕ БРОЖЕНИЕ
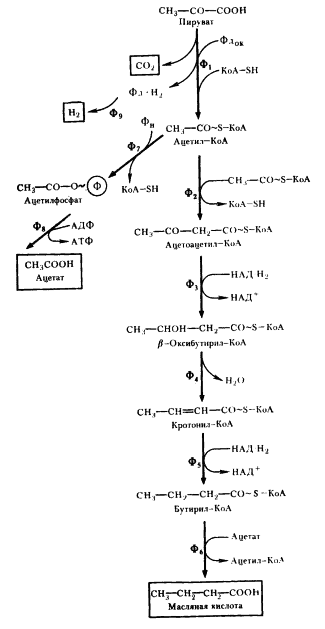 |
| Рис. 57. Пути превращения пирувата в маслянокислом брожении, осуществляемом Clostridium butyricum : Ф1 — пируват:ферредоксиноксидоредуктаза; Ф2 — ацетил-КоА-трансфераза (тиолаза); Ф3 — (3-оксибутирил-КоА-дегидрогеназа; Ф4 — кротоназа; Ф5 — бутирил-КоА-дегидрогеназа; Ф6 — КоА-трансфераза; Ф7 — фосфотрансацетилаза; Ф8 — ацетаткиназа; Ф9 — гидрогеназа; Фдок — окисленный; Фд-H2 — восстановленный ферредоксин; ФН — неорганический фосфат |
Следующий вариант решения донор-акцепторной проблемы на базе гликолитически образованного пирувата представляет собой маслянокислое брожение. Новое в маслянокислом брожении — возникновение реакций конденсации типа С2 + С2 ® С4 , в результате чего образуется С4 -акцепторная кислота. Судьба этой кислоты различна и определяется необходимостью акцептирования водорода с НАД-H2 , освобождающегося в процессе брожения, а это в свою очередь тесно связано с оттоком водорода на конструктивные процессы. В качестве конечных C4 -продуктов в процессе брожения возникают соединения различной степени восстановленности. Характерным C4 -продуктом брожения является масляная кислота. Осуществляют такой тип брожения многие бактерии, относящиеся к роду Clostridium .
Типичными представителями клостридиев, осуществляющих маслянокислое брожение, являются C. butyricum и C. pasteurianum . Они сбраживают сахара с образованием масляной и уксусной кислот, CO2 и H2 (рис. 57). Превращение глюкозы до пирувата осуществляется по гликолитическому пути. Следующая реакция — разложение пирувата до ацетил-КоА и CO2 , сопровождающееся образованием восстановленного ферредоксина (Фд). Реакция катализируется ферментом пируват: ферредоксиноксидоредуктазой и является ключевой в маслянокислом брожении. Особенности реакции — участие в ней белков, содержащих негемовое железо и кислотолабильную серу (FeS-белки)45 .
45 Кислотолабильной она названа потому, что при кислотной обработке белка происходит ее выделение в виде H2 S.
К FeS-белкам относится группа белков, участвующих в процессах электронного транспорта (ферредоксины), и ряд ферментов, катализирующих окислительно-восстановительные реакции. Установлено, что FeS-белки являются ключевыми в таких важных клеточных процессах, как фотосинтез, дыхание, азотфиксация, фиксация CO2 .
Отличительная особенность FeS-белков — строение их активного центра, содержащего негемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров (FeS-центры) широко распространены в клетках. Простейший из них содержит один атом железа, нековалентно связанного в молекуле белка, получившего название рубредоксина, с четырьмя остатками цистеина (рис. 58, А )
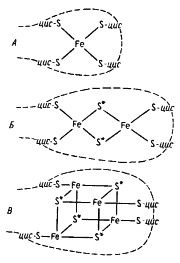 |
| Рис. 58. Железосероцентры FeS-белков. Железосероцентр рубредоксина (А ); предполагаемые модели железосероцентров Fe2 S2 -типа (Б ) и Fe4 S4 -типа (В ). Звездочкой отмечена неорганическая кислотолабильная сера; прерывистой линией обозначена полипептидная цепь; цис — цистеин |
Обнаруженный у C. pasteurianum рубредоксин имеет окислительно-восстановительный потенциал около — 57 мВ и участвует в реакциях одноэлектронного переноса, в основе которого лежит переход железа:
Fe2+ « Fe3+ .
Остальные FeS-белки имеют более сложно организованные FeS-центры, в состав которых входит также неорганическая кислотолабильная сера. Известны Fe2 S2 -центры (содержат по два атома железа и неорганической серы), Fe3 S3 - и Fe4 S4 -центры (рис. 58, Б, В ). FeS-белки могут содержать один или более центров в молекуле. У большинства FeS-содержащих ферментов помимо FeS-центров в молекуле имеются и иные кофакторы: металлы (молибден, селен), хромофорные группы (флавин, гемы, птеридины), витамины (табл. 16).
Клостридии содержат ферредоксины с 1 — 2 центрами Fe4 S4 -типа и молекулярной массой 6000 — 7000 Да.
В зависимости от особенностей строения FeS-центров ферредоксины могут осуществлять одновременный перенос одного или двух электронов. Окислительно-восстановительный потенциал ферредоксинов находится в диапазоне от — 490 до — 310 мВ, однако описаны FeS-белки, окислительно-восстановительный потенциал которых высоко положителен (около + 350 мВ).
Ферредоксины играют центральную роль в метаболизме клостридиев, сопрягая катаболические процессы с биосинтетическими реакциями (рис. 59).
Таблица 16. Железосеросодержащие ферменты эубактерий
| Простетическая группа | Ферменты |
| FeS-центры | гидрогеназа и др. |
| FeS-центры + тиаминпирофосфат | пируват:ферредоксин-оксидоредуктаза |
| FeS-центры + флавин | сукцинатдегидрогеназа, НАД(Ф)-H2 -дегидрогеназа, глутаматсинтетаза и др. |
| FeS-центры + гем | диссимиляционная сульфитредуктаза |
| FeS-центры + молибден | нитрогеназа, диссимиляционная нитратредуктаза, формиатдегидрогеназа и др. |
| FeS-центры + два и более дополнительных кофактора | ассимиляционная сульфитредуктаза, ксантиндегидрогеназа и др. |
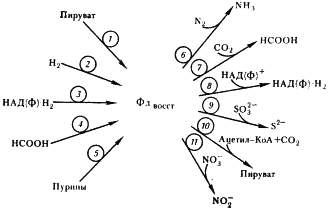 |
| Рис. 59. Роль ферредоксина в метаболизме клостридиев: 1 — пируват:ферредоксин-оксидоредуктаза; 2 — гидрогеназа; 3 — ферредоксин: НАД (Ф)-оксидоредуктаза; 4 — формиатдегидрогеназа; 5 — ксантиндегидрогеназа; 6 — нитрогеназа; 7 — ферредоксин:CO2 -оксидоредуктаза (возможно, это формиатдегидрогеназа, катализирующая реакцию 4 в обратном направлении); 8 — реакция 3, протекающая в обратном направлении; 9 — сульфатредуктаза; 10 — реакция 1, протекающая в обратном направлении; 11 — нитратредуктаза |
Объясняется это тем, что у клостридиев (как и других облигатных анаэробов) физиологические реакции в клетке всегда протекают при отрицательных окислительно-восстановительных потенциалах. В этих условиях FeS-белки, имеющие общий отрицательный окислительно-восстановительный потенциал, особенно пригодны для функционирования в составе ферментов и в качестве переносчиков электронов.
Образующийся в реакции восстановленный ферредоксин поставляет электроны для восстановления N2 , протонов (H+ ), CO2 и НАДФ+ , а последующее превращение ацетил-КоА приводит к синтезу АТФ в реакции субстратного фосфорилирования.
Путь, ведущий к синтезу масляной кислоты, начинается с реакции конденсации двух молекул ацетил-КоА (см. рис. 57). Образовавшийся ацетоацетил-КоА восстанавливается в b-оксибутирил-КоА. Источником электронов в этой реакции и дальше на пути синтеза масляной кислоты служат молекулы НАДxH2 , образующиеся при окислении 3-ФГА в 1,3-ФГК (см. рис. 53).
Дальнейшее превращение заключается в отщеплении от молекулы (3-оксибутирил-КоА молекулы воды, что приводит к образованию соединения с двойной углеродной связью. Кротонил-КоА ферментативно восстанавливается в бутирил-КоА. Масляная кислота образуется в реакции переноса кофермента А с молекулы бутирил-КоА на ацетат. Эта реакция более "выгодна" для клетки, так как не приводит к потере энергии (в отличие от реакции простого гидролиза). Образующийся в реакции ацетил-КоА возвращается в метаболический поток и может быть использован для синтеза АТФ (реакция 7 на рис. 57) или же вновь участвовать в последовательности реакций, ведущих к синтезу масляной кислоты (реакции 2 — 6, там же).
Разобранный выше путь, завершающийся синтезом масляной кислоты, не связан с получением клеткой энергии, поскольку ни на одном из этапов не происходит образования АТФ. Единственное назначение метаболических превращений ацетил-КоА по этому пути — акцептирование электронов, переносимых на НАД+ в процессе гликолитического метаболизирования глюкозы: две молекулы НАД-H2 образуются на этапе гликолиза, и на двух этапах превращений ацетил-КоА до масляной кислоты происходит потребление водорода с НАД-H2 .
В связи с этим особо важное значение приобретает превращение ацетил-КоА, ведущее к синтезу ацетата, поскольку именно с этим путем связано дополнительное получение клостридиями энергии в процессе маслянокислого брожения. Процесс
29-04-2015, 01:57
