Таким образом, типы брожений, осуществляемых клостридиями, необычайно разнообразны как в отношении используемых субстратов, так и синтезируемых конечных продуктов, и виды, осуществляющие сбраживание углеводов по гликолитическому пути с накоплением масляной кислоты в качестве одного из основных продуктов, являются только одной из групп организмов, относимых к роду Clostridium.
Особенности конструктивного метаболизма
Потребности клостридиев в питательных веществах отличаются большим разнообразием. Как правило, клостридии могут расти только на сложных, богатых органическими соединениями средах. Многие клостридии выделяют экзоферменты, расщепляющие макромолекулы (углеводы, белки) на составляющие их мономеры. До сих пор только небольшое число видов удалось культивировать в лаборатории на синтетической среде. Для них выявлена потребность в витаминах (главным образом группы В) и наборе аминокислот.
Интересная особенность эубактерий из рода Clostridium — дальнейшее развитие способности вовлекать углекислоту в клеточный метаболизм. У C. kluyveri , растущего на смеси C3 -соединений (этанол + ацетат), до 30% углерода клетки возникает из углерода CO2 . Для C. aceticum и других видов, осуществляющих гомоацетатное брожение, показана способность к хемолитоавтотрофному росту на минеральной среде за счет превращения CO2 и H2 в ацетат:
4H2 + 2CO2 ® CH3 -COOH + 2H2 O.
В группу гомоацетатных бактерий, помимо некоторых представителей рода Clostridium , входят организмы, принадлежащие к родам Acetobacterium, Acetogenium, Eubacterium, Butyribacterium и др. При росте на минеральной среде энергию ацетогены получают в процессе анаэробного дыхания с использованием H2 в качестве донора электронов, а CO2 — конечного их акцептора (см. гл. 16). Исходными метаболитами для биосинтетических путей служат ацетил-КоА (ключевой метаболит пути фиксации CO2 ацетогенами) и пируват, образующийся из последнего в реакции восстановительного карбоксилирования.
Пути включения CO2 в клеточный метаболизм клостридиев различны. Углекислота может использоваться ими в качестве конечного акцептора электронов, что приводит к прямому восстановлению CO2 до формиата. Донорами электронов в этой реакции служат восстановленный ферредоксин или НАД-H2 . Реакция может служить способом удаления избытка восстановительных эквивалентов, образующихся при брожении, т. е. быть необходимой для сбалансирования окислительных и восстановительных этапов в энергетическом метаболизме. Образовавшийся в результате восстановления CO2 формиат может подвергаться дальнейшему восстановлению и служить источником метильных групп, используемых для клеточных биосинтезов.
Для разных видов клостридиев показана активная фиксация CO2 на C2 - и C3 -соединениях, таких как ацетил-КоА, пропионил-КоА, пируват, в реакциях восстановительного карбоксилирования, например:
ацетил-КоА+ CO2 + Фдвосст ® пируват + KoA-SH + Фдок .
Механизм, по которому происходит автотрофная фиксация CO2 у клостридиев, осуществляющих гомоацетатное брожение, изображен на рис. 62.
Дальнейший шаг вперед по пути независимости от среды связан с распространением у этой группы эубактерий способности фиксировать атмосферный азот (небольшая способность к фиксации N2 обнаружена у пропионовых бактерий). Первый анаэробный азотфиксатор был выделен из почвы C. Н. Виноградским и назван им в честь Л. Пастера Clostridium pasteurianum .
Молекула N2 чрезвычайно прочна. Чтобы разорвать три связи между двумя атомами в молекуле N2 , необходимо затратить 941 кДж/моль, поэтому восстановление N2 до NH3 химическим путем — очень энергоемкий процесс. Фиксация молекулярного азота, до сих пор обнаруженная только у прокариот, осуществляется с помощью ферментной системы — нитрогеназы, состоящей из двух компонентов: малого, содержащего железо и серу (Fe-белок), и большого, в состав которого дополнительно входит молибден (MoFe-белок)47 . Соотношение между ними у разных азотфиксирующих прокариот колеблется от 1:1 до 2:1, хотя в целом нитрогеназы из разных источников обнаруживают значительное сходство.
Для функционирования нитрогеназы необходим источник энергии в виде АТФ, ионы магния и восстановитель с низким окислительно-восстановительным потенциалом. У C. pasteurianum непосредственным донором электронов для восстановления N2 служит восстановленный ферредоксин, электроны с которого поступают сначала на Fe-белок нитрогеназы (рис. 63).
47 У некоторых азотфиксаторов вместо или наряду с молибденом в составе большой субъединицы обнаружен ванадий, у других найдена нитрогеназа, содержащая только железо.
Восстановленный Fe-белок образует комплекс с молекулами Mg и АТФ, что приводит к сдвигу окислительно-восстановительного потенциала FeS-центра белка от — 290 до — 400 мВ.
Это делает возможным последующий перенос активированных электронов на MoFe-белок, в активном центре которого происходит восстановление N2 . Перенос 1 электрона на MoFe-белок сопровождается гидролизом как минимум 2 молекул АТФ. Так как за один раз FeS-центрами ферредоксина, Fe- и MoFe-белков может быть перенесено не более 2 электронов, а для восстановления N2 до аммиака необходимо 6 электронов, следовательно, процесс должен состоять не меньше чем из трех последовательных стадий восстановления:
![]()
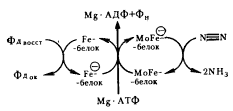 |
| Рис. 63. Функционирование нитрогеназы: кружком обозначена восстановленная форма белка. Объяснение см. в тексте |
В течение длительного времени не удавалось обнаружить какие-либо частично восстановленные промежуточные соединения. Единственным идентифицированным продуктом восстановления был аммиак. Недавно быстрая остановка нитрогеназной реакции в кислой или щелочной среде позволила обнаружить гидразин. Вероятно, промежуточные соединения в процессе восстановления молекулы N2 остаются прочно связанными с нитрогеназой. По проведенным измерениям, для восстановления 1 молекулы N2 требуется не менее 12 молекул АТФ. Таким образом, процесс азотфиксации связан с затратой большого количества клеточной энергии. Для ассимиляции 1 мг N2 C. pasteurianum в процессе брожения перерабатывается примерно 500 мг сахара.
Помимо N2 нитрогеназа может восстанавливать ряд других субстратов, таких как N2 O, C2 H2 и его аналоги, N3 – , CN– . В отсутствие N2 нитрогеназа катализирует выделение молекулярного водорода в реакции, протекающей с затратой АТФ. Это дает основание предполагать, что нитрогеназа является результатом дальнейшего усложнения молекулы гидрогеназы, приобретшей способность катализировать не только восстановление протонов, ведущее к выделению H2 , но и ряд других субстратов, в том числе и N2 .
Роль в природе и практическое значение
С жизнедеятельностью клостридиев связаны различные процессы, протекающие в природе: разложение (гниение) азотсодержащих соединений (белков, нуклеиновых кислот) в анаэробных условиях; анаэробное разложение растительных материалов, таких как клетчатка, хитин. Некоторые сахаролитические клостридии могут использовать в качестве субстрата брожения пектиновые вещества, составляющие покровы растительных клеток. Пектин — полимер метил-D -галактуроновой кислоты. Последняя имеет сложное строение и при воздействии на нее пектиновыми ферментами гидролизуется на ряд сахаров, кислот и метиловый спирт. Клостридии, принадлежащие к виду C. felsineum , содержат активную пектиназу и могут поэтому получать энергию, осуществляя маслянокислое брожение пектиновых веществ. Этот вид играет важную роль в процессе мацерации волокон при мочке льна.
Еще в конце прошлого века было обнаружено, что некоторые клостридии патогенны, т. е. вызывают заболевания человека и животных. В основе патогенности клостридиев лежит их способность синтезировать и выделять из клетки высокоэффективные токсины.
Бактерии группы Clostridium находят и практическое применение. Их используют в производстве масляной кислоты, необходимой для парфюмерной промышленности. Ацетоно-бутиловое брожение, осуществляемое некоторыми видами клостридиев, используют для получения в промышленном масштабе ацетона и бутанола. В свое время в нашей стране возникла острая потребность в этих веществах. Получать их химическим путем в то время было гораздо сложнее, чем микробиологически. В 30-х гг. академик В. Н. Шапошников организовал одно из первых в СССР промышленных микробиологических производств, на котором было освоено получение н -бутанола и ацетона с помощью клостридиев.
АЛЬТЕРНАТИВНЫЕ ПУТИ СБРАЖИВАНИЯ УГЛЕВОДОВ
В течение длительного времени считали, что единственным путем сбраживания углеводов является гликолитический путь с различными вариантами метаболизирования пирувата. Однако постепенно накапливались данные, которые определенно указывали на существование иных, чем гликолиз, путей расщепления углеводов. Гликолитическая схема в одних случаях не, могла объяснить использования эубактериями пентоз в качестве энергетического субстрата, а также того, каким путем они синтезируют необходимую для нуклеиновых кислот рибозу, в других — распределения 14 C в конечных продуктах брожения.
Работами нескольких лабораторий были расшифрованы еще два пути расщепления углеводов, отличные от гликолитического, получившие название окислительного пентозофосфатного пути (другие названия: гексозомонофосфатный, или фосфоглю-конатный, или путь Варбурга — Диккенса — Хореккера) и 2-кето-3-дезокси-б-фосфоглюконатного (КДФГ), или пути Энтнера — Дудорова 48 .
48 Пути названы по имени ученых О. Варбурга (О. Warburg), Ф. Диккенса (F. Dickens), Г. Хореккера (G. Horecker), И. Энтнера (N. Entner) и М. Дудорова (М. Doudoroff), внесших большой вклад в их расшифровку.
ОКИСЛИТЕЛЬНЫЙ ПЕНТОЗОФОСФАТНЫЙ ПУТЬ
Схема начальных этапов окислительного пентозофосфатного пути представлена на рис. 64. Первая реакция заключается в фосфорилировании глюкозы с помощью АТФ и превращении ее в метаболически активную форму глюкозо-6-фосфата, аналогично тому, что имеет место на первом этапе гликолиза. Следующий этап заключается в дегидрировании глюкозо-6-фосфата, катализируемом глюкозо-6-фосфатдегидрогеназой. Особенность реакции в том, что в ней участвует НАДФ+ в качестве акцептора водорода. Образовавшийся продукт реакции очень нестоек и спонтанно или с помощью фермента лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты, которая подвергается окислительному декарбоксилированию, катализируемому фосфоглюконатдегидрогеназой. Эта реакция приводит к образованию соответствующего пентозофосфата, НАДФ-H2 и выделению CO2 . Рибулозо-5-фосфат обратимо превращается в ксилулозо-5-фосфат и рибозо-5-фосфат с участием ферментов фосфопентозоэпимеразы и фосфопентозоизомеразы соответственно.
Суммарно весь процесс можно представить в виде следующего уравнения:
глюкозо-6-фосфат + 2НАДФ+ ® рибозо-5-фосфат + CO2 + 2НАДФ-Н2 .
Как видно, на этом этапе образуются 2 молекулы НАДФ-H2 , которые могут потребляться в восстановительных биосинтетических процессах, и молекула рибозо-5-фосфата, используемого в синтезе нуклеиновых кислот и пентозосодержащих коферментов49 . Примечательно, что ни на одном из окислительных этапов не синтезируется АТФ.
49 Некоторые авторы считают, что особенность окислительного пентозофосфатного пути — перенос электронов на окислительных этапах на НАДФ+ , а не на НАД+ — в последующем оказалась очень "выгодной" для аэробов, так как позволила иметь два отдельных пула восстановленных пиридиновых переносчиков, с одного из которых (НАД-H2 ) электроны поступали в дыхательную цепь, а с другого (НАДФ-H2 ) использовались в биосинтетических восстановительных реакциях.
Первоначально окислительный пентозофосфатный путь возник, вероятно, для обеспечения эубактерий пентозами. В этом случае возникновение только трех новых ферментов (глюкозо-6-фосфатдегидрогеназы, лактоназы и фосфоглюконатдегидрогеназы) уже приводило к синтезу пентоз. Поскольку к этому времени функционировали изомеразные ферменты гликолитического пути (см. рис. 53), формирование фосфопентозоизомеразы произошло довольно легко. Действительно, при определенных условиях окислительный пентозофосфатный путь на этом завершается.
Дальнейшее его развитие, вероятно, связано с энергетическими потребностями клетки. Меньшей части образующегося рибозо-5-фосфата оказалось достаточно для удовлетворения всех потребностей клетки в пентозах. Остальная часть синтезируемого пентозофосфата была субстратом, хранившим в себе большие запасы энергии. Способность использовать в энергетических целях этот субстрат связана с возникновением двух ферментов: фосфопентозоэпимеразы, катализирующей превращение рибулозо-5-фосфата в ксилулозо-5-фосфат (рис. 64), и пентозофосфокетолазы, катализирующей расщепление ксилулозо-5-фосфата на 3-ФГА и ацетилфосфат (рис. 65).
Использование в качестве источника энергии в анаэробных условиях пентозных субстратов, образуемых в окислительном пентозофосфатном пути, свойственно группе гетероферментативных молочнокислых бактерий, для которых характерно образование в качестве конечных продуктов брожения ряда органических соединений: молочной и уксусной кислот, этилового спирта, глицерина, CO2 и др. Этим гетероферментативные молочнокислые бактерии отличаются от гомоферментативных, почти полностью сбраживающих гексозы по гликолитическому пути в молочную кислоту.
 |
| Рис. 64. Окислительный пентозофосфатный путь (начальные этапы): Ф1 — гексокиназа; Ф2 — глюкозо-6-фосфатдегидрогеназа; Ф3 — лактоназа; Ф4 — фосфоглюконатдегидрогеназа (декарбоксилирующая); Ф5 — фосфопентозоэпимераза; Ф6 — фосфопентозоизомераза (по Dagley, Nicholson, 1973) |
Изучение механизмов образования конечных продуктов брожения гетероферментативными молочнокислыми бактериями обнаружило, что они связаны с дальнейшими различными путями метаболизирования C2 - и C3 -фрагментов фосфокетолазной реакции. 3-ФГА претерпевает ряд ферментативных превращений, идентичных таковым гликолитического пути, и через пируват превращается в молочную кислоту. Судьба двухуглеродного фрагмента различна: двухступенчатое восстановление ацетилфосфата приводит к накоплению в среде этанола; окислительный путь превращения ацетилфосфата завершается образованием уксусной кислоты (рис. 65).
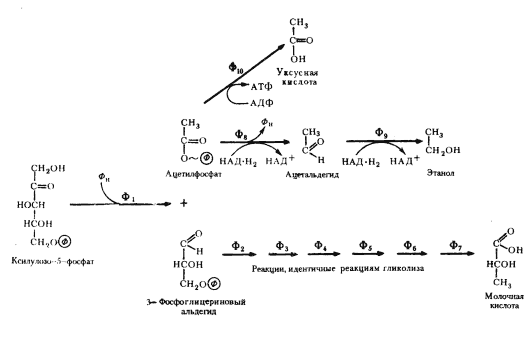 |
| Рис. 65. Гетероферментативное молочнокислое брожение: Ф1 — пентозофосфокетолаза; Ф2 — 3-ФГА-дегидрогеназа; Ф3 — фосфоглицераткиназа; Ф4 — фосфоглицеромутаза; Ф5 — енолаза; Ф6 — пируваткиназа; Ф7 — лактатдегидрогеназа; Ф8 — ацетальдегиддегидрогеназа; Ф9 — алкогольдегидрогеназа; Ф10 — ацетаткиназа (по Schlegel, 1972) |
Преобладание в ферментационной среде того или иного продукта зависит от вида культуры, условий культивирования и фазы развития. Гетероферментативные молочнокислые бактерии Leuconostoc mesenteroides сбраживают глюкозу в молочную кислоту, этанол и CO2 по следующему уравнению:
C6 H12 O6 ® CH3 -CHOH-COOH + CH3 -CH3 -CH2 OH + CO2
У других гетероферментативных молочнокислых бактерий больший удельный вес занимают процессы, ведущие к накоплению уксусной кислоты. Образование уксусной кислоты из ацетилфосфата сопряжено с синтезом АТФ. Если брожение идет с образованием этанола, то выход энергии равен 1 молекуле АТФ на молекулу сброженной глюкозы; если образуется уксусная кислота, то общий энергетический баланс процесса составляет 2 молекулы АТФ на молекулу глюкозы, т. е. такой же, как при гликолизе.
Окислительный пентозофосфатный путь функционирует в качестве единственного пути сбраживания углеводов у облигатных гетероферментативных молочнокислых бактерий. Эти бактерии лишены ключевых ферментов гликолитического пути, например альдолазы и триозофосфатизомеразы. Большинство молочнокислых бактерий имеют два пути сбраживания углеводов: гликолитический и окислительный пентозофосфатный. Сбраживание гексоз, как правило, протекает по гликолитическому пути, а пентоз — по окислительному пентозофосфатному. Это имеет место, например у Lactobacillus plantarum . Ферменты окислительного пентозофосфатного пути обнаружены у клостридиев.
Таким образом, возникнув сначала как механизм синтеза клеткой C5 -соединений, т. е. для выполнения узкой специфической задачи, этот путь получил дальнейшее развитие и стал выполнять дополнительную функцию снабжения эубактерий энергией в анаэробных условиях. Субстратная база для окислительного пентозофосфатного пути позднее была расширена, так как он стал использоваться и для сбраживания пентоз биогенного происхождения, накапливавшихся в окружающей среде.
Но на этом пути эволюционное развитие окислительного пентозофосфатного пути расщепления углеводов не остановилось. Была сформирована последовательность реакций, "замыкающая" этот путь в цикл, в результате чего стала возможной полная деградация молекулы сахара. Исходными субстратами на этом пути служат пентозы, образующиеся из рибулозо-5-фосфата, ксилулозо-5-фосфата и рибозо-5-фосфата (см. рис. 64). При участии двух дополнительных ферментов — транскетолазы и трансальдолазы — осуществляется перенос C2 - и C3 -фрагментов между изомерными пентозо-5-фосфатами и продуктами их взаимопревращений (рис. 66). Сначала транскетолаза переносит C3 -фрагмент от молекулы ксилулозо-5-фосфата на молекулу рибозо-5-фосфата, в результате чего образуется C7 -сахар и C3 -сахар — 3-ФГА. 3-ФГА, образующийся в транскетолазной реакции и, как известно, представляющий собой промежуточный продукт гликолитического пути, является первой точкой, в которой пересекаются эти пути.
Далее трансальдолаза действует на продукты транскетолазной реакции, перенося C3 -фрагмент от молекулы C7 -сахара на C3 -молекулу — 3-ФГА. В результате образуются молекулы C6 -и C4 -сахара. Один из продуктов реакции — фруктозо-6-фосфат является промежуточным соединением гликолитического пути, поэтому данная реакция есть вторая точка пересечения обоих путей углеводного метаболизма. Наконец, транскетолаза осуществляет перенос C2 -фрагмента от молекулы D -ксилулозо-5-фосфата на молекулу C4 -сахара по той же схеме, что и в первой транскетолазной реакции.
 |
| Рис. 66. Окислительный пентозофосфатный путь (конечные этапы): Ф1 — транскетолаза; Ф2 — трансальдолаза; кружками обведены C2 — гликольальдегидная и C3 — диоксиацетоновая группы; в квадраты заключены C3 — 3-фосфоглицериновый альдегид (3-ФГА), C4 — D -эритрозо-4-фосфат, C6 — D -фруктозо-6-фосфат, C7 — D -седогептулозо-7-фосфат (по Schlegel, 1972) |
Итог этих взаимопревращений таков: из 3 молекул пентозофосфата синтезируются 2 молекулы фруктозо-6-фосфата и 1 молекула 3-ФГА. Фруктозо-6-фосфат ферментативно превращается в глюкозу, и 2 молекулы глюкозы снова возвращаются в цикл. 2 молекулы 3-ФГА также могут конденсироваться с образованием 1 молекулы глюкозы. В результате функционировавания полного окислительного пентозофосфатного пути из 6 поступающих в него молекул глюкозы 5 молекул ревосстанавливаются, а одна полностью окисляется до CO2 , что приводит к восстановлению 12 молекул НАДФ+ до НАДФ-H2 . Это можно представить в виде следующего уравнения:
6 глюкозо-6-фосфат + 12НАДФ+ ® 5 глюкозо-6-фосфат + 6CO2 + 12НАДФ-H2 + ФН .
Таким образом, окислительный пентозофосфатный путь может служить циклическим механизмом полной деградации углеводов, при этом водород, отщепленный от глюкозы, поступает в электронтранспортную цепь и переносится на O2 .
Остановимся теперь на функциях последнего этапа пути. Как механизм, обеспечивающий полную деградацию углеводов, этот путь не получил универсального распространения, хотя есть эубактерии, осуществляющие разложение углеводов в аэробных условиях только по окислительному пентозофосфатному пути. У многих организмов, использующих пентозы в качестве субстратов брожения, окислительный пентозофосфатный путь служит для превращения пентоз в гексозы, которые затек сбраживаются в гликолитическом пути. Кроме того, выше мы упоминали о двух точках пересечения этого пути с гликолизом на этапах образования 3-ФГА и фруктозо-6-фосфата. Все это говорит о тесном контакте окислительного пентозофосфатного пути с гликолизом и о возможном переключении с одного пути на другой. Наконец, помимо пентоз, образующихся на начальных этапах пути, возникновение C4 - и C7 -сахаров в транскетолазной и трансальдолазной реакциях также представляет определенный интерес для клетки, так как эти сахара являются исходными субстратами для синтеза ряда важных клеточных метаболитов.
ГЕТЕРОФЕРМЕНТАТИВНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ
К гетероферментативным молочнокислым бактериям, сбраживающим сахара с образованием молочной кислоты, CO2
, этанола и/или уксусной кислоты, относятся представители рода Leuconostoc
и бактерии, объединенные в подрод Betabacterium
рода Lactobacillus
(L. fermentum, L. brevis
). У них отсутствует ключевой фермент гликолитического пути — фруктозодифосфатальдолаза, и поэтому сбраживание субстратов они
29-04-2015, 01:57
