Гидрогеназы — одна из групп FeS-содержащих ферментов, катализирующих реакции поглощения и выделения молекулярного водорода, обнаружены у разных групп эубактерий: облигатных анаэробов и аэробов, факультативных форм, у хемо- и фототрофных организмов. Различаются строением молекулы, природой доноров и акцепторов электронов, с которыми взаимодействуют, локализацией в клетке, выполняемыми функциями. Но все гидрогеназы катализируют реакцию H2 ® 2H+ + 2e– .
Гидрогеназа C. pasteurianum , один из наиболее детально изученных ферментов, — белок с молекулярной массой примерно 60 000 Да, представленный одной субъединицей. В молекуле содержатся три центра типа Fe4 S4 . Донором (акцептором) электронов клостридиальной гидрогеназы служит ферредоксин.
При разрушении клеток C. pasteurianum гидрогеназная активность проявляется только в растворимой фракции: в периплазматическом пространстве и цитоплазме. Гидрогеназа, локализованная в периплазматическом пространстве, катализирует необратимую реакцию поглощения H2 . Находящаяся в цитоплазме гидрогеназа способна катализировать реакции как поглощения, так и выделения H2 . У клостридиев она входит в состав ферментного комплекса, осуществляющего окислительное декарбоксилирование пирувата (см. рис. 57).
Основная функция гидрогеназ клостридиев (и других облигатных анаэробов) заключается в избавлении от избытка образующихся в катаболических реакциях восстановительных эквивалентов (электронов), которые переносятся на H+ и удаляются из клетки в виде молекулярного водорода.
Гидрогеназы других эубактерий могут иметь более сложное строение: состоять из нескольких неидентичных субъединиц, содержать помимо FeS-центров флавины в качестве простетических групп. Помимо ферредоксинов гидрогеназы разных организмов могут взаимодействовать с довольно широким набором переносчиков электронов: цитохромами c , НАД (Ф), хинонами и др.
В то время как поглощение На происходит только с участием гидрогеназ, выделение молекулярного водорода у эубактерий, способных к фиксации N2 , наряду с гидрогеназой может катализироваться и нитрогеназой. Согласно одной из точек зрения, гидрогеназы возникли в результате усложнения структуры ферредоксинов.
Ацетил-КоА превращается в ацетилфосфат, а затем в ацетат, при этом синтезируется молекула АТФ. Две последние реакции аналогичны тем, которые происходят при образовании уксусной кислоты в пропионовокислом брожении (см. рис. 56).
Основным источником выделяемых при брожении газообразных продуктов (CO2 и H2 ) служит реакция окислительного декарбоксилирования пирувата. У клостридиев описаны и другие пути образования молекулярного водорода. В частности, НАД-H2 , возникающий на гликолитическом пути, может восстанавливать ферредоксин в реакции, катализируемой НАД-H2 :ферредоксиноксидоредуктазой, а с восстановленного ферредоксина H2 выделяется при участии гидрогеназы. Как видно, природа нашла различные пути для избавления от избытка восстановительных эквивалентов и для регенерирования и последующего возвращения в клеточный метаболизм промежуточных переносчиков водорода.
Выведение уравнения маслянокислого брожения и определение его энергетического выхода затруднительно из-за лабильности процесса, состоящего из двух основных ответвлений: одного — окислительного, ведущего к образованию ацетата и АТФ, другого — восстановительного, функция которого — акцептирование водорода, образовавшегося в процессе гликолиза. Количественное соотношение между обоими ответвлениями зависит от многих внешних факторов (состав среды, стадия роста и др.).
Расчеты показали, что в целом на 1 моль сбраживаемой глюкозы в маслянокислом брожении образуется 3,3 моля АТФ. Это наиболее высокий энергетический выход брожения, т. е. получения энергии за счет субстратного фосфорилирования, из всех рассмотренных выше типов брожений.
Некоторые клостридии (C. acetobutylicum, C. bejerinckii, C. cellobioparum и др.) при сбраживании сахаров наряду с кислотами накапливают в среде нейтральные продукты (бутиловый, изопропиловый, этиловый спирты, ацетон). Особенно много нейтральных продуктов образуется культурой C. acetobutylicum, что дало основание в свое время выделить как вариант маслянокислого брожения ацетоно-бутиловое брожение. У клостридиев, осуществляющих ацетоно-бутиловое брожение, образование масляной кислоты происходит на первом этапе брожения. По мере подкисления среды (до pH ниже 5) и повышения в ней концентрации жирных кислот индуцируется синтез ферментов, приводящих к накоплению нейтральных продуктов, в первую очередь н -бутанола и ацетона. н -Бутанол образуется из бутирил-КоА, предшественника масляной кислоты, в результате двух последовательных ферментативных реакций (рис. 60). Первая из них заключается в отщеплении кофермента А и одновременном гидрировании, приводящем к образованию масляного альдегида. Последующее его восстановление с помощью НАД-H2 приводит к появлению н -бутанола. Путь, ведущий к образованию ацетона, начинается с переноса от ацетоацетил-КоА кофермента А на ацетат. Декарбоксилирование ацетоуксусной кислоты приводит к образованию ацетона. Образование этанола происходит в результате двухступенчатого восстановления ацетил-КоА.
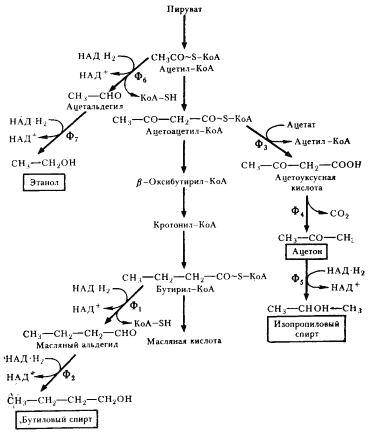 |
| Рис. 60. Образование нейтральных продуктов при маслянокислом брожении: Ф1 — бутирилальдегиддегидрогеназа; Ф2 — бутанолдегидрогеназа; Ф3 — КоА-трансфераза; Ф4 — ацетоацетатдекарбоксилаза; Ф5 — изопропанолдегидрогеназа; Ф6 — ацетальдегиддегидрогеназа; Ф7 — алкогольдегидрогеназа |
Физиологический смысл дополнительных ферментативных этапов у C. acetobutylicum , ведущих к накоплению в среде н -бутанола, этанола и ацетона, заключается в образовании конечных продуктов нейтрального характера. Первоначально нейтральный pH среды вследствие накопления масляной и уксусной кислот быстро падает. Некоторые клостридии выработали механизм борьбы с нарастающей кислотностью, который начинает функционировать при низком pH среды и приводит к появлению перечисленных выше нейтральных продуктов. Одновременно происходит понижение общей кислотности среды, что также свидетельствует об активном противодействии этих бактерий неблагоприятным условиям.
Изучение физиологии группы клостридиев, осуществляющих ацетоно-бутиловое брожение, привело к открытию В. Н. Шапошниковым (1884 — 1968) явления двухфазности этого процесса, которое позднее было обнаружено в большинстве типов брожений, характеризующихся сложным набором конечных продуктов. В основе явления двухфазности лежит тесная связь между конструктивными и энергетическими процессами. Вначале, когда имеет место активный рост культуры, сопровождающийся интенсивными биосинтетическими процессами, происходит значительный отток образующегося при брожении восстановителя для конструктивных целей. Это сопровождается преобладающим синтезом более окисленных конечных продуктов брожения (I фаза). При затухании роста и переходе культуры в стационарное состояние уменьшается потребность в восстановителе для конструктивных целей. Последнее приводит к большему его использованию в энергетических процессах и, следовательно, к образованию более восстановленных конечных продуктов брожения (II фаза). Таким образом, масштабы конструктивного метаболизма определяют характер и направление энергетических процессов.
Как можно оценить возникшую у маслянокислых бактерий последовательность ферментативных реакций, ведущих к синтезу масляной кислоты, а также дополнительные ферментативные этапы, ведущие к синтезу н -бутанола и ацетона? На пути от ацетил-КоА до масляной кислоты в двух точках имеет место акцептирование водорода с НАД-H2 . Синтез н -бутанола из бутирил-КоА связан еще с двумя восстановительными этапами. Итак, образование н -бутанола вызвано не только противодействием нарастающей кислотности. Этот дополнительно развившийся участок пути весьма эффективен в качестве ферментативных преобразований, связанных с утилизацией возникающих в процессе брожения молекул НАД-H2 .
Рассмотрим под этим же углом зрения путь, ведущий к синтезу ацетона. Метаболизирование части ацетоацетил-КоА через ацетоуксусную кислоту в ацетон приводит к определенной потере потенциальных акцепторов водорода, которые могли бы на пути к образованию масляной кислоты или н -бутанола присоединить соответствующее количество водорода с НАД-H2 . Однако этот путь является более коротким путем образования нейтральных продуктов, что, вероятно, для бактерий в определенных условиях выгодно. Кроме того, попыткой как-то компенсировать этот недостаток можно объяснить возникновение у некоторых видов клостридиев способности ферментативно восстанавливать ацетон в изопропанол с использованием водорода с НАД-H2 .
С точки зрения решения обеих проблем (нейтрализация среды и акцептирование восстановительных эквивалентов, образующихся при гликолизе), наиболее эффективен путь, ведущий к синтезу этанола, на двух этапах которого происходит акцептирование водорода с НАД-H2 . Некоторые клостридии в качестве одного из нейтральных продуктов образуют значительные количества этанола.
БАКТЕРИИ РОДА Clostridium
К клостридиям относят большое количество видов бактерий, число которых постоянно возрастает. Это один из самых крупных родов среди эубактерий. Принадлежность к роду определяется на основании только трех признаков: 1) способности образовывать эндоспоры; 2) облигатно анаэробного характера энергетического метаболизма; 3) неспособности осуществлять диссимиляционное восстановление сульфата. Отсюда понятно, что эта таксономическая группа эубактерий чрезвычайно гетерогенна, о чем, в частности, свидетельствует интервал значений ГЦ-оснований ДНК, молярное содержание которых с учетом описанных новых видов занимает область от 21 до 57%.
Из этого можно также сделать вывод, что организмы, объединяемые в род Clostridium , нельзя рассматривать как эволюционно однотипные. Последующая характеристика их метаболических особенностей дает достаточно четкое представление об этом. Изучение эубактерий, относимых к клостридиям, наоборот, указывает на раннее расхождение видов рода в процессе эволюции.
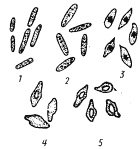 |
| Рис. 61. Процесс спорообразования у клостридиев: 1 — молодые вегетативные клетки; 2 — клетки, находящиеся в стационарной фазе; 3, 4 — стадии спорообразования; 5 — клетки с созревшими спорами (по Иерусалимскому, 1963) |
За исключением C. coccoides , вегетативные клетки бактерий из рода Clostridium имеют форму прямых или слегка изогнутых палочек с закругленными концами (рис. 61). Большинство видов грамположительные, подвижные. Движение осуществляется с помощью перитрихиально расположенных жгутиков. По мере старения в процессе цикла развития клетки теряют подвижность, накапливают гранулезу (запасное вещество типа крахмала) и переходят к спорообразованию. Образующиеся споры овальной или сферической формы. Диаметр их, как правило, превышает диаметр вегетативной клетки, поэтому, если формирующаяся спора расположена в центре клетки, последние меняют форму, становясь веретеновидными (рис. 61); если же споры образуются у одного из клеточных концов, клетки приобретают форму барабанных палочек.
Клостридии — облигатные анаэробы. Однако спектр их чувствительности к молекулярному кислороду достаточно широк, что связано с обнаружением в клетках большинства клостридиев супероксиддисмутазы и с другими приспособлениями на уровне клеточных популяций, помогающими нейтрализовать токсические эффекты O2 и его производных. Именно при работе с клостридиями Л. Пастер в 1861 г. открыл форму жизни без кислорода.
Энергетический метаболизм
В зависимости от вида сбраживаемого субстрата выделяют несколько физиологических групп клостридиев: сахаролитические клостридии, использующие в качестве субстратов брожения вещества углеводной природы (моносахара, крахмал, клетчатка); протеолитические клостридии, субстратами брожения которых являются белки, пептиды, аминокислоты; пуринолитические клостридии, специфически приспособленные к сбраживанию гетероциклических соединений (пурины и пиримидины). Среди них есть виды, обладающие довольно широкими возможностями (субстратами брожения служат как углеводы, так и белки), и узкоспециализированные виды, способные использовать в качестве источника энергии и углерода какое-либо одно или очень небольшое число соединений.
Субстратами брожения сахаролитических клостридиев служат такие моносахара, как глюкоза, фруктоза, лактоза, ксилоза и др. Некоторые виды могут использовать крахмал, целлюлозу, пектин, хитин, предварительно гидролизуемые соответствующими экзоферментами. Типичными представителями сахаролитических клостридиев, осуществляющих разобранное в предыдущем разделе классическое маслянокислое брожение, являются C. butyricum и C. pasteurianum . Известны среди клостридиев виды, сбраживающие сахара по гликолитическому пути, но без образования масляной кислоты (табл. 17). Пути, ведущие к биосинтезу большинства перечисленных в таблице продуктов брожений, осуществляемых клостридиями, уже обсуждались нами при разборе маслянокислого и других видов брожений.
Для некоторых клостридиев (C. aceticum, C. thermaceticum, C. formicaceticum и др.) характерно сбраживание сахаров, приводящее практически к образованию только одного конечного продукта — уксусной кислоты (гомоацетатное брожение); из 1 молекулы сброженной гексозы синтезируется 3 молекулы ацетата. Изучение последовательности биохимических реакций, приводящих к этому, показало, что сбраживание 1 молекулы гексозы по гликолитическому пути приводит к образованию только 2 молекул ацетата. Одновременно образуются и 2 молекулы CO2 . Третья молекула ацетата синтезируется из 2 молекул CO2 принципиально иным путем. Фиксация углекислоты у гомоацетатных клостридиев46 происходит по нециклическому механизму, получившему название ацетил-КоА-пути, поскольку его ключевым метаболитом является ацетил-КоА (рис. 62). Одна из молекул CO2 , служащая источником метильной группы ацетата, на первом этапе восстанавливается с образованием формиата, а затем при участии тетрагидрофолиевой кислоты в качестве кофермента в несколько этапов восстанавливается до метил-ТГФК. С последнего метильная группа переносится на фермент, содержащий витамин B12 в качестве кофермента (корриноидный фермент), приводя к регенерированию ТГФК. С корриноидного фермента CH3 -группа поступает на CO-дегидрогеназу.
46 Виды, осуществляющие гомоацетатное брожение, называют также ацетогенными.
Таблица 17. Основные продукты брожения некоторых сахаролитических клостридиев, не образующих масляной кислоты
| Организм | Основные продукты брожения |
| C. sphenoides, C. glycolicum | этанол, уксусная кислота, CO2 , H2 |
| C. cellobioparum | этанол; уксусная, муравьиная, молочная кислоты; CO2 , H2 |
| C. clostridioforme | уксусная, молочная кислоты; CO2 , H2 |
| C. oroticum | этанол; уксусная, молочная, муравьиная кислоты; CO2 |
| C. coccoides | янтарная, уксусная кислоты |
| C. durum | этанол, пропанол; муравьиная, уксусная, молочная кислоты |
| C. nexile | этанол; муравьиная, уксусная, молочная, янтарная кислоты; H2 |
| C. quercicolum | уксусная, пропионовая кислоты, H2 |
| C. ramosum | муравьиная, уксусная, молочная, янтарная кислоты |
| C. aceticum, C. thermaceticum, C. formicaceticum, C. spiroforme | уксусная кислота |
Вторая молекула CO2 , углерод которой служит источником карбоксильной группы ацетата, при участии CO-дегидрогеназы восстанавливается до CO, оставаясь связанной с этим ферментом. CO-дегидрогеназа, ключевой фермент этого пути синтеза ацетата, имеет 3 центра, связывающие CH3 -, CO-группы и кофермент А. Затем на ферменте осуществляется карбоксилирование метильной группы и взаимодействие образовавшейся ацетильной группы с коферментом А, приводящее к образованию ацетил-КоА. По характеру превращений, катализируемых CO-дегидрогеназой, фермент правильнее называть ацетил-КоА-синтазой. Дальнейшие превращения ацетил-КоА до ацетата, сопровождающиеся образованием АТФ, описаны ранее.
К протеолитическим относятся клостридии, имеющие активные протеолитические ферменты и поэтому способные использовать в качестве субстратов белки и пептиды, гидролизуя их до аминокислот и подвергая затем последние сбраживанию. В эту группу входят C. putrifiicum, C. histolyticum, C. sporogenes и другие сапрофитные виды. Близки к этим видам и некоторые патогенные формы: C. botulinum — продуцент ботулина — экзотоксина, являющегося одним из самых сильных биологических ядов; C. tetani — столбнячная палочка, образующая в организме человека столбнячный токсин. К протеолитическим клостридиям примыкают виды, использующие в качестве источника углерода и энергии ограниченное число свободных аминокислот. Например, C. cochlearium растет только на среде с глутаминовой кислотой, глутамином и гистидином; C. sticklandii может сбраживать лизин, аргинин, фенилаланин, серин, а C. propionicum — треонин, аланин, серин, цистеин.
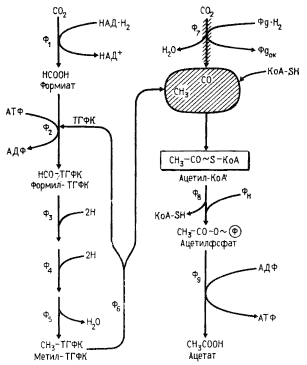 |
| Рис. 62. Ацетил-КоА-путь фиксации CO2 у гомоацетатных клостридиев: Ф1 — формиатдегидрогеназа; Ф2 — формил-ТГФК-синтаза; Ф3 — Ф5 -ферменты, катализирующие превращение формил-ТГФК до метил-ТГФК; Ф6 — корриноидный фермент; Ф7 — CO-дегидрогеназа (фермент изображен в виде заштрихованных стрелки и эллипса); Ф8 — фосфотрансацетилаза; Ф9 — ацетаткиназа |
Известны два типа сбраживания аминокислот клостридиями. Для многих клостридиев одна аминокислота может служить источником энергии и углерода, например, глутаминовая кислота — для C. tetanomorphum , лизин — для C. sticklandii . В этом случае ее диссимиляция приводит к возникновению метаболитов, характерных для гликолитического пути, и в первую очередь пирувата, дальнейшие превращения которого идут по одному из путей, описанных выше. У C. sticklandii сбраживание лизина приводит к образованию масляной и уксусной кислот и NH3 , а у C. tetanomorphum при сбраживании глутаминовой кислоты в дополнение к перечисленным выше продуктам образуется некоторое количество CO2 .
Ряд аминокислот может подвергаться сбраживанию клостридиями только парами. Механизм процесса был расшифрован Л. Стиклендом (L. Stickland) в 1934 г., показавшим, что при этом происходит сопряженное окисление-восстановление пары аминокислот, одна из которых окисляется, другая — восстанавливается. Такой тип сбраживания аминокислот получил название реакции Стикленда. Окисляемыми аминокислотами, т. е. донорами электронов, служат аспарагин, аланин, валин, серин, гистидин и др. Восстанавливаемые аминокислоты — глицин, пролин, орнитин, аргинин и др.
Наиболее обстоятельно изучен процесс сопряженного сбраживания аланина и глицина, которые, как правило, поодиночке большинством клостридиев не используются. Первым этапом превращений аланина является его окислительное дезаминирование, приводящее к образованию соответствующей a-кетокислоты, в данном случае пирувата:
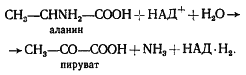
Пировиноградная кислота затем подвергается окислительному декарбоксилированию в реакции, катализируемой пируват:ферредоксин-оксидоредуктазой, приводящей в конечном итоге к синтезу молекулы АТФ и ацетата. На двух этапах окислительного преобразования аланина возникают восстановленные переносчики, которые используются для восстановления второй аминокислоты — глицина. Восстановительное дезаминирование глицина до ацетата — довольно сложная реакция. Катализирующая ее ферментная система связана с мембраной и состоит из нескольких белков, включая белок, содержащий селен:
| CH2 NH2 -COOH | + | НАД-H2 | ® | CH3 -COOH | + | NH3 | + | НАД+ . |
| глицин | ацетат |
В целом сопряженные окислительно-восстановительные превращения аланина и глицина могут быть выражены следующим образом:
аланин + 2H2 O ® ацетат + NH3 + CO2 + 4Н;
2 глицин + 4Н ® 2 ацетат + 2NH3 .
Получение энергии при сбраживании этой пары аминокислот связано с окислением аланина и соответствует 1 молекуле АТФ на молекулу окисленного аланина.
Обнаружены клостридии, специфически приспособленные к сбраживанию гетероциклических азотсодержащих соединений" в том числе пуринов и пиримидинов, — пуринолитические клостридии. Относящиеся к этой группе виды часто узкоспециализированы в отношении пищевых субстратов. Так, C. acidurici и C. cylindrosporum могут расти, сбраживая только некоторые пурины (гуанин, ксантин, гипоксантин, мочевая кислота) до уксусной и муравьиной кислот, глицина, NH3 и CO2 . C. uracilium и C. oroticum могут сбраживать пиримидины. C. oroticum использует оротовую кислоту, выделяя в среду уксусную и дикарбоновую кислоты, CO2 и NH3 . C. uracilium использует урацил, который распадается до b-аланина, CO2 и NH3 . Сбраживание пуринов и пиримидинов — сложный процесс, состоящий из многих последовательных реакций, в некоторых из них путем субстратного фосфорилирования синтезируется АТФ.
Совершенно особый тип брожения осуществляет C. kluyveri , сбраживающий смесь этанола и уксусной кислоты до масляной, капроновой кислот и H2 . Превращение этанола и уксусной кислоты в масляную и капроновую кислоты можно описать. следующими уравнениями:

Однако ни одна из этих реакций не приводит к синтезу АТФ. Энергетическая сторона процесса долгое время оставалась неясной. Оказалось, что получение энергии связано с образованием молекулярного водорода в процессе окисления этанола, дегидрирование которого на двух этапах приводит к синтезу ацетил-КоА:
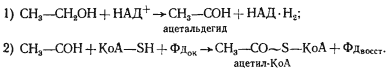
Электроны с ферредоксина могут переноситься далее
29-04-2015, 01:57
