ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ім. М. ГОРЬКОГО МОЗ УКРАЇНИ
лизогуб микола віталійович
УДК 617.51+616.831]-001-036-074-083.98
КЛІНІКО-ІМУНОХІМІЧНА ОЦІНКА ЕФЕКТУ ЗАХИСТУ МОЗКУ ПРИ ТЯЖКІЙ ЧЕРЕПНО-МОЗКОВІЙ ТРАВМІ
14.01.30 – анестезіологія та інтенсивна терапія
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Донецьк ─ 2008
Дисертацією є рукопис.
Робота виконана в Харківському національному медичному університеті МОЗ України при співпраці з ФДУ «Государственный научный центр социальной и судебной психиатрии им. В.П. Сербского Федерального агентства по здравоохранению и социальному развитию» (м. Москва, Російська Федерація).
Наукові керівники: д.мед.н., професор Хижняк Анатолій Антонович, Харківський національний медичний університет МОЗ України, завідувач кафедри анестезіології та інтенсивної терапії; д.мед.н. Гуріна Ольга Іванівна, Федеральна ДУ «Государственный научный центр социальной и судебной психиатрии им. В.П. Сербского Федерального агентства по здравоохранению и социальному развитию», завідувач відділом нейрохімії
Офіційні оппоненти: д.мед.н., професор Шано Валентина Петрівна, Донецький національний медичний університет імені М. Горького МОЗ України, професор кафедри анестезіології, інтенсивної терапії та медицини невідкладних станів факультету післядипломної освіти
д.мед.н., професор Зубков Віктор Іванович, Українська військово-медична академія МО України, професор кафедри анестезіології та реаніматології
Захист відбудеться « 8 » жовтня 2008 р. о 11 годині на засіданні спеціалізованої вченої ради Д.11.600.04 при Донецькому національному медичному університеті ім. М. Горького МОЗ України (83003, м. Донецьк, проспект Ілліча, 16)
З дисертацією можна ознайомитись у бібліотеці Донецького національного медичного університету ім. М. Горького МОЗ України (83003, м. Донецьк, проспект Ілліча, 16)
Автореферат розісланий « 26 » вересня 2008 р.
Вчений секретар
спеціалізованої вченої ради, доцент
А.М. Колeсніков
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Щороку у світі від черепно-мозкової травми гине 1,5 мільйона чоловік, а 2,4 мільйона стають інвалідами (Лихтерман Л.Б., 2000). Частота черепно-мозкових травм у різних регіонах України складає від 2,3 до 4,2‰ (Марков А.В. із співавт., 2005), летальність при тяжких її формах перевищує 40% (Сук В.М. із співавт., 2008). Тому, удосконалення методів лікування хворих на тяжку черепно-мозкову травму (ТЧМТ) є актуальною проблемою сучасної інтенсивної терапії (Чепкий Л.П., 1998, Усенко Л.В. із співавт., 2006, Царенко С.В., 2007, LescotT. etal., 2008).
Однією з провідних проблем у інтенсивній терапії тяжкої ЧМТ є боротьба з набряком головного мозку та вторинним ішемічним його ушкодженням (Усенко Л.В. із співавт., 2006, Черній В.І. із співавт., 2007, Глумчер Ф.С. із співавт., 2008), розвиток яких залежить від порушення проникності гематоенцефалічного бар’єру (ГЕБ).
Методи оцінки ступеню ураження головного мозку та проникності ГЕБ у пацієнтів з різними неврологічними та нейрохірургічними захворюваннями знаходяться останнім часом під підвищеною увагою: по-перше, вони допомагають розшифрувати патогенез вторинних ішемічних ушкоджень головного мозку (BergerR. etal., 2007, GerlachR. etal., 2006, PleinesU. etal., 2001) на клітинному та молекулярному рівні, а, по-друге, з ними тісно пов’язані методи направленого транспорту до мозку різних речовин (Чехонін В.П., 2004).
Дослідження останніх років довели (Чурляев Ю.А. із співавт., 2002, HerrmannM. etal., 2001, PelinkaL., 2004), що ушкодження головного мозку та порушення проникності ГЕБ супроводжуються елімінацією у кров нейроспецифічних речовин, у тому числі нейроспецифічних білків (НСБ). На сьогоднішній день відомо більше 65 НСБ, проте найбільш вивченими є білок S-100 (GerlachR. etal., 2006, IngebrigstenT. etal., 2000), нейронспецифічна енолаза (NSE) (BergerR. etal. 2007, LiN. etal., 2004, McKeatingE. etal., 1998), гліальний фібрилярний кислий протеїн (GFAP) (Чехонін В.П. із співавт., 2004, PelinkaL., 2004, VosP. etal., 2004). Дослідження GFAPта NSEу комплексі дозволяє оцінити ушкодження різних клітин (нейронів та астроглії) головного мозку (Чехонін В.П. із співавт., 2007).
Питання медикаментозної профілактики вторинних ішемічних ушкоджень головного мозку продовжують активно розроблятися (Клігуненко О.М. із співавт., 2007, Усенко Л.В. із співавт., 2006, Хижняк А.А. із співавт., 2006). Частина заходів інтенсивної терапії, що входили до алгоритмів лікування черепно-мозкової травми ще декілька років тому, сьогодні вже використовуються обмежено, або взагалі не використовуються, враховуючі дані доказової медицини, – глюкокортикоїди (AldersonP. etal., 2005), лікувальна гіпотермія (AldersonP. etal., 1999), великі дози барбітуратів (RobertsI., 1998).
Розроблені останнього часу препарати L-лізину есцинат та мексидол вже довели свою клінічну ефективність (Акшулаков С.К. із співавт., 2006, Спасіченко П.В., 2000, Усенко Л.В. із співавт., 2002, Черній В.І. із співавт., 2001). Використання обох препаратів має під собою патогенетичне обґрунтування та відповідає концепції мультимодальної нейропротекторної терапії, що спрямована на декілька ланок патогенезу церебральної ішемії (Павленко А.Ю., 2006).
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційна робота «Клініко-імунохімічна оцінка ефекту «захисту мозку» при тяжкій черепно-мозковій травмі» є фрагментом планової науково-дослідницької роботи кафедри медицини невідкладних станів та анестезіології Харківського національного медичного університету «Антистресорний захист при ушкодженнях головного мозку різної етіології» (№ державної реєстрації 0104U002242) та науково-дослідницької роботи ФДУ «ГНЦССиП им. В.П.Сербского» «Научное обоснование и разработка новых направлений, технологий и управления качеством оказания психиатрической и медико-психологической помощи населению в условиях реформирования здравоохранения и социальных преобразований, совершенствование на этой основе судебно-психиатрической экспертизы и профилактики общественно опасных действий психических больных» (№ державної реєстрації 0120.0803299).
Мета дослідження: покращення результатів лікування хворих на тяжку черепно-мозкову травму шляхом удосконалення діагностики цілісності гематоенцефалічного бар’єру та оптимізації нейропротекторних компонентів інтенсивної терапії.
Задачі дослідження:
1. Вивчити особливості епідеміології та проявів ізольованої тяжкої черепно-мозкової травми.
2. Вивчити концентрацію нейронспецифічної енолази та гліофібрилярного кислого протеїну у сироватці крові здорових донорів.
3. Оцінити цілісність гематоенцефалічного бар’єру у постраждалих на тяжку черепно-мозкову травму шляхом визначення концентрації нейроспецифічних білків гліофібрилярного кислого протеїну та нейронспецифічної енолази у сироватці крові у момент надходження.
4. Дослідити динаміку концентрації нейроспецифічних білків гліофібрилярного кислого протеїну та нейронспецифічної енолази у сироватці крові постраждалих на тяжку черепно-мозкову травму, що отримували стандартну інтенсивну терапію.
5. Дослідити вплив оптимізованих методів інтенсивної терапії на динаміку концентрації нейроспецифічних білків гліофібрилярного кислого протеїну та нейронспецифічної енолази у сироватці крові постраждалих на тяжку черепно-мозкову травму.
6. Оцінити вплив оптимізованих методів інтенсивної терапії на перебіг та результати лікування тяжкої черепно-мозкової травми.
Об’єкт дослідження – пацієнти тяжкою черепно-мозковою травмою, здорові донори.
Предмет дослідження – діагностика стану гематоенцефалічного бар’єру, способи інтенсивної терапії та способи оцінювання ефективності лікування тяжкої черепно-мозкової травми.
Методи дослідження – загальноклінічні, біохімічні, магнітно-резонансна томографія головного мозку, імунологічні, статистичні.
Наукова новизна отриманих результатів. Вперше встановлена роль нейроспецифічних білків NSEта GFAPу діагностиці порушень цілісності гематоенцефалічного бар’єру при тяжкій черепно-мозковій травмі.
Вперше встановлено, що первинне ушкодження нейронів та астроцитів призводить до надходження у кров нейроспецифічних білків NSEта GFAPпротягом перших 6 годин тяжкої черепно-мозкової травми.
Вперше встановлено, що концентрація нейронспецифічної енолази у гострому періоді тяжкої ЧМТ відображує рівень свідомості.
Вперше встановлено, що використання L-лізину есцинату в дозі 20 мл/добу та мексидолу у дозі 800 мг/добу внутрішньовенно у комплексі інтенсивної терапії тяжкої черепно-мозкової травми зменшує елімінацію у кров нейроспецифічних білків, у порівнянні із стандартною терапією, що свідчить про здатність стабілізувати гематоенцефалічний бар’єр у цих препаратів.
Практичне значення отриманих результатів. Запропонована схема інтенсивної терапії тяжкої черепно-мозкової травми забезпечує зменшення тривалості штучної вентиляції легенів на 29,2%, прискорення відновлення свідомості на 17,4% та зниження летальності у гострому періоді на 10,1%. Запропонована схема інтенсивної терапії впроваджена у роботу Харківської міської клінічної лікарні швидкої та невідкладної медичної допомоги ім. проф. О.І. Мєщанінова, Харківської обласної клінічної лікарні, Дніпропетровської міської лікарні №11, матеріали дисертації використовуються у навчальному процесі лікарів-інтернів та лікарів-курсантів анестезіологів Харківського національного медичного університету.
Особистий внесок здобувача. Разом з науковими керівниками д.мед.н. професором А.А. Хижняком та д.мед.н. О.І. Гуріною визначені напрямки дослідження, сформульовані мета та задачі. Патентно-інформаційний пошук, огляд літератури, набір та обробка фактичного матеріалу, отримання нейроспецифічних білків GFAPта NSEу чистому вигляді, клінічні дослідження, розподіл хворих на групи, проведення інтенсивної терапії, імуноферментний аналіз нейроспецифічних антигенів, статистична обробка, теоретичне узагальнення результатів роботи та їх практичне впровадження виконані автором самостійно.
Апробація результатів дисертації. Матеріали дисертації висвітлені у доповідях та обговорені на 4 з’їзді анестезіологів України (м. Донецьк, 2004 р.), науково-практичній конференції «Принципи захисту хворого від ендогенної та екзогенної агресії у анестезіології та інтенсивній терапії» (м. Донецьк, 2008 р.), 4 з’їзді нейрохірургів України (м. Дніпропетровськ, 2008 р.), на засіданнях Харківської обласної Асоціації анестезіологів та ФДУ «ГНЦССиП им. В.П.Сербского».
Апробація дисертації відбулася на спільному засіданні кафедри медицини невідкладних станів і анестезіології та кафедри госпітальної хірургії Харківського національного медичного університету 25 лютого 2008.
Публікації. За темою дисертації опубліковано 9 наукових праць, із них 4 – у наукових журналах, затверджених ВАК України, отримано патент на корисну модель та надруковані методичні рекомендації із грифом МОЗ України.
Обсяг та структура дисертації. Дисертація викладена на 123 сторінках машинописного тексту, складається з вступу, огляду літератури, матеріалів та методів, результатів власних досліджень, аналізу та узагальнення отриманих результатів, висновків, практичних рекомендацій, ілюстрована 23 рисунками, містить 9 таблиць. Список використаної літератури містить 180 джерел, із них 70 літературних джерел із країн СНД та 110 іноземних джерел.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал та методи. До дослідження увійшли 191 пацієнтів у віці від 18 до 65 років з тяжкою ЧМТ, що знаходились на лікуванні у відділенні інтенсивної терапії Харківської міської клінічної лікарні швидкої та невідкладної медичної допомоги ім. проф. О.І. Мєщанінова та 45 здорових донорів.
Дизайн дослідження (рис. 1) – клініко-біохімічне проспективне рандомізоване дослідження. Умовою включення була тяжка черепно-мозкова травма (8 балів та менше за шкалою ком Глазго). Умовою виключення пацієнтів з дослідження була наявність захворювань та травм нервової системи в анамнезі.
Для оцінки ефективності різних схем інтенсивної терапії усі пацієнти були розподілені в момент надходження на 3 групи за допомогою простої фіксованої рандомізації з використанням методу випадкових чисел.
Пацієнти групи 1 (n= 76) отримували стандартну інтенсивну терапію, згідно існуючим рекомендаціям. Пацієнтам 2 групи (n= 58) до комплексу інтенсивної терапії було включено препарат L-лізину есцинат, що має протинабряковий та ангіопротекторний ефект, в дозі 20мл/добу протягом 7-8 діб. Пацієнтам 3 групи (n= 57) проводилась мультимодальна нейропротекторна терапія шляхом включення до комплексу інтенсивної терапії L-лізину есцинату в дозі 20 мл/добу та мексидолу в дозі 800 мг/добу (антиоксидантний та антигіпоксичний препарат). Умовно здорові донори (n= 45) склали контрольну групу.
Діагноз встановлювався на основі даних анамнезу, клінічного та неврологічного дослідження. Із інструментальних методів використовували МРТ головного мозку (томограф Образ-1 з індукцією магнітного поля 0,12 Тл), ехоенцефалоскопію та краніографію.
Рис. 1 Дизайн дослідження.
Умови включення пацієнтів |
1. Тяжка ізольована черепно-мозкова травма (8 балів та менше за ШКГ) |
||||
| Умови виключення пацієнтів | Наявність захворювань та травм нервової системи в анамнезі | ||||
| Загальна кількість пацієнтів | 191 пацієнт Чоловіків– 154 Жінок– 37 |
||||
| Рандомізація | Фіксована пряма рандомізація з використанням методу випадкових чисел | ||||
| Параметри розподілу на групи |
|
||||
| Стандартна | Стандартна звключенням L-лізинуэсцинату20 мл/добупротягом 7-8 діб |
Стандартна звключенням L-лізинуэсцинату20 мл/добупротягом 7-8 дібта мексидолу800 мг/добу |
|||
| ГРУПА 1 | ГРУПА 2 | ГРУПА 3 | |||
76 паціентів чоловіків– 60, жінок– 16 ШКГ = 6,6 ± 0,3 |
58 паціентів чоловіків– 49, жінок– 9 ШКГ = 6,8 ± 0,2 |
57 паціентів чоловіків– 45, жінок– 12 ШКГ = 6,3 ± 0,2 |
|||
| Ознаки, що оцінюються | 1. Летальність. 2. Динаміка рівню свідомості. 3. Тривалість штучної вентиляції легенів. 4. Динаміка концентрації нейроспецифічних білків (GFAPтаNSE). |
||||
У реанімаційному залі пацієнту забезпечувався центральний венозний доступ та, враховуючи коматозний стан, вони переводилися на ШВЛ ендотрахеальним способом, починала проводитись інфузійна терапія та пацієнтів переводили до операційної. Середній час від моменту надходження до стаціонару до переводу до операційної складав 24 ± 7 хвилин.
Ургентне оперативне втручання проводилось в умовах внутрішньовенної багатокомпонентної анестезії з ШВЛ. З препаратів для наркозу використовували: тіопентал натрію 3,5 ± 0,5 мг/кг, а потім по 1,5 мг/кг кожні 20 хвилин операції; оксибутират натрію 60,0 ± 5,0 мг/кг, потім по 30,0 ± 5,0 мг/кг кожну годину хірургічного втручання; сибазон 0,25 ± 0,05 мг/кг; фентаніл 10 мкг/кг протягом першої години операції, 5 мкг/кг протягом другої години операції. Міоплегія проводилась ардуаном в дозі 0,06 мг/кг протягом першої години операції та 0,03 мг/кг в наступні години. ШВЛ під час операції проводилась в режимі помірної гіпервентиляції.
Після оперативного втручання усі пацієнти потребували проведення інтенсивної терапії. Стандартний комплекс інтенсивної терапії включав наступні положення:
1. Положення у ліжку з піднятим головним кінцем на 15-20 °.
2. ШВЛ у режимі нормовентиляції (ДО = 6-7 мл/кг, ЧД = 16-18 за хв., FiO2 =30 %) частотним респіратором протягом всього періоду коматозного стану.
3. Загальний об’єм інфузійної терапії призначався з розрахунку 40 мл/кг на добу з корекцією патологічних втрат за методом балансів. Основним препаратом для інфузії був ізотонічний розчин натрію хлориду. Для підтримання колоїдно-осмотичного тиску використовувались препарати на основі гідроксиетильованого крохмалю (Рефортан) та модифікованої желатини (Гелофузін) в об’ємі 20% від загальної кількості рідини, що вводилась. Розчин альбуміну призначали лише при наявності гіпопротеінемії менш ніж 50 г/л. Еритроциарна маса призначалась при рівні гемоглобіну менш ніж 80 г/л.
4. З метою корекції показників гемодинаміки за необхідністю використовувались симпатомиметики (адреналін 0,05-0,1 мкг/кг/хв. або дофамін 7-10 мкг/кг/хв.). Середній артеріальний тиск утримувався на рівні не менше 90 мм рт. ст.
5. Аналгоседація проводилась у пацієнтів протягом перших 2-3 діб.
6. З антиоксидантних препаратів усім пацієнтам вводилась аскорбінова кислота в дозі 500 мг/добу.
7. Антибактеріальні препарати використовували з урахуванням ступеню проникності їх крізь ГЕБ (цефалоспорини 3 та 4 покоління). При приєднанні вентилятор-асоційованої пневмонії призначався другий антибактеріальний препарат (фторхінолони або аміноглікозиди).
8. Усім пацієнтам призначалося раннє (з 2 доби) зондове харчування готовими сумішами відповідно міжнародним рекомендаціям за системою ESPEN.
9. Лікувальні заходи, спрямовані на профілактику утворення стресових виразок, проводили за допомогою Н2 -блокаторів (квамател 40мг/добу).
10. Ноотропні стимулюючі засоби (пірацетам 10 г/добу) призначали при підвищенні рівня свідомості до 10 балів ШКГ та вище.
Забір крові для визначення концентрації GFAPта NSEу пацієнтів з ТЧМТ проводили протягом перших 2 годин після надходження та в подальшому на 2-3, 6-7, 10-11 та 13-15 добу. Кров центрифугували 10 хв. при 2000 g, сироватку заморожували при температурі -20 °С та тримали при цих умовах до проведення дослідження.
Під керівництвом д.мед.н. О.І. Гуріної нами були отримані високоочищені препарати нейроспецифічних білків GFAPта NSEта на їх основі розроблені діагностичні тест-системи на основі моноклональних антитіл для «сендвіч-варіанту» імуноферментного аналізу, які дозволяли надійно та відтворювано визначати концентрації GFAPта NSEу сироватці крові у інтервалі концентрацій від 1 до 128 нг/мл з межею чутливості 1 нг/мл.
Статистичний аналіз проводили за допомогою ліцензійних програмних пакетів MSOfficeXP.Розраховувались М (середня), s(стандартне відхилення) та m(стандартна похибка стандартного відхилення). Для оцінки достовірності відмінностей використовували t– критерій Стьюдента. Для багаторазових порівнянь використовувалась поправка Бонфероні. Для виявлення зв’язку між величинами використовувався кореляційний аналіз з розрахунком коефіцієнту кореляції Пірсона.
Результати власних досліджень. Аналіз етіології ізольованої тяжкої ЧМТ показав, що найбільшу кількість хворих складали пацієнти, що отримали травму внаслідок падіння з висоти зросту (84,8%). Друге місце займав дорожньо-транспортний травматизм (11%). Більшість пацієнтів – це чоловіки у віці понад 35 років, що страждали на хронічний алкоголізм. Найчастішим проявом ізольованої ТЧМТ була субдуральна гематома (63,9% постраждалих); рідшим інтракраніальним проявом тяжкої ЧМТ була епідуральна гематома (25,6% пацієнтів). Вогнища забою, що потребували хірургічної корекції, спостерігалися у 45% постраждалих.
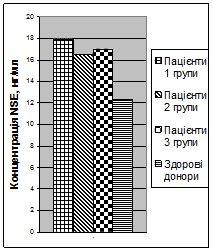
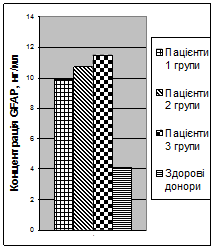
При імунохімічному дослідженні сироватки крові здорових донорів було визначено, що концентрація GFAPскладала 3,0 ± 0,12 нг/мл (не перевищувала 4,1 нг/мл), а концентрація NSEскладала 7,7 ± 0,39 нг/мл (не перевищувала 12,4 нг/мл).
При дослідженні концентрації GFAPу сироватці крові пацієнтів з ТЧМТ (рис. 3) було виявлено, що у пацієнтів 1, 2 та 3 груп вона достовірно не відрізнялась, складаючи 9,9 ± 0,5 нг/мл, 10,7 ± 0,9 нг/мл та 11,5 ± 0,9 нг/мл відповідно, та достовірно (p< 0,01) перевищувала донорський рівень.
При дослідженні концентрації NSE(рис. 2) при надходженні також не було виявлено різниці між групами (концентрація складала 18,3 ± 3,5 нг/мл, 16,5 ± 2,5 нг/мл та 17,0 ± 1,8 нг/мл відповідно у пацієнтів 1, 2 та 3 груп), та концентрація достовірно (p< 0,01) перевищувала донорський рівень. Виявлений середньої сили кореляційний зв’язок (r= - 0,57) між концентрацією NSEта рівнем свідомості при надходженні у пацієнтів з ТЧМТ.
Рис. 2Концентрація NSEу сироватці крові у перші 6 годин після тяжкої ЧМТ |
Рис. 3Концентрація GFAPу сироватці крові у перші 6 годин після тяжкої ЧМТ |
Таким чином, протягом перших 6 годин тяжкої ЧМТ відзначався прорив ГЕБ з «виходом» у кров нейроспецифічних білків GFAPтаNSE, що є результатом значного первинного ушкодження нейронів та астроцитів. Нейронспецифічна енолаза може служити додатковим діагностичним критерієм тяжкості нейротравми.
При кількісному динамічному моніторингу концентрації GFAPу пацієнтів, що отримували стандартну терапію (1 група), були виявлені наступні зміни (рис. 5). У динаміці травматичної хвороби головного мозку концентрація
8-09-2015, 22:15