Виходячи з того, що гістологічне дослідження не завжди може підтвердити гострі ішемічні порушення в міокарді, оскільки для розвитку виразних морфологічних змін в серці необхідно не менше 6-12 годин, з метою об’єктивізації судово-медичного дослідження та встановлення реальної можливості післясмертного виявлення патологічних змін в міокарді у випадках раптової смерті внаслідок ГІХС було проведене вивчення маркеру некрозу – серцевого Тропоніна І в цільній крові. В основу принципу дії тесту на визначення сТn І покладено принцип хроматографії, при якій відбувається міграція нанесених антитіл до сТn І вздовж мембрани, реакція вказаних компонентів із реагентом, який заздалегідь нанесений на тестову ділянку мембрани і захоплює для селективного визначення сТn І в цільній крові, сироватці чи плазмі. В результаті реакції утворюється кольорова лінія, наявність якої свідчить про позитивний результат, в той час як відсутність лінії вказує на негативний результат тесту. Пороговий рівень визначення сТn І становить 0,5 нг/мл. Кількісний вміст сТn І чи ступінь його підвищення в крові, плазмі чи сироватці – тест не визначає. Тому він не може бути єдиним критерієм ГІХС, ІМ, а в сукупності з іншими лабораторними (перш за все – гістологічним) методами дослідження. Матеріалом дослідження була кров, узята із порожнин шлуночків серця 11 трупів осіб молодого та зрілого віку, що померли раптово, без наявних ознак насильницької смерті. Дослідження проводилося в умовах моргу Луганського обласного бюро судово-медичної експертизи.
З метою встановлення додаткових критеріїв диференціальної діагностики патологічних станів серця на основі власного способу визначення патологічних змін біологічних тканин (патент України на корисну модель №26357, 2007), було проведене дослідження лазерних поляриметричних зображень міокарда шлуночків серця осіб, загиблих внаслідок механічної травми (контрольна група - 7 осіб), та раптово померлих внаслідок гострої ішемічної хвороби серця ( 9 осіб).
Отримані дані опрацьовувались методами математичного аналізу для об¢єктивізації і кількісного описання властивостей як органа в цілому, так і його структурних компонентів: біометричний аналіз, варіаційна статистика. Розбіжності між груповими середніми величинами вважались вірогідними за умови довірчої імовірності безпомилкового судження не менш 0,95 (Р< 0,05) (Г.Г. Автандилов, 1984; Г.Ф. Лакін, 1990).
Результати дослідження та їх обговорення. За даними бюро судово-медичної експертизи управління охорони здоров'я Луганської обласної державної адміністрації за 5 років (2002-2006 р.р.) у м. Луганську серед померлих від причин, зумовлених ненасильницькою смертю, у 2250 (72,25%) випадках смерть наставала від ішемічної хвороби серця (ІХС), та інших захворювань системи кровообігу - 368 випадків (16,35%). Із них 1524 (67,7%) були чоловіки, 726 (32,3%) - жінки. Кількість померлих внаслідок захворювань системи кровообігу та, зокрема, від ІХС, збільшилась у 1,5 рази. Внаслідок гострої ішемічної хвороби серця (ГІХС) померло 164 (7,2%) осіб. Серед них - 134 (81%) чоловіків і 30 (19%) жінок. В основному, при розтинах, у померлих мали місце такі форми, як гостра коронарна недостатність з розвитком раптової коронарної смерті, гострий і повторний інфаркти міокарда різної локалізації, об'єму і площі поразнення серцевого м'яза. Основну масу (81%) померлих внаслідок гострої ішемічної хвороби серця складали особи чоловічої статі працездатного віку (рис. 1).
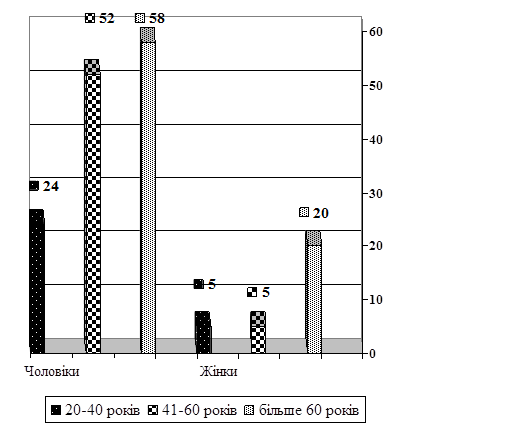
Рис. 1. Розподіл померлих мешканців м. Луганська у термін 2002-2006 р.р. внаслідок ГІХС за віком та статтю
Вивчення показників смертності внаслідок захворювань системи кровообігу серед населення Луганської області за останні 5 років (2002-2006 р.р.) дозволило встановити такі ж самі тенденції демографічних зрушень, як і серед мешканців м. Луганська. Серед померлих від причин ненасильницької смерті у 11161 (79,98%) випадків смерть настала від ІХС, та інших форм захворювань системи кровообігу. Із них 8527 (76,39%) були чоловіки, 2634 (23,61%) - жінки. Кількість померлих від захворювань системи кровообігу, та зокрема від ІХС - збільшилась у 1,5 рази. Загальна кількість померлих від ХІХС - 8028 (71,92%). З них 6149 (76,59%) чоловіків і 1879 (23,41%) жінок. У разі смерті внаслідок гострої ішемічної хвороби серця (ГІХС) померло 1116 (9,55%) осіб. Серед них: 917 (82%) чоловіків і 199 (18%) жінок. За віковими групами серед чоловіків померлі особи були розподілені таким чином: віком до 20 років - 22 випадки; 21-40 років – 360 випадків; від 41-60 років – 422 випадки; від 60 років і більше – 113 випадків. Серед жінок: віком до 20 років – 12 випадків; 21-40 років – 65 випадків; від 41-60 років – 97 випадків; від 60 років і більше – 25 випадків (рис. 2).
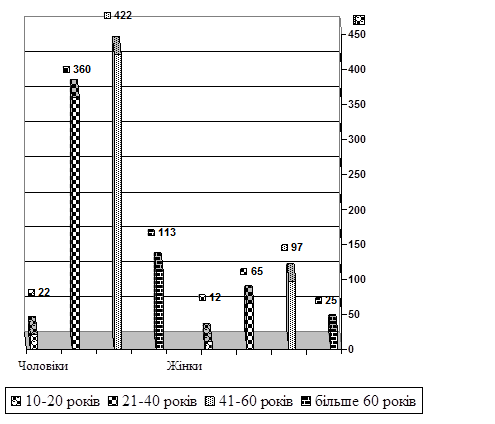
Рис. 2. Розподіл померлих мешканців Луганської області у термін 2002-2006 р.р. внаслідок ГІХС за віком та статтю
Таким чином, в структурі ненасильницької смерті серед померлих осіб м. Луганська та Луганської області значне місце належить різним формам ішемічної хвороби серця, зокрема гострій ішемічній хворобі серця. Серцево-судинні захворювання, у тому числі і ГІХС, суттєво "помолодшали". Основна маса померлих від ГІХС - це люди працездатного віку і домінуючим серед них були особи чоловічої статі, що ставить проблему захворювань системи кровообігу на перший план у вирішенні соціальних питань серед населення Луганської області.
З огляду на те, що однозначної думки відносно гістологічної оцінки уражень кардіоміоцитів при ГІХС, як ознак гострої коронарної недостатності, немає, нами й були дослідження особливостей гістологічних змін міокарда лівого шлуночка у разі раптової смерті внаслідок гострої коронарної недостатності. Так, в ділянках ішемії у разі раптової смерті внаслідок ГІХС безпосереднім об’єктом патологічних змін міокарда були кардіоміоцити (КМЦ) субендокардіального шару та ділянок ішемії і некрозу інтрамуральної локалізації. Для вказаних ділянок характерними були набряк, мікронекрози м’язових волокон. В останніх визначались гіперхромія та збільшення розмірів ядер, хвилеподібна деформація, ділянки міолізу та фрагментація м’язових волокон. Кардіоміоцити були потоншеними до 11,16±1,89 мкм, вони розділялись на повздовжні пучки міофібрил зі слабо виразною сарколемою, між якими знаходились брилки порушених м’язових волокон, що створювало передумови для фуксинофільної дегенерації та вакуольної дистрофії КМЦ. В м¢язових клітинах визначались ділянки атрофії міофібрил з брилками ліпофусцину у цитоплазмі.Також для карідоміоцитів вказаних ділянок лівого шлуночка виразною ознакою патологічних змін була втрата ними поперекової смугасті, яка добре виявлялась при імпрегнації гістологічних зрізів нітратом срібла. Для ділянок ішемії та некрозу міокарда характерним було нерівномірне його кровонаповнення. У переважній більшості досліджуваних випадків це явище спостерігалось на передній стінці лівого шлуночка, частіше субендокардіально. Такі особливості кровопостачання були зумовленістаном спазму артерій та дистонічно кровонаповнених вен. Так, при мікроскопічному вивченні виявлялись крупні артерії та їх гілки зі звивистістю та зменшенням просвіту внаслідок спазму та облітерації, зумовленої наявністю склеротичних змін та тромбоутворення. Зменшення ширини просвіту, спазм і плазматичне просякання стінки були визначені серед артеріол, прекапілярних артеріол міокарда. В ділянці ішемії міокарда мало місце достовірне зменшення до 0,06±0,002% питомої щільності артерій і збільшення до 0,17±0,06% питомої щільності вен; повнокров’я та стаз еритроцитів в артеріолах і гемокапілярах, спазм та плазматичне просякання їх стінок. Одним із проявів патологічних змін в ділянках ішемії і некрозу міокарда було збільшення у 2 рази числа гемокапілярів, ширина простору яких не перевершувала 2,0 мкм. Враховуючи відсутність у них еритроцитів та наявніть тільки компонентів плазми – вони були віднесені до плазматичних. Плазматичні ГК у полях зору відрізнялись підвищеною звивистістю, та довжиною, яка сягала 200,0-230,0 мкм й була зумовлена зменшеним числом поперечних міжкапілярних сполучень, що надавало капілярній сітці розріджений вигляд, що є проявом розвитку ішемії міокарда та створює передумови до його некротичних змін.
При дослідженні поверхні ендокарда шлуночків серця за допомогою скануючого електронного мікроскопа, було встановлено, що їх ендокардіальна поверхня представлена хвилястими складками у вигляді валикоподібних підвищень і заглиблень між ними, що в цілому, забезпечує “шорсткість” рел’єфу, призначеного для створення турбулентності кровотоку в порожнинах серця. У випадках смерті внаслідок ГКН, характерними були вогнищеві зміни рел’єфу ендокарда лівого шлуночка з ознаками погрубішання, фрагментарності та збільшення товщини складок, втрати ними хвилястості й придбанням лінійності напрямку. При вивченні поверхні ендокарда лівого шлуночка на імпрегнованих 0,25% нітратом срібла гістологічних зрізах було встановлено, що у разі раптової смерті внаслідок ГКН ендотеліальні клітини відрізнялися поліморфністю і ступінь зв’язності їх із сусідніми клітинами змінювався і коливався в діапазоні 4-8, тоді як в нормі він становив 6. Встановлено, що у випадках смерті внаслідок ГКН у сполучній тканині ендокарда лівого шлуночка вогнищево мали місце виразні патологічні зміни, проявами яких були погрубішання, втрата фібрілярності, фрагментарність.Їм відповідали вогнищеві контрактурні зміни каріоміоцитів, локалізованих в субендокардіальному шарі міокарда лівого шлуночка. Наведеними морфологічними змінами шарів міокарда і можна пояснити вогнищеві зміни рел’єфу ендокарда лівого шлуночка з погрубішанням, фрагментарністю та збільшенням товщини складок, значною втратою ними хвилястості і придбанням лінійності напрямку у разі смерті внаслідок ГКН.
З метою отримання більш повного обсягу інформації про особливості патологічних змін ендокарду лівого шлуночка у разі раптової смерті внаслідок ГКН були вивчені кровоносні судини субендокарділаьного шару. Був використаний метод ін’єкції метилметакрилату через коронарні артерії з наступною його полімеризацією і дослідженням у скануючому електронному мікроскопі. Встановлено, що в субендокардіальному просторі шлуночків мають місце зліпки судин у вигляді приплющених прямокутників із закругленими краями, орієнтовані за повздовжньою віссю. Глибина їх розповсюдження від ендотеліального шару до компактного міокарду складала 300,0-500,0 мкм. Рел’єф цих судин був рівний, з вдавленнями від ядер ендотеліальних клітин. Форма і розміри судин дозволили вважати їх капіляроподібними синусоїдами. Вони розташовувались в декілька ярусів. Між судинами кожного ярусу визначались з’єднання короткими капіляроподібними синусоїдами. Особливістю капіляроподібних синусоїдів лівого шлуночку було те, що вони мали числені, безпосередні сполучення з судинами мікроциркуляторного русла компактного міокарда, переважно з гемокапілярами та венулами. У разі смерті внаслідок ГКН капіляроподібні синусоїди субендокардіального простору, що локалізувались вогнищево, відрізнялись меншою довжиною, фрагментарністю, порідшенням сітки за рахунок зменшення числа поперечних сполучень, наявністю мікродеформацій, сплощень стінки. Окрім цього, у разі смерті внаслідок ГКН, у субендокардіальному просторі лівого шлуночка поряд з капіляроподібними синусоїдами виявлялись спазмовані гемокапіляри, ширина простору яких не перевищувала 2 мкм, а також значно розширені судини венозного сплетіння.
З метою дослідження особливостей змін мітохондріального апарату міокарда шлуночків у разі раптової смерті внаслідок гострої коронарної недостатності було проведене експериментальне дослідження на 12 білих, безпородних щурах. Ультраструктурне дослідження змін мітохондріального апарату міокарда шлуночків у разі раптової смерті внаслідок гострої коронарної недостатності визначило, що в різних зонах міокарда шлуночків щурів у саркоплазмі скорочувальних кардіоміоцитів закономірно спостерігався значний гетерогенітет мітохондрій, що відрізнялися щільністю та кількістю крист, ступенем їх орієнтації. Кількісна оцінка співвідношення між трьома типами мітохондрій показала, що найбільша частка високоенергетичних мітохондрій була характерною для інтрамуральних зон лівого и правого шлуночків, сягаючи 73% і 71% відповідно. При моделюванні гострої коронарної недостатності в міокарді шлуночків серця щурів спостерігалися різноманітні патологічні зміни, які залежали від розташування ділянок міокарда відносно зон ішемічного ушкодження, а також виявлялися неоднаково в різних досліджуваних локалізаціях стінки шлуночків. Зокрема, у ділянках шлуночкового міокарда, що були наближеними до зон ішемічного ушкодження, загальна гістологічна будова в цілому зберігалася, апоптотичні зміни спостерігалися рідко, проте на ультраструктурному рівні виявлялися численні патологічні зміни мітохондріального апарата. Кількісне дослідження показало, що у субендокардіальній зоні міокарда лівого шлуночка найбільшою мірою зменшувались щільність і кількість мітохондріальних крист (-74,1% і -71,4% відповідно; р<0,05). Також різко зменшувались середній об’єм мітохондрій, площа поверхні зовнішньої і внутрішньої мембран. У ділянках міокарда в зоні ішемії були наявні групи апоптотично загиблих кардіоміоцитів з характерними ознаками деструкції ядер і більшості органел, причому ушкодження мітохондрій мали найбільш значний ступінь. У цитоплазмі серцевих міоцитів, що знаходилися на початкових етапах апоптотичної загибелі, були виявлені групи мітохондрій з ознаками фрагментації зовнішньої і внутрішньої мембран, деструкції мітохондріальних крист, вакуолізації матрикса. Виявлялися поодинокі органели з конденсованими мембранними фрагментами, що свідчить про різке зниження рівня енергетичного метаболізму скорочувальних кардіоміоцитів за рахунок тотальної деструкції мітохондрій, серед яких найбільш уразливими були високоенергетичні мітохондрії.
З метою визначення лабораторно-діагностичних паралелей отриманих порушень тканинних компонентів, кровоносної системи шлуночків серця при смерті внаслідок ГІХС, нами було проведені дослідження біофізичних змін вказаних об¢єктів. Мікроспектрофотометрія, проведена нами з метою пошуку непрямих доказів змін компонентів стінки лівого шлуночка, отриманих при вивченні кровоносного та лімфатичного русла серця в зв¢язку з порушенням обміну речовин при раптовій смерті від ГІХС. Було проведене порівняльне кількісне вивчення вмісту нуклеїнових кислот в кардіоміоцитах в нормі та при ГІХС. Аналіз мікроспектрохімічного дослідження змін вмісту нуклеїнових кислот показав, що їх вміст у складі кардіоміоцитів лівого шлуночка при раптовій смерті внаслідок гострої ішемічної хвороби серця та у осіб контрольної групи відрізняється. Так, показники світлооптичної щільності ядер та цитоплазми КМЦ ЛШ при смерті внаслідок ГІХС достовірно перевершували такі ж показники контрольної групи, сягаючи 106, 87 ± 4,32 у.о та 71,83 ± 3,83 у.о. відповідно. Ці особливості можуть бути зумовлені зближенням анізотропних дисків та скороченням ізотропних білків, утворенням анізотропних конгломератів внаслідок фрагментації міофібріл у порушених КМЦ.
Для встановлення можливостіпосмертного виявлення патологічних змін в міокарді у випадках раптової смерті внаслідок ГІХС було проведене вивчення маркеру некрозу – серцевого тропоніна І (сТn І) в крові. Результати тестування порівнювались із результатами гістологічного дослідження серця померлих раптово. Було встановлено, що у 10 із 11 випадків позитивні результати на визначення сТn І повністю співпадали з виявленими гістологічними порушеннями міокарда у разі раптової смерті внаслідок ГІХС, а саме – з дистрофічними змінам кардіоміоцитів та появою білка у крові осіб, що померли раптово. Таким чином, за зміною серцевого тропоніна І, встановлена можливість посмертного виявлення патологічного процесу в міокарді у випадках раптової смерті внаслідок ГІХС. Тест для визначення сТn І у цільній крові є швидким імунохроматографічним експрес-аналізом для диференційної діагностики раптової смерті внаслідок ГІХС, ІМ. Однак, оскільки кількісний вміст сТn І чи ступінь його підвищення в крові тест не визначає, він не може бути єдиним критерієм ГІХС, а застосуватися в сукупності з іншими лабораторними (перш за все – гістологічним) методами дослідження.
Аналіз лазерно-поляриметричного дослідження виявив, що статистична структура розподілів інтенсивності поляризаційно контрастованих (00 – 900 ) поляризаційних зображень двопроменезаломлюючої архітектоніки (міозинові фібрили) гістологічних зрізів тканини міокарда суттєво відрізняється для її різних станів. Зокрема, середнє значення і дисперсія розподілів інтенсивності зображень гістологічних зрізів тканини міокарда при раптовій смерті внаслідок гострої ішемічної хвороби серця на 53% були меншими від значень аналогічних статистичних моментів розподілів інтенсивності зображень контрольної групи тканин міокарда. Асиметрія та ексцес розподілів інтенсивності в зображенні гістологічних зрізів тканини міокарда у разі смерті внаслідок гострої ішемічної хвороби серця були у 3-3,5 рази більшими від значень аналогічних статистичних моментів розподілів інтенсивності зображень контрольної групи тканин міокарда. Одержані результати можна пов’язати з тим, що вплив патологічних (ішемічних, некротичних) змін виявлявся у розслабленні та дистрофічних змінах тканини міокарда. Такі процеси призводять до загального зменшення двопроменезаломлення міозинових фібрил. В результаті чого знижується загальний рівень просвітлення і поява вогнищ затемнення у зображеннях міокарда шлуночків, які були одержані для перехрещених поляризатора і аналізатора, що може бути одним із критеріїв верифікації раптової смерті внаслідок гострої ішемічної хвороби серця.
ВИСНОВКИ
1. Вивчення показників смертності населення м. Луганська і Луганської області за останні 5 років (2002 – 2006 р.р.) засвідчило, що в структурі ненасильницької смерті від 72,25% до 79,98% складали випадки смерті внаслідок ішемічної хвороби серця: хронічної (76,35% і 71,92%) та гострої ішемічної хвороби серця (7,2% та 9,55%). Основну масу (77,7%) померлих внаслідок гострої ішемічної хвороби серця складали особи чоловічої статі молодого та зрілого віку.
2. У випадках раптової смерті внаслідок гострої ішемічної хвороби серця найчастішою локалізацією ішемії міокарда лівого шлуночка були субендокардіальні та інтрамуральні ділянки його стінки, в яких визначалось достовірне зменшення до 11,16±1,89 мкм товщини кардіоміоцитів, їх хвилеподібна деформація, фрагментація, втрата ними поперечної смугастості, гіперхромія та збільшення розмірів ядер, зменшення ядерно-цитоплазматичного індекса. В ділянці ішемії міокарда мало місце достовірне зменшення до 0,06±0,002% питомої щільності артерій і збільшення до 0,17±0,06% питомої щільності вен; повнокров’я та стаз еритроцитів в артеріолах і гемокапілярах, спазм та плазматичне просякання їх стінок; збільшення у 2 рази числа плазматичних гемокапілярів, що є проявом розвитку ішемії міокарда та створює передумови до його некротичних змін.
3. За допомогою скануючої електронної мікроскопії нативних препаратів міокарда було виявлено, що у разі смерті внаслідок гострої ішемічної хвороби серця у лівому шлуночку мали місце: ділянкове потовщення, фрагментарність та збільшення
8-09-2015, 19:29
