ЛУГАНСЬКИЙ ДЕРЖАВНИЙ МЕДИЧНИЙУНІВЕРСИТЕТ
АНДРОСОВА Марина Євгеніївна
УДК: 577.12:576.36:591.112.2-008.64
РОЛЬ ОПІОЇДІВ У РЕГУЛЯЦІЇ МЕХАНІЗМІВ АПОПТОЗУ ПРИ ГОСТРІЙ СЕРЦЕВІЙ НЕДОСТАТНОСТІ В ЕКСПЕРИМЕНТІ
14.01.32 – медична біохімія
АВТОРЕФЕРАТ
дисертації на здобуття наукового ступеня
кандидата медичних наук
Луганськ – 2008
Дисертацією є рукопис
Робота виконана в Луганському державному медичному університеті
Міністерства охорони здоров’я України
Науковий керівник доктор медичних наук, професор
Комаревцева Ірина Олександрівна,
Луганський державний медичний університет
МОЗ України,
завідуюча кафедри медичної хімії.
Офіційні опоненти:
доктор медичних наук, професор
Кульчицький Олег Костянтинович,
Інститут геронтології АМН України,
завідувач лабораторії регуляції метаболізму
доктор медичних наук, професор
Савченкова Лариса Василівна,
Луганський державний медичний університет
МОЗ України,
завідуюча кафедри клінічної фармакології та фармакотерапії
Захист відбудеться “12” червня 2008 року о 1200 годині на засіданні спеціалізованої вченої ради Д 29.600.03 в Луганському державному медичному університеті за адресою: 91045, м. Луганськ, кв. 50-річчя Оборони Луганська, 1 Г.
З дисертацією можна ознайомитись у бібліотеці Луганського державного медичного університету (м. Луганськ, кв. 50-річчя Оборони Луганська, 1Г).
Автореферат розісланий “10 ” травня 2008 року.
Вчений секретар
спеціалізованої вченої ради
І.А. Вишницька
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Серцева недостатність (СН) є найбільш частим і серйозним ускладненням багатьох захворювань серцево-судинної системи [GrahamI., etal., 2007]. У структурі кардіоваскулярної смертності майже 50 % випадків пов’язано з прогресуючою дисфункцією міокарда [ZegersE.S., VerheugtF.W., 2007]. За даними Фремінгемського дослідження, дотепер СН продовжує залишатися потенційно летальною стадією ішемічної хвороби серця, артеріальної гіпертензії, міокардитів, кардіоміопатій, вад та інших захворювань серця. СН характеризується не тільки широким поширенням, але й високим рівнем інвалідізації й смертності хворих. Прогноз хворих залишається невтішним. Так, середня 5-річна смертність в усій популяції хворих з хронічною серцевою недостатністю (ХСН) залишається неприпустимо високою й складає 70 % для чоловіків і 63 % для жінок [Remme W.J., et al., 2007]. Серед хворих з важкими стадіями СН смертність коливається в межах 35–50 % протягом 1-го року, складає 50–70 % через 2 роки й перевищує 70 % через 3 роки після встановлення діагнозу [SwedbergK., et al., 2005].
Широке застосування на теперішній час антрациклінових антибіотиків у складі схем поліхіміотерапії дозволило суттєво підвищити ефективність лікування з досягненням повної ремісії або регресії пухлин у дорослих у 40–70 %, а в дітей в 70–98 % випадків [Калінкіна Н.В., 2000]. У той же час, окрім позитивного терапевтичного ефекту антрацикліни через низьку вибірність дії викликають ряд порушень з боку здорових органів і систем: пригнічення кровотворення, ураження шлунково-кишкового тракту, легень, але найбільше ураження припадає на серце [Фисенко Л.Н. и др., 2004; Lipshultz S.E., et al.,2004]. Інколи кардіальні ускладнення настільки серйозні, що терапія цими цитостатиками стає неможливою й зупиняється до досягнення чіткого протипухлинного ефекту.
За даними різних авторів, частота кардіальних ускладнень при лікуванні антрациклінами коливається від 1,5 до 71 % [Doyle J., еt al., 2005; Peng X., еt al., 2005] і чітко корелює з їх кумулятивною дозою [Minotti G., еt al., 2004]. Особливе значення має той факт, що антрациклінові ураження серця довгий час можуть не проявлятися клінічно. Однак, незважаючи на це, патологічний процес прогресує й призводить до необоротних змін міокарда й в результаті до застійної СН.
Ендогенна опіоїдна система бере активну участь у формуванні відповідних реакцій організму на зміну умов існування й внутрішнього середовища [Маслов Л.Н., Лишманов Ю.Б., 2002]. Результати різноманітних досліджень при ішемії-реперфузії, імобілізаційному стресі й аритмогенних впливах указують на позитивний ефект активування периферичних опіатних рецепторів (ОР) застосуванням їх синтетичних агоністів [Лишманов Ю.Б., 1994; Маслов Л.Н., Лишманов Ю.Б., 2002]. Однак ще залишається недослідженим ефект активації цих рецепторів на тлі окисного стресу.
Таким чином, ураховуючи труднощі прогнозування кардіотоксичності антрациклінів за клінічними ознаками, імовірність її проявлення після довгого періоду часу після закінчення хіміотерапії й особливо тяжке протікання в разі розвитку застійної СН, можна вважати, що ця проблема являє собою первинний клінічний інтерес, а вивчення патогенетичних механізмів кардіотоксичної дії цих препаратів і розробка критеріїв ранньої діагностики дозволять теоретично обґрунтувати методи корекції пошкоджень серця на ранніх етапах і, таким чином, попередити розвиток тяжких пізніх кардіальних ускладнень.
Мета дослідження. Встановити роль біохімічних регуляторних систем серця – опіатних рецепторів, обміну оксиду азоту, К+ АТФ –каналів, сфінгозинового шляху в розвитку апоптозу й в перерозподілі тканинної води при гострій серцевій недостатності в експерименті.
Завдання дослідження:
1. Вивчити ступінь розвитку апоптотичних процесів біохімічно за ДНК-фрагментацією в порівнянні з морфологічною детекцією при використанні ядерного барвника Хехст у тканині міокарда при антрацикліновій моделі гострої серцевої недостатності (ГСН) і за умов активації ОР.
2. Визначити особливості оксид азоту–залежного механізму активації апоптозу в тканині міокарда за рівнем стабільних метаболітів оксиду азоту – нітрит- і нітрат-аніонів та вплив активації периферичних ОР на їх вміст.
3. Встановити роль ОР у регуляції К+ АТФ –каналів плазматичної й мітохондріальної мембран кардіоміоцитів за умов стимульованого апоптозу.
4. Дати характеристику реактивності прооксидантно-антиоксидантної системи міокарда за умов активації периферичних ОР при стимуляції клітинної загибелі.
5. Вивчити стан сфінгомієлінового метаболічного шляху в кардіоміоцитах при стимуляції апоптозу й на тлі активації периферичних ОР.
6. На основі даних ядерно-магнітно-резонансної (ЯМР) релаксометрії вивчити релаксаційні механізми апоптозу при розвитку експериментальної ГСН і при активації ОР.
Об’єкт дослідження – стан апоптотичного процесу в міокарді на моделі ГСН.
Предмет дослідження – реакції різноманітних шляхів регуляції апоптозу міокарда – ОР, К+ АТФ –каналів, оксиду азоту (NO), вільного сфінгозину (СФЗ).
Наукова новизна отриманих результатів. На антрацикліновій моделі ГСН встановлено внесок вивчених шляхів регуляції в розвиток апоптотичних процесів у міокарді, що дозволить поглибити знання про програмовану клітинну загибель на молекулярному рівні й встановити її роль у патогенезі СН.
Вперше виявлено, що активація ОР у міокарді за умов розвитку антрациклінової ГСН викликає антиапоптотичний ефект.
Встановлено, що блокування К+ АТФ -каналів міокарда негативно впливало на показники фрагментованої ДНК (ф-ДНК) міокарда, що в свою чергу попереджалося попередньою активацією периферичних ОР.
Розуміння ролі NO в регуляції апоптозу при цій моделі ГСН розкрило можливі шляхи його фармакологічної корекції блокаторами ендогенного NO в клінічній практиці.
Комплексне вивчення ЯМР-релаксаційних показників біологічних рідин у взаємозв’язку з рівнем апоптозу в кардіоміоцитах дозволило з’ясувати механізми порушення водного балансу організму в цілому при СН.
Отримані ЯМР-показники дали патогенетичне обґрунтування їх системному ефекту при ГСН, підвищуючи діагностичну значимість цього методу експрес-діагностики серцево-судинної патології.
Результати дослідження дозволили розвити наукові уявлення про низку біохімічних сигнальних шляхів апоптозу при серцево-судинній патології й сприятимуть розробкам терапевтичних підходів у клінічній кардіології.
Практична значимість роботи. Визначені закономірності реактивності механізмів, які модулюють апоптоз при стимуляції опіоїдної регуляції біохімічних функцій, мають суттєве значення для можливого попередження розвитку патологічних проявів у віддалений період після формування ГСН.
ЯМР-параметри тканин можуть бути використані при оцінці біохімічних змін, що протікають у міокарді при введенні препаратів з різною про- й антиапоптотичною спрямованістю.
Факт тривалої активності антиоксидантної системи й відсотка ф-ДНК у відповідь на попередню активацію ОР до формування ГСН дещо пояснює патогенез і патоморфоз останньої, що розвинулася після застосування антрациклінових антибіотиків. Результати роботи використовуються в учбовому процесі, при роботі аспірантів і наукових співробітників за методами біохімічного аналізу патологічних процесів у тканинах і клітинних культурах.
Одержані результати сприятимуть удосконаленню біохімічної корекції розладів, що формуються на тлі окисного стресу, не лише в лабораторних умовах, але й при подальших розробках і патогенетичній терапії в клініці.
Особистий внесок здобувача. Автором здійснено аналіз попередніх наукових літературних даних, обґрунтована актуальність і необхідність дослідження, його мета й завдання, сформовано групи спостереження. Особисто розроблено програму дослідження, обґрунтовано й відібрано методи дослідження, розроблено протокол для фіксації результатів і структуру бази даних. Самостійно проведені біохімічні дослідження процесів стимуляції клітинної загибелі й регуляторного впливу активації ОР у сформованих групах тварин. Здобувач безпосередньо приймала участь у проведенні імунофлуоресцентного й гістологічного аналізів. Заповнена база даних, проведений статистичний аналіз та інтерпретація отриманих результатів. Особисто виконано інформаційний пошук, написання всіх розділів, створення ілюстрацій та формування висновків.
Апробація результатів дисертації. Матеріали дисертації були повідомлені й апробовані на I-й регіональній науково-практичній конференції молодих вчених і студентів “Перспективи розвитку фармацевтичної науки та практики в Україні” (м. Луганськ, 2005 р.); Всеукраїнській науково-практичній конференції студентів, інтернів і молодих вчених “Проблеми захисту інтелектуальної власності в медицині та біології” (м. Луганськ, 2005 р.); II-й регіональній науково-практичній конференції молодих учених і студентів “Перспективи розвитку фармацевтичної науки та практики в Україні” (м. Луганськ, 2006 р.); 60-й ювілейній науково-практичній конференції студентів і молодих вчених “Актуальні проблеми сучасної медицини”, (м. Київ, 2006 р.); IX-му Українському біохімічному з’їзді (м. Харків, 2006 р.); міжкафедральних засіданнях працівників кафедри медичної хімії й науково-дослідницького центру Луганського державного медичного університету.
Публікації. За результатами дисертаційної роботи опубліковано 14 наукових праць. Серед них: 6 статей у фахових виданнях (2 – без співавторів), 3 патенти на корисну модель, 5 тез доповідей у матеріалах п’ятьох наукових конференцій.
Структура й обсяг дисертації. Дисертація складається з вступу, 4 розділів основної частини (огляду літератури, матеріалів і методів дослідження, розділу результатів власних досліджень, аналізу й узагальнення результатів досліджень), висновків і списку використаних літературних джерел. Робота ілюстрована 7 таблицями й 34 рисунками. Повний обсяг дисертації – 110 сторінок. Список літератури 250 джерел (87 кирилицею, 163 латиницею).
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали й методи дослідження. Експеримент було проведено на 492 білих щурах-самцях 16–18-тижневого віку, маса яких становила 250–300 грам. При постановці експерименту ми керувалися “Загальними етичними правилами експериментів на тваринах”, ухваленими I Національним конгресом з біоетики від 20 вересня 2001 року, Київ, Україна. Протокол експерименту узгоджений з комісією з біоетики Луганського державного медичного університету.
У тварин формували ГСН шляхом введення доксорубіцину гідрохлориду (ВАТ “Київмедпрепарат”, м. Київ) у дозі 20 мг/кг у вигляді 2 % водного розчину одноразово інтраперітонеально. Контрольним щурам вводили відповідний об’єм 0,9 % ізотонічного розчину натрію хлориду. Тварин спостерігали до сьомої доби експерименту включно.
Даларгін (синтетичний лей-енкефалін, D-Ala2 -Leu5 -Arg6 -енкефалін) (ЗАТ “БИОЛИК”, м. Харків) вводили інтраперітонеально в дозі 100 мкг/кг маси щурів у вигляді 0,1 % водного розчину за 20 хвилин до формування ГСН протягом усіх діб її розвитку. Ін'єкцію налоксону (антагоніст ОР) (ЗАТ “БИОЛИК”, м. Харків) у дозі 0,5 мг/кг у вигляді 0,04 % водного розчину вводили інтраперітонеально за 20 хвилин до введення даларгіну й протягом періоду спостереження, одноразово.
Неселективне інгібування АТФ-чутливих К+ АТФ -каналів викликали ін'єкцією глібенкламіду (ТОВ “Фармацевтична компанія “ЗДОРОВ’Я”, м. Харків) у дозі 0,3 мг/кг у вигляді 0,05 % водного розчину за 20 хвилин до введення даларгіну протягом усього періоду спостереження.
У кожній експериментальній групі тварин проводили морфологічну детекцію апоптозу кардіоміоцитів за допомогою флуоресцентної мікроскопії з використанням барвника Хехст 33342, який зв’язується з ДНК; імунофлуоресцентний аналіз (МТТ-аналіз) і кількісне визначення генетичних маркерів апоптозу р53, Bcl-2 в тканині міокарда; у тій же тканині методом фотометрії визначали відсоток ф-ДНК (Messmer U.K., 1996), активність супероксиддисмутази (СОД) і вміст вільного СФЗ (модифікований метод Прохорової М.І., 1982); рівень NO в тканині міокарда й сироватці крові за концентрацією NO2 - й NO3 - (Орлова Е.А., 2001); час релаксації протонів води тих же тканин за даними ЯМР-релаксометра "Mіnіspec pc 100" фірми "Bruker" (Німеччина), укомплектованого модульними програмами: EDM 110A; EDM 510A; 511A; 610A; 612A; 613A, що дозволяють змінювати послідовність імпульсів; загальну оксидантну активність (ЗОА) і загальну антиоксидантну активність (ЗАА) сироватки.
Первинний цифровий матеріал експериментальних досліджень був оброблений традиційними методами варіаційної статистики (Лапач С.Н., Чубенко А.В., Бабич П.Н., 2000). Для оцінки достовірності отриманих результатів був використаний критерій Стьюдента. Результати розцінювались як достовірні при р<0,05.
Результати дослідження та їх обговорення. Одним з найбільш характерних біохімічних критеріїв оцінки активності процесів апоптозу в тканині є показник фрагментації виділеної ДНК (Walker P.R., 1994). Проведені нами дослідження показали (Рис. 1), що найбільший рівень ф-ДНК при моделюванні ГСН (Шляхто Е.В. та ін., 2006; Giordano F.J., 2005) був на третю добу експерименту – 96,28 % (р<0,01) з подальшим зниженням значень до сьомої доби – 14,17 % (р<0,01). Попередня активація периферичних м- й д-ОР (Fryer R.M., et al, 2000; Лишманов Ю.Б. и др., 2000) призвела до достовірного зниження рівня ф-ДНК по відношенню до групи ГСН на третю, п’яту й сьому добу – падіння відсотка фрагментації склало 20,17 % (р<0,05), 19,56 % (р<0,001) і 6,97 % (р<0,05) відповідно.
Ці дані мали своє підтвердження при морфологічній оцінці зрізів сердець відповідних експериментальних груп із застосуванням гематоксилін-еозину й імунофлуоресцентного забарвлення за Хехстом.
При паралельному введенні глібенкламіду (неселективного блокатора К+ АТФ -каналів) і даларгіну спостерігалося повне усування цитопротекторного ефекту останнього. Механізм цитопротекторної дії активаторів мітохондріальних каналів повністю не вивчено, однак встановлено, що вони поперед-жають розпад АТФ. Наші дані дозволяють припустити, що активація м- й д-ОР призводить до відкриття К+ АТФ –каналів внутрішніх мембран мітохондрій, що може сприяти енергетиці клітини.
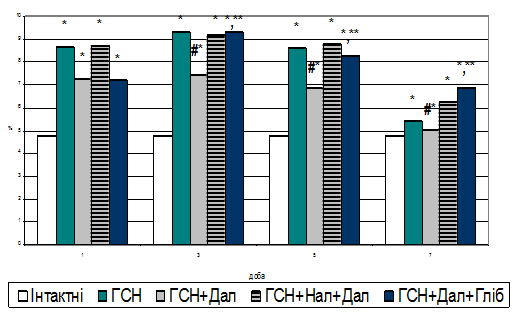
Рис. 1. Рівень фрагментації ДНК на тлі формування ГСН й при попередній активації периферичних ОР (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,01);
** - показники достовірні по відношенню до групи ГСН+Дал (р<0,05);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Завдяки механізмам своєї дії білок р53 розглядається як проапоптотичний маркер (Das D. K., et al, 2004). Вивчення експресії р53 (Рис. 2) показало її значне підсилення, починаючи з першої доби: на 5,3 %, 44,6 % (р<0,01), 57,2 % (р<0,01) і 69,3 % (р<0,01) щодо групи контролю відповідно діб спостереження. Застосування даларгіну призвело до зниження експресії на третю добу на 3,2 %, на п’яту – на 21,9 % й на сьому – на 38,7 % відносно групи ГСН.
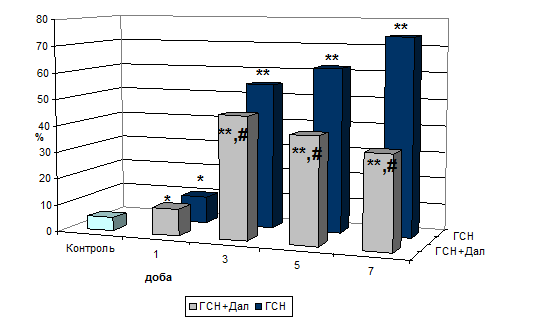
Рис. 2. Експресія р53 при активації периферичних ОР на тлі формування ГСН (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Відомо, що кардіоміоцити експресують білки Bcl-2 родини (Berry С., et al., 2000). Щодо формування окисного стресу в міокарді експресія внутрішньоклітинного антиапоптотичного маркера Всl-2 (Рис. 3) супроводжувалась її зниженням на третю добу на 13,6 % (р<0,01), на п’яту – на 29,7 % (р<0,01) і на сьому – на 18,9 % (р<0,01).
Попередня активація периферичних м- й д-ОР призвела до зниження експресія на третю добу лише на 7,5 %, на п’яту – на 11,4 % (р<0,05) і на сьому – на 12,3 % щодо групи контролю (Рис. 3).
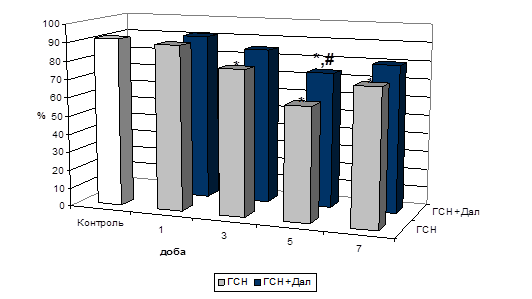
Рис. 3. Експресія Всl-2 при активації периферичних ОР на тлі формування ГСН (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Трансмембранні оксидоредуктази широко включені до контролю внутрішньоклітинного окисно-відновного стану (Berridge M.V. et al., 2000). Вивчення метаболічної активності клітин міокарда за здатністю мітохондріальних НАДН-дегідрогеназ перетворювати водорозчинний МТТ у забарвлений нерозчинний у воді формазан показало (Рис. 4), що при окисному стресі зниження їх активності склало на першу добу 20,6 % (р<0,01), на третю – 21,5 % (р<0,01), на п’яту – 17,2 % й на сьому – 8,3 % (р<0,01) відносно контрольних значень.
За умов попередньої активації периферичних ОР активність мітохондріальних дегідрогеназ була нижча за контрольні значення на першу добу на 14,6 %, на третю – на 16,4 %, на п’яту – на 10,3 % (р<0,05) і на сьому – на 4,9 % (р<0,05).
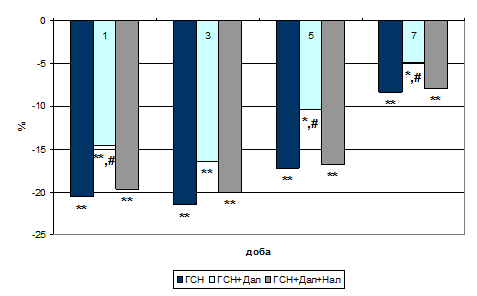
Рис. 4. Активність мітохондріальних дегідрогеназ на тлі формування ГСН й при попередній активації периферичних ОР (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
У зв’язку з тим, що NO розглядається як біфункціональна молекула, механізм дії якої залежить від умов, за яких вона синтезується (Манухина Е.Б. и др., 2002), нами було вивчено концентрацію його стабільних метаболітів. Формування ГСН в міокарді супроводжувалося підвищенням загального рівня NOх уже з першої доби: на 30,81 % (р<0,05), 49,04 % (р<0,001), 32,17 % (р<0,01) і 14,26 % відповідно діб спостереження.
Попереднє застосування даларгіну, як активатора периферичних м- й д-ОР, призвело до зниження загального вмісту NOх . Показник був підвищеним лише на 23,04 % (р<0,01), на 30,83 % (р<0,01) (зниження на 12,22 % (р<0,05) відносно групи ГСН), на 14,59 % (р<0,05) (нижче на 13,31 % (р<0,05) щодо групи ГСН) і на 2,34 % (зниження на 10,47 % (р<0,05) відносно групи ГСН) відповідно діб спостереження.
Порушення функції ендотелію при формуванні окисного стресу призвело до пригнічення механізмів синтезу фізіологічних, нетоксичних доз NO, що можна було спостерігати за зниженим відсотком NO2
-
від загальної кількості NOх
: на першу добу на 23,56 %,
8-09-2015, 23:00
