 |
 |
| А | Б |
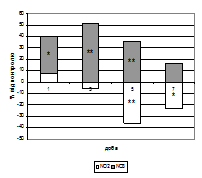
Рис. 5. Співвідношення рівнів стабільних метаболітів NO2 - й NO3 - в тканині міокарда в загальній кількості NOх при активації периферичних ОР (Б) на тлі формування ГСН (А) (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
При застосуванні даларгіну показник відсотка нітрит-аніона в загальній кількості NOх був збільшений на першу добу на 4,51 % відносно групи контролю й на 36,71 % (р<0,001) щодо групи ГСН; на третю й п’яту добу частка NO2 - залишалася зниженою відносно контрольних значень на 28,87 % (р<0,05) і 32,62% (р<0,01) відповідно (але збільшеною на 20,43 % й 50,47 % (р<0,001) відповідно щодо групи ГСН); на сьому добу спостерігалося зниження відсотка NO2 - на 16,96 % відносно групи контролю й підвищення на 36,09 % (р<0,001) щодо групи ГСН.
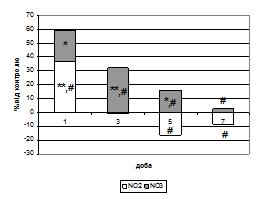
Останнім часом вважається, що при стимуляції апоптозу оксидантами в різних типах клітин активується сфінгомієлін-церамідний шлях (DyntarD., etal., 2001; SonJ.H., etal., 2007). Нами було проведене визначення рівня вільного СФЗ в тканині міокарда (Рис. 6).
Так, у щурів контрольної групи вміст вільного СФЗ дорівнював 2,08±0,31 мкг/г. Експериментальна ГСН супроводжувалася збільшенням концентрації СФЗ, яка складала: 3,05±0,19 мкг/г (p<0,05), 7,02±1,13 мкг/г (p<0,001), 7,05±1,14 мкг/г (p<0,001) і 9,77±0,94 мкг/г (p<0,001) відповідно до діб спостереження. При активації периферичних м- й д-ОР підвищення рівня СФЗ мало такі значення: 2,87±0,26 мкг/г, 4,13±0,47 мкг/г (p<0,01), 3,77±0,48 мкг/г (p<0,05) і 4,34±0,41 мкг/г (p<0,001) відповідно до діб спостереження.
Проведене дослідження кореляційного зв’язку між вмістом вільного СФЗ й рівнем ф-ДНК лише підтверджує один з механізмів розвитку ГСН при цій моделі (Suzuki E., et al., 2004; Matsunaga T., еt al., 2004).
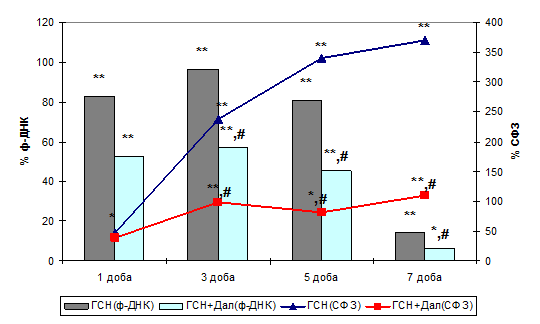
Рис. 6. Співвідношення відсотка вільного СФЗ до відсотка ф-ДНК при активації периферичних ОР на тлі формування ГСН (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Більш низький відсоток збільшення СФЗ може констатувати менш виражений рівень медіації для подальшої деструкції фосфоліпідних компонентів клітинних мембран та апоптотичної загибелі кардіоміоцитів (Рис. 6).
Характеризуючи прооксидантну й антиокисну рівновагу в тканинах ми оцінили активність СОД, як ключового ферменту антиоксидантного захисту (Molavi B. et al., 2004; Childs C. et al., 2002). Встановлено, що формування окисного стресу супроводжувалося значним підвищенням активності цього ферменту з максимальними значеннями на першу добу спостереження й подальшим поступовим зниженням до сьомої доби (Табл. 1).
Попереднє застосування агоністу ОР також викликало значне підвищення активності цього ферменту, а відмінністю було те, що до останньої доби експерименту значення залишалися доволі високими, і це, можливо, забезпечило захист клітин міокарда від проапоптотичної дії активних форм кисню.
З метою підтвердження системного характеру зазначених впливів ми провели біохімічне дослідження ЗОА й ЗАА сироватки крові. Ці показники досить виразно говорили про наявність найбільших пошкоджень у системі антиоксидантного захисту, переважно на третю й п’яту добу, коли вони мали статистично достовірну відмінність щодо контрольних величин. Також дуже чітко простежувалася динаміка змін у бік активації антиоксидантного захисту при активації периферичних ОР, що мало виражений кореляційний зв’язок з рівнем ф-ДНК.
Таблиця 1.
Показники активності СОД, ЗОА й ЗАА сироватки крові при активації периферичних ОР на тлі формування ГСН (%)
| СОД, % інгіб. | ЗОА (%) | ЗАА (%) | ||||
| ГСН | ГСН+Дал | ГСН | ГСН+Дал | ГСН | ГСН+Дал | |
| Контроль,(n=6) | 17,51±0,8 | 17,51±0,8 | 55,32±0,9 | 55,32±0,9 | 55,17±0,7 | 55,17±0,7 |
| 1 доба, (n=6) | 81,71±1,8* | 83,46±1,4* | 58,86±1,6 | 56,11±1,3 | 25,75±0,6** | 53,63±0,9# |
| 3 доба, (n=6) | 48,25±1,1* | 36,38±1,2 | 68,57±1,2* | 59,32±1,4# | 20,89±1,1** | 32,51±1,8*,# |
| 5 доба, (n=6) | 47,86±1,0* | 45,33±1,3* | 63,98±1,2* | 57,64±1,2# | 37,09±1,4** | 44,76±1,3* |
| 7 доба, (n=6) | 28,79±1,1* | 44,36±1,6*,# | 57,72±1,8 | 55,59±1,1 | 47,78±1,5* | 51,83±1,1 |
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,05);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Існує припущення, що в процесі апоптозу спостерігається порушення об’єм-регулюючих механізмів клітини (Yu S., et al., 2000; Segal M.S., et al, 2001), у тому числі й роботи Cl- - і К+ -об’єм-регулюючих каналів. Нами були досліджені ЯМР-релаксаційні показники клітинного об’єму залежно від періоду спостереження (Табл. 2).
Динаміка показників спін-спінової й спін-гратчастої релаксації до третьої доби формування окисного стресу свідчить про втрату тканиною міокарда фракції вільної води, що, за експериментальними даними, супроводжувалося дегідратацією тканин серця на першу добу й подальшою тенденцією до гідратації, починаючи з третьої доби (Рис. 7, 8).
Таблиця 2.
Розподіл показників Т1 і Т2 в тканині міокарда при активації периферичних ОР на тлі формування ГСН (мс)
| Т1 (мс) | Т2 (мс) | |||
| ГСН | ГСН+Дал | ГСН | ГСН+Дал | |
| Контроль(n=6) | 554,88±22,46 | 554,88±22,46 | 44,95±0,41 | 44,95±0,41 |
| 1 доба, (n=6) | 484,25±27,86* | 680,79±17,38**,# | 42,13±0,47** | 46,87±0,68*, # |
| 3 доба, (n=6) | 544,81±35,86 | 658,56±8,75**,# | 42,62±2,35 | 45,92±0,81 |
| 5 доба, (n=6) | 545,81±44,79 | 693,72±10,12**,# | 47,64±0,62** | 49,17±0,88**,# |
| 7 доба, (n=6) | 667,85±17,91** | 692,19±20,15** | 46,24±1,39 | 38,88±1,58**,# |
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
** - показники достовірні по відношенню до групи контролю (р<0,01);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
Отримані дані лише підтверджують етапність вивченого раніше механізму розвитку ГСН при застосуванні антрациклінових антибіотиків (утрата клітиною рідини й подальше “зморщення”), який заснований на інгібуванні синтезу нуклеїнових кислот, модифікації в транспорті сарколемального Са2+ , розвитку дисбалансу в електролітному складі (Minotti G., et al., 2004). Інтервал утрати структурованої внутрішньоклітинної води співпадав з початком максимальних проявів клітинної деградації, тому нами було виявлено, що показник фракції внутрішньоклітинної води (Ра) мав досить чіткий кореляційний зв'язок з відсотком фрагментації ДНК в тканині міокарда.
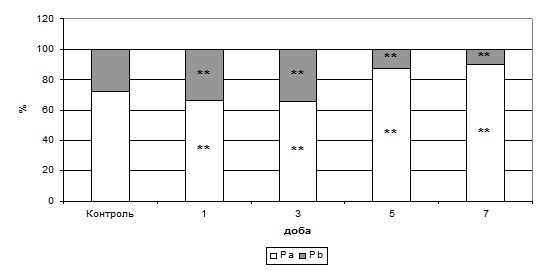
Рис. 7. Розподіл показників внутрішньо- (Ра) й позаклітинної (Рb) води в тканині міокарда при формуванні ГСН (%).
Примітки: ** - показники достовірні по відношенню до групи контролю (р<0,01).
На рис. 7 і 8 видно, що на тлі застосування даларгіну Т1-релаксація була достовірно вища за групу формування патології, а Т2 – мала тенденцію до зниження. Таке сполучення часових складових указує, що сигнал іде від кристалічної фракції води, тобто спостерігається її приріст. При цьому частка внутрішньоклітинної води на першу, третю й сьому добу мала тенденцію наближення до контрольних значень.
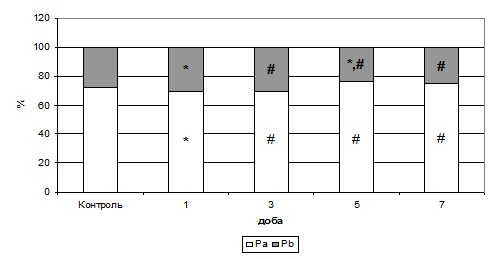
Рис. 8. Розподіл показників внутрішньо- (Pa) й позаклітинної (Pb) води в тканині міокарда при активації периферичних ОР на тлі формування ГСН (%).
Примітки: * - показники достовірні по відношенню до групи контролю (р<0,05);
# - показники достовірні по відношенню до групи ГСН (р<0,05).
У наших дослідженнях формування стану окисного стресу в міокарді супроводжувалося підвищенням експресії про- (р53) і зниженням експресії антиапоптотичних (Bcl-2) білків, що проявилося підвищенням рівня ф-ДНК кардіоміоцитів. Також спостерігався дисбаланс між захисними силами організму й пошкоджуючими факторами в бік останніх.
Дані, отримані в результаті вивчення розподілу й функцій ОР та опіоїдних пептидів, дозволяють пропонувати застосування цих препаратів з успішним результатом при ряді патологічних станів серцево-судинної системи. Встановлено, що ці ендогенні речовини можуть бути більш сильнодіючими, але викликати меншу кількість побічних ефектів, ніж звичайні фармакологічні засоби [GrossG.J., PeartJ.N., 2007].
Встановлені механізми пострецепторної дії ліганду ОР дозволяють говорити про участь у пошкодженні міокарда при гіперсекреції активних форм кисню таких посередників як NO й СФЗ. Стає зрозумілим, що гіперпродукція NO на даній моделі ГСН активувала процеси клітинної загибелі.
ВИСНОВКИ
1. Активація периферичних м- й д-опіатних рецепторів при антрацикліновій моделі стимуляції апоптозу міокарда супроводжується зниженням його проявів у кардіоміоцитах, активацією антиоксидантної системи й нормалізацією клітинного об’єму за участю системи оксиду азоту, сфінгомієлінового шляху, К+ АТФ -каналів.
2. Вивчено біохімічні ознаки активації апоптотичних процесів у серці на моделі формування гострої серцевої недостатності окисного ґенезу. Відмічено максимальне підвищення деградації ДНК (на 96,28 %) на третю добу спостереження. Встановлено, що за умов активації опіатних рецепторів морфологічні й біохімічні прояви апоптозу мали значно меншу вираженість у тканині міокарда (підвищення на 56,79 %).
3. Визначено, що початкова стадія гострої серцевої недостатності окисного генезу супроводжувалася максимальним підвищенням загального рівня оксиду азоту в тканині міокарда на третю добу (на 49,04 %). Перерозподіл стабільних метаболітів оксиду азоту в бік нітрит-аніонів при активації периферичних м- й д-опіатних рецепторів свідчить про можливу участь останніх у регуляції системи оксиду азоту.
4. Антиапоптотичний ефект синтетичного лей-енкефаліну – даларгіну – реалізується через активацію м- й д-опіатних рецепторів за участю К+ АТФ -каналів кардіоміоцитів за умов стимульованого апоптозу.
5. На тлі окисного стресу в міокарді як перша реакція спостерігається підвищення активності системи антиоксидантного захисту (у 4,6 рази) з подальшим її пригніченням. За умов активації периферичних опіатних рецепторів не спостерігалося зниження активності супероксиддисмутази протягом усього експерименту.
6. Встановлена активація сфінгомієлінового метаболічного шляху в міокарді при експериментальній гострій серцеві недостатності. Вона супроводжувалася прогресуючим підвищенням вільних сфінгоїдних основ (у 4,7 рази). Під впливом даларгіну цей показник значно знижувався (у 2,1 рази).
7. З першої по третю добу розвитку гострої серцевої недостатності в міокарді встановлені зниження часу релаксації й частки внутрішньоклітинної води кардіоміоцитів, які з третьої по сьому добу змінювались у бік гідратації клітин. При стимуляції апоптозу на цьому тлі через опіатні рецептори спостерігалося збільшення часу релаксації й зменшення внутрішньоклітинного об’єму, що обумовлено ущільненням гідратного шару тканинної води й вказує на нормалізацію клітинних процесів у міокарді.
СПИСОК ОПУБЛІКОВАНИХ РОБІТ
1. Андросова М.Е. Влияние даларгина на ЯМР-релаксацию сыворотки крови крыс при экспериментальной сердечной недостаточности // Український медичний альманах. – 2006. – Т. 9, № 2. – С. 11–12.
2. Комаревцева И.А., Андросова М.Е. Содержание фрагментированной ДНК в миокарде крыс при доксорубицин-индуцированной сердечной недостаточности и на фоне введения даларгина // Український медичний альманах. – 2006. – Т. 9, № 3. – С. 71–73.
3. Комаревцева И.А., Андросова М.Е. Уровень свободного сфингозина в миокарде при введении даларгина на фоне доксорубицин-индуцированной кардиомиопатии // Український медичний альманах. – 2006. – Т. 9, № 4. – С. 49–50.
4. Комаревцева И.А., Андросова М.Е. ЯМР-релаксация клеток миокарда крыс при стимуляции опиоидных рецепторов на модели сердечной недостаточности // Український медичний альманах. – 2006. – Т. 9, № 5. – С. 61–63.
5. Андросова М.Е. Стабильные метаболиты оксида азота при экспериментальной сердечной недостаточности на фоне активации опиатных рецепторов // Український журнал клінічної та лабораторної медицини – 2007. – Т. 2, № 1. – С. 61–65.
6. Комаревцева І.О., Андросова М.Є. Вплив активації периферичних опіатних рецепторів на вміст стабільних метаболітів оксиду азоту, вільного сфінгозину, оксидантно-антиоксидантний стан при експериментальному окисному стресі міокарда // Медична хімія. – 2007. – Т. 9, № 2. – С. 29–33.
7. Патент України на корисну модель. Спосіб підвищення толерантності кардіоміоцитів до доксорубіцин-індукованого оксидативного стресу / Комаревцева І.О., Андросова М.Є. – № 29411 від 10.01.2008, Бюл. № 1.
8. Патент України на корисну модель. Метод ранньої діагностики апоптотичних процесів у культурах клітин / Комаревцева І.О., Клімочкіна О.М., Орлова О.А., Андросова М.Є., Шипілова І.В., Бриндак Д.В. – № 25410 від 10.08.2007, Бюл. № 12.
9. Патент України на корисну модель. Спосіб визначення вмісту стабільних метаболітів оксиду азоту в культурі клітин / Комаревцева І.О., Клімочкіна О.М., Андросова М.Є., Шипілова І.В. – № 24577 від 10.07.2007, Бюл. №10.
10.Андросова М.Є., Денисенко А.С., Приходько А.С., Парінов Р.А. Апоптотична загибель кардіоміоцитів щурів під дією доксорубіцину // Перспективи розвитку фармацевтичної науки та практики в Україні: Тези I регіональної науково-практичної конференції молодих вчених і студентів. – Луганськ, 2005. – С. 41–42.
11.Androsova M.Ye., Parinov R.A., Shipilov K.V.NMR-relaxometry of serum of animals at doxorubicin induced heart insufficiency // Теоретические и практические аспекты современной медицины: Материалы 78-й научно-практической конференции студентов и молодых учених. – Симферополь, 2006. – С. 115.
12.Андросова М.Е., Паринов Р.А., Соловьева И.В. Биохимические механизмы активации опиоидных рецепторов при сердечной недостаточности у крыс // Перспективи розвитку фармацевтичної науки та практики в Україні: Тези II регіональної науково-практичної конференції молодих вчених і студентів. – Луганськ, 2006. – С. 10–11.
13.Андросова М.Е., Паринов Р.А. Влияние даларгина на сфингозиновый сигнальный путь активации апоптоза при экспериментальной сердечной недостаточности // Актуальні проблеми сучасної медицини: Тези 60 науково-практичної конференції студентів і молодих вчених Національного медичного університету імені О.О.Богомольця з міжнародною участю. – Київ, 2006. – С. 49–50.
14.Комаревцева И.А., Орлова Е.А., Андросова М.Е., Сенчий В.Н. Активация опиатных рецепторов и уровень метаболитов NO при доксорубицин-индуцированной сердечной недостаточности // IX Укр. біохімічний з”їзд: Матеріали з’їзду – Харків, 2006. – Т. 2. – С. 69.
АНОТАЦІЯ
Андросова М.Є. Роль опіоїдів у регуляції механізмів апоптозу при гострій серцевій недостатності в експерименті. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.32 – медична біохімія. – Луганський державний медичний університет, Луганськ, 2008.
Дисертація присвячена вивченню ролі біохімічних регуляторних систем – опіатних рецепторів, сфінгомієлінового шляху, оксиду азоту й К+ АТФ -каналів – у регуляції апоптозу в процесі формування гострої серцевої недостатності.
Встановлено, що стимуляція програми клітинної загибелі при експериментальній гострій серцевій недостатності супроводжується зниженням антиоксидантних властивостей організму, активацією сфінгомієлінового метаболічного шляху, підвищенням вмісту стабільних метаболітів оксиду азоту (здебільшого за рахунок нітрат-аніону), гідратацією клітин. Досліджено рівень апоптозу в міокарді при активації периферичних опіатних рецепторів за участю К+ АТФ – каналів.
У роботі вперше представлена можливість регуляції апоптотичних процесів у міокарді через периферичні м- й д-опіатні рецептори. Встановлено, що в цьому процесі також приймала участь система оксиду азоту (за рахунок конститутивних синтаз), сфінгомієліновий сигнальний шлях, що супроводжувалося більш тривалою стимуляцією антиоксидантної системи організму, приростом у міокарді фракції кристалічної води зі зниженням частки внутрішньоклітинної води. Це підтверджує можливу участь опіоїдів у позитивному впливі на підтримання нормальної життєдіяльності кардіоміоцитів.
Ключові слова: міокард, серцева недостатність, апоптоз, фрагментація ДНК, оксид азоту, сфінгозин, опіатні рецептори, ЯМР-релаксація.
АННОТАЦІЯ
Андросова М.Е. Роль опиоидов в регуляции механизмов апоптоза при острой сердечной недостаточности в эксперименте. – Рукопись.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.01.32 – медицинская биохимия. – Луганский государственный медицинский университет, Луганск, 2008.
Диссертация посвящена изучению роли биохимических регуляторных систем – опиатных рецепторов, сфингомиелинового пути, оксида азота и К+ АТФ -каналов – в регуляции апоптоза в процессе формирования острой сердечной недостаточности.
В основе работы лежит: исследование степени развития апоптотических процессов в миокарде биохимически (по фрагментации ДНК) в сопоставлении с морфологической детекцией и иммунофлуоресцентным определением экпрессии проапоптотических (p53) и антиапоптотических (Bcl-2) маркеров (с использованием ядерного красителя Хехст) при стимулировании программируемой клеточной гибели (антрациклиновая модель экспериментальной острой сердечной недостаточности); установление уровня общего оксида азота по содержанию его стабильных метаболитов – нитрит- и нитрат-анионов в ткани миокарда; рассмотрение системы сфингозина, как сигналпередающей в развитии апоптоза; определение активности митохондриальных дегидрогеназ и основного фермента антиоксидантной защиты – супероксиддисмутазы; изменения времени релаксации протонов тканевой воды по данным ЯМР-релаксометрии.
Как показало наше исследование, ДНК-фрагментация имела четкую прямую корреляцию с экспрессией проапоптотических (p53) и обратную корреляцию с экспрессией антиапоптотических (Bcl-2) маркеров. Активация периферических м- и д-опиатных рецепторов даларгином на фоне формирования острой сердечной недостаточности приводила к уменьшению уровня фрагментированной ДНК, что сопровождалось приближением показателей активности митохондриальных дегидрогеназ к контрольным значениям. Это, в свою очередь, сопровождалось угнетением окислительных процессов в миокарде и активацией антиоксидантной системы организма.
При формировании острой сердечной недостаточности было выявлено повышение содержания стабильных метаболитов оксида азота (преимущественно за счет нитрат-аниона). Предварительная активация периферических опиатных рецепторов приводила к снижению общего уровня оксида азота с увеличением доли нитрит-аниона.
Была установлена активация сфингомиелинового сигнального пути при стимуляции окислительных процессов в миокарде, что проявилось прогрессирующим достоверным повышением уровня свободного сфингозина. Корреляционный анализ показал зависимость между уровнем свободных сфингоидных оснований и степенью деградации ДНК (положительная), активностью супероксиддисмутазы (отрицательная) и содержанием стабильных метаболитов оксида азота (положительная).
В условиях стимуляции апоптоза установлено снижение времени релаксации с явлениями дегидратации тканей с первых по третьи сутки наблюдения, где интервал потери структурированной внутриклеточной воды совпадал с началом максимальных проявлений клеточной деградации (сильная положительная корреляционная связь). С третьих по седьмые сутки наблюдалось увеличение клеточного объема. При регуляции апоптоза в этих условиях через опиатные рецепторы наблюдался прирост фракции кристаллической воды. При этом доля внутриклеточной воды имела тенденцию приближения к контрольным значениям.
Установлено повышение уровня фрагментированной ДНК при блокаде К+ АТФ -каналов плазматической и митохондриальной мембран клеток миокарда под действием глибенкламида на фоне активации опиатных рецепторов. Эти данные свидетельствуют об участии К+ АТФ -каналов в регуляции апоптотических процессов в миокарде.
Таким образом, установленные эффекты активации опиатных рецепторов позволяют говорить об участии в повреждении миокарда при гиперсекреции активных форм кислорода таких посредников как оксид азота и сфингозин.
Это, в свою очередь, дает новые научные представления о биохимических процессах при патологиях и способствует продолжению исследований по разработке иных терапевтических подходов в клинической кардиологии.
Ключевые слова: миокард, сердечная недостаточность, апоптоз, фрагментация ДНК, оксид азота, сфингозин, опиатные рецепторы, ЯМР-релаксация.
SUMMARY
Androsova М.Ye. The role of opioids оn
8-09-2015, 23:00
