МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
ІМ. М. ГОРЬКОГО
УДК 616.33+616.34+616.33-002+616-092
ЗНАЧЕННЯ МІСЦЕВИХ НЕСПЕЦИФІЧНИХ ПРОТЕОЛІТИЧНИХ МЕХАНІЗМІВ У РОЗВИТКУ ВИРАЗКОВИХ УРАЖЕНЬ ШЛУНКОВО-КИШКОВОГО ТРАКТУ
14.03.04 - патологічна фізіологія
Автореферат
дисертації на здобуття наукового ступеня
кандидата медичних наук
Донецьк - 2008
Дисертацією є рукопис.
Робота виконана в Кримському державному медичному університеті ім. С. І. Георгієвського МОЗ України (м. Сімферополь)
Науковий керівник: доктор медичних наук, професор
Кубишкін Анатолій Володимирович,
Кримський державний медичний університет
ім. С. І. Георгієвського МОЗ України,
професор кафедри патологічної фізіології.
Офіційні опоненти: доктор медичних наук, професор
Казімірко Ніла Казімірівна,
Луганський державний медичний університет
МОЗ України, завідувач кафедри патологічної фізіології.
доктор медичних наук, професор
Гоженко Анатолій Іванович ,
Одеський державний медичний університет
МОЗ України, завідувач кафедри
загальної та клінічної патологічної фізіології.
Захист відбудеться “20 ” червня 2008 р. о 1000 годині на засіданні спеціалізованої вченої ради Д 11.600.02 при Донецькому національному медичному університеті ім. М. Горького МОЗ України (83003, Україна, м. Донецьк, пр. Ілліча, 16).
З дисертацією можна ознайомитися в бібліотеці Донецького національного медичного університету ім. М. Горького (83003, Україна, м. Донецьк, пр. Ілліча, 16).
Автореферат розісланий “14” травня 2008 р.
Вчений секретар
спеціалізованої вченої ради Д 11.600.02,
доктор медичних наук,
доцент М. В. ЄРМОЛАЄВА
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. ВХШ й ВХДПК залишається актуальною проблемою гастроентерології, оскільки в структурі захворюваності займає одне з перших місць і приводить до зниження працездатності й інвалідності хворих. Незважаючи на широкий арсенал сучасних діагностичних і лікарських засобів, які застосовуються для діагностики й лікування виразкової хвороби, відзначається висока частота розвитку ускладнень, що сполучаються зі схильністю до розвитку рецидивів захворювання й резистентністю до проведеної терапії (Склянська О.А., 2004) Незважаючи на загальновизнану провідну роль інфікування Helicobacter pylori в ульцерогенезі ВХШ й ВХДПК є складним багатофакторним за патогенезом гастроентерологічним захворюванням, а багато патогенетичних ланок ульцерогенезу залишаються дискутабельними й до кінця не вивченими (Аруин Л.И., 1998; Скрипник І.М., 2001; Ліпатнікова А.С., 2006).
Ключову роль в ульцерогенезі грають запальні зміни, які розвиваються в слизовій оболонці на втручання Helicobacter pylori і знижують її резистентність до впливу факторів пептичної агресії, сприяють утворенню виразки (Соловьева Г.А., 2007). У розвитку неспецифічного запалення приймають участь гуморальні і клітинні механізми, одним із ключових компонентів яких є нейтрофільні гранулоцити, що містять значну кількість лізосомальних протеїназ, які мають деструктивний потенціал (PhamC.T., 2006). Активація протеїназ визначає, у значній мірі, патогенез запального процесу, у тому числі в слизовій шлунка (BerginP.J. etal., 2004), а їхня взаємодія із інгібіторами протеїназ визначає ступінь протеолітичної агресії в плані розвитку деструктивних змін в тканинах, що вони ушкоджують (LindstedtK.A. etal., 2004). Розуміння ролі взаємодії компонентів протеїназ-інгібіторної системи служить важливою ланкою у з'ясуванні молекулярних основ патології (Веремеенко К.Н., 1994; Кубишкін А.В., 2008). Крім того, вивчення неспецифічних протеолітичних механізмів розвитку патології в системі травлення викликає інтерес у зв'язку з його насиченістю специфічними протеїназами, що беруть участь у процесах травлення.
Таким чином, складні й не до кінця вивчені механізми формування виразкових уражень системи травлення обґрунтовують необхідність удосконалювання діагностичних і лікувальних підходів на основі розкриття нових патогенетичних механізмів їхнього формування. Вивчення ролі місцевих неспецифічних протеолітичних механізмів у формуванні ульцерогенезу дозволить не тільки поліпшити якість діагностики, але й проводити адекватний прогноз і профілактику цих порушень із розробкою надалі підходів до вдосконалювання терапії.
Зв'язок роботи з науковими програмами, планами, темами. Робота виконана в рамках наукової тематики кафедри патологічної фізіології Кримського державного медичного університету ім. С. І. Георгієвського “Розробка підходів для оцінки патогенетичної ролі тканинних протеїназ й їх інгібіторів при системних і локальних патологічних процесах” (номер держ. реєстрації 0107U001255). Дисертант є співвиконавцем теми.
Мета дослідження. Установити значення місцевих неспецифічних протеолітичних механізмів у розвитку виразкових уражень травного тракту і розробити критерії діагностики й прогнозу розвитку.
Завдання дослідження:
1. Вивчити стан протеїназ-інгібіторної системи слизової оболонки шлунка й слизової оболонки кишечнику при експериментальному моделюванні виразкових ушкоджень травного тракту.
2. Зіставити стан компонентів протеїназ-інгібіторної системи й ультраструктурні зміни тканини шлунка при експериментальному моделюванні виразково-некротичних ушкоджень слизової оболонки гастродуоденальної зони.
3. Визначити характер змін активності неспецифічних протеїназ шлункового соку у хворих з захворюваннями травного тракту.
4. Дослідити стан показників місцевого антипротеїназного захисту слизової оболонки гастродуоденальної зони у хворих з патологією шлунка й дванадцятипалої кишки.
5. Виявити діагностичне й прогностичне значення змін еластазоподібної активності шлункового соку для оцінки ступеня ушкодження слизової оболонки шлунка й слизової оболонки кишечника.
Об'єкт дослідження : експериментальні тварини з моделлю виразкової хвороби й хворі різних вікових груп з патологією гастродуоденальної зони.
Предмет дослідження: значення системи місцевих неспецифічних протеолітичних й антипротеолітичних механізмів у формуванні виразково-некротичних уражень травного тракту.
Методи дослідження – біохімічні, морфологічні і статистичні.
Наукова новизна отриманих результатів. У результаті комплексного вивчення процесів протеолізу шлункового змиву, супернатанту стравохідного відділу слизової оболонки шлунка, супернатанту фундального відділу слизової оболонки шлунка, кишкового змиву й супернатанту слизової оболонки тонкої кишки і сироватки крові в експериментальних тварин, шлункового соку у хворих різних вікових груп з гастродуоденальною патологією, а також морфологічних змін у стінці шлунка й тонкого кишечнику виявлені нові патогенетичні аспекти розвитку ВХШ й ВХДПК. Уперше установлено, що дисбаланс у протеїназ-інгібіторній системі може бути одним з факторів, який приводить до формування ВХШ й ВХДПК. Уперше встановлено, що механізми ушкодження слизової оболонки шлунка й слизової оболонки дванадцятипалої кишки безпосередньо взаємозалежні з порушеннями в протеїназ-інгібіторній системі. Виявлено регіональні особливості в стані інгібіторів протеїназ у різних відділах системи травлення. Показано, що фактором, який приводить до ушкодження слизової оболонки служить пригнічення місцевих неспецифічних протеїназ потенціалу при збільшенні активності неспецифічних протеїназ, у першу чергу еластазоподібної активності. Розроблений принципово новий підхід для вдосконалення діагностики ступеня ушкодження слизової оболонки шлунка й дванадцятипалої кишки у хворих з патологією гастродуоденальної зони.
Практичне значення отриманих результатів. Отримані в ході досліджень дані розширюють уявлення про патогенез ВХШ й ВХДПК. Показано доцільність визначення показників протеїназ-інгібіторної системи при захворюваннях гастродуоденальної зони. При оцінці ступеня ушкодження слизової оболонки гастродуоденальної зони варто проводити дослідження стану протеїназ-інгібіторної системи шлункового соку. Для визначення ступеня ефективності проведеної терапії на госпітальному етапі варто враховувати динаміку показників активності місцевого неспецифічного протеїназ-інгібіторного потенціалу шлункового соку. Зниження або збереження низького рівня інгібіторів протеїназ при високій активності неспецифічних протеїназ варто вважати несприятливою ознакою, що впливає на прогноз.
Матеріали роботи використані в навчальному процесі кафедр патофізіології Кримського державного медичного університету ім. С. І. Георгієвського, Харківського національного медичного університету, Тернопільського державного медичного університету ім. І. Я. Горбачевського, Донецького національного медичного університету ім. М. Горького, Медичного інституту Сумського державного університету.
Особистий внесок здобувача. Автором було проведенио патентно-інформаційний пошук, аналіз актуальності і ступеня вивчення проблеми; визначені напрямки досліджень, сформульовано ціль і задачі роботи, проведено огляд і аналіз літератури, визначено методологічні підходи, відпрацьовано експериментальні моделі, вивчено та узагальнені результати проведених досліджень, обґрунтовано наукові висновки. Розробленоспосіб оцінки стану слизової оболонки шлунка у хворих з гастродуоденальною патологією (деклар. патент України на корисну модель № 26332 (А61У 10/00) від10.09.2007 р.
Апробація результатів. Апробовані на спільному засіданні кафедр патологічної фізіології, гістології, цитології та ембріології, нормальної фізіології, патологічної анатомії, терапії і сімейної медицини ФПО Кримського державного медичного університету ім. С. І. Георгієвського МОЗ України, протокол № 68, від 15.01.2008 р).Результати досліджень повідомлені на: науково-практичній конференції “Актуальні питання патофізіології” (Ялта, 2006 р.), Міжнародної конференції молодих вчених “Актуальні проблеми клінічної, експериментальної та профілактичної медицини” (Донецьк, 2007 р.); VI-тих читаннях В. В. Підвисоцького (Одеса, 2007 р.), засіданні товариства патофізіологів Криму (Сімферополь, січень 2008 р.).
Публікації. За матеріалами дисертації опубліковано 8 праць, із них 5 – статті в ліцензованих ВАК України журналах і збірниках, 3 з котрих – моноавторські, 2 – у матеріалах, наукових конференцій. Отримано 1 деклараційний патент України на корисну модель.
Обсяг і структура дисертації. Дисертаційна робота складається із вступу, огляду літератури, матеріалів і методів дослідження, розділу власних досліджень, аналізу та узагальнення результатів, висновків, практичних рекомендацій, списку використаних джерел. Бібліографічний перелік містить 280 найменувань, із них 167 кирилицею та 113 латиницею. Текст викладено на 112 сторінках тексту, ілюстровано 14 таблицями, 7 графіками, 9 світловими і 12 електронними мікрофотографіями, 10 рисунками.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріал і методи дослідження. Експериментальні дослідження проведені на 24 білих щурах-самцях лінії “Vistar”, масою тіла 180-200 г. Утримання тварин у віварії було однаковим, що є необхідною умовою створення структурної групи. Температура приміщення, де здійснювалися експерименти, складала 19-22 °С. Експериментальні дослідження проводилися відповідно до вимог “Європейської конвенції про захист хребетних тварин, які використовуються в дослідницьких та інших наукових цілях” (Strasburg, 18.03.1986 р.). Експерименти проводилися згідно дозволу Вченої Ради Кримського медичного інституту (протокол № 103 від 30.11.1977 р.); комісії з питань біоетики при Кримському державному медичному університеті ім. С. І. Георгієвського (протокол № 11 від 08.01.2008 р.). Гостру виразку шлунка моделювали двома способами. Перший - шляхом підшкірного введення тваринам індометацину в дозі 35 мг/кг маси тіла після 24 годин голодування. Декапитацію проводили через 4 години після введення індометацину - індометацинова виразка. Другий - імобілізацією тварин, які напередодні голодували протягом 24 годин, у тісних клітках-пеналах у положенні на животі протягом 6 годин при температурі 8 о C - стресова виразка.
Клінічні дослідження проводилися на 165 пацієнтах з різноманітною патологією гастродуоденальної зони з яких 42 дорослих пацієнта і 123 дітей. Фіброгастродуоденоскопічне дослідження верхніх відділів травного тракту проводили з використанням гнучкого ендоскопу японської фірми “Olympus”.У результаті дослідження були виявлені різноманітні зміни слизової оболонки шлунка від ознак поверхневого запалення до ерозивних форм у дітей і до виразок у дорослих. Для опису змін слизової оболонки у хворих на гастрит використали “Класифікацію і градацію гастриту. Модифіковану Сіднейську систему” (1996).
ТПА біологічного матеріалу вимірювали спектрофотометричним методом (А. В. Кринська та співавт., 1977). Вимір ЕПА біологічного матеріалу проводили за гідролізом синтетичного субстрату N – t – BOC – аланіл – p – нітрофенілового ефіру (Reanal) (О. Г. Оглоблина та співавт., 1980). Визначення АТА шлункового соку проводили за здатністю шлункового соку гальмувати гідроліз бензоіларгінін-р-нітроанілін трипсином. Для визначення КСІ у пробах попередньо осаджували кислотостабільні білки (В. Ф. Нартикова та співавт., 1969; О. Г. Оглоблина та співавт., 1980).
Морфологічні дослідження (світлову і електронну мікроскопію) шлунка і кишечнику проводили у експериментальних тварин. Діагностику Helicobacterpylori - інфекції проводили за уреазним експрес-методом, який базується на високій уреазній активності Helicobacterpylori. Біоптати, узяті з найбільш запальних ділянок слизової оболонки, поміщали в тест-розчин відразу після проведення гастроскопії. Результати оцінювали протягом першої години, наступної другої години й через 24 години за зміною забарвлення тест-розчину з жовтого на малиново-червоний, що свідчить про наявність Helicobacterpylori у досліджуваному шматочку слизової оболонки шлунка. Результати дослідження оцінювалися як “позитивні”, якщо забарвлення з'являлося протягом першої години, “слабопозитивні”, якщо зміна забарвлення наступала протягом другої години й “негативні”, якщо зміни забарвлення не наступало через 24 години.
Статистична обробка отриманих цифрових даних проведена з використанням методів варіаційної статистики з обчисленням середніх величин (M) і оцінкою ймовірності розбіжностей (m), вірогідними вважали показники при р<0,05. Статистичні розрахунки виконували з використанням електронних таблиць Exel для Microsoft Office.
Результати власних досліджень та їх обговорення. Експериментальним дослідженням місцевого неспецифічного протеїназ-інгібіторного потенціалу шлунка у інтактних тварин вперше були визначенні наступні рівні місцевих неспецифічних протеїназ та їх інгібіторів у шлунковому змиві ЕПА = 35,34 ± 6,84 нМ/мг• хв, ТПА = 28,92 ± 5,08 нМ/мг• хв, КСІ = 9,16 ± 2,26 мІО/мг; супернатанті стравохідного відділу слизової оболонки шлунка ЕПА = 30,69 ± 4,11 нМ/мг• хв, ТПА = 5,42 ± 1,28нМ/мг• хв, КСІ = 16,70 ± 5,53 мІО/мг; супернатанті фундального відділу слизової оболонки шлунка ЕПА = 99,75 ± 13,74 нМ/мг• хв, ТПА = 25,29 ± 5,19 нМ/мг• хв, КСІ = 21,01 ± 2,66 мІО/мг; змиві тонкої кишки ЕПА = 102,76±7,01 нМ/мг• хв , ТПА = 25,26±5,74 нМ/мг• хв, КСІ = 13,91±3,67 мІО/мг; супернатанті слизової оболонки тонкої кишки ЕПА = 175,45 ± 18,09 нМ/мг• хв, ТПА = 29,15 ± 8,73 нМ/мг• хв, КСІ = 27,55 ± 4,10 мІО/мг. У сироватці крові ЕПА = 1,07 ± 0,19 мМ/мл• хв, ТПА = 278,0 ± 24,16 мМ/мл• хв, КСІ = 5,91 ± 0,36 мІО/мл.
Експериментальні дослідження в сироватці крові показали збільшення ТПА на 53,7 % (р<0,001) при індометациновій виразці. При моделюванні стресової виразки спостерігалося зниження ТПА на 34,6 % (р<0,001) у порівнянні з контролем. ЕПА сироватки крові перевищила контроль на 46,6 % і на 10,9 % при індометациновій і при стресовій виразках відповідно. Рівень активності КСІ в сироватці крові при індометациновій виразці, збільшився в порівнянні з контролем на 43 % (р<0,001). При моделюванні стресової виразки КСІ наближалася до контрольних значень. Проведені дослідження шлункового змиву показали рістТПА на 109 % (р<0,001) при індометациновій виразці, при стресовій на 272,7 % (р<0,05) у порівнянні з контролем. При індометациновій виразці спостерігалося зниження ЕПА шлункового змиву на 20,1 % у порівнянні з контролем, а стресова виразка викликала її збільшення у 3 рази (р<0,05). Активність КСІ знизилася щодо контролю при індометациновій виразці на 50 % (р<0,05), а при стресовій на 33 %. РістТПА, спостерігався в супернатанті стравохідного відділу слизової оболонки шлунка, ТПА при цьому збільшилася стосовно контролю на 60,8 % при моделюванні індометацинової виразки (рис. 1). На моделі стресової виразки ТПАсупернатанту стравохідного відділу слизової оболонки шлунка перевищила контроль майже у 2,5 рази. ЕПА у супернатанті стравохідного відділу слизової оболонки шлунка перевищила контроль на 158,6 % і на 101,9 % (р<0,001)при індометациновій і при стресовій виразках відповідно. Рівень КСІ у супернатанті стравохідного відділу слизової оболонки шлунка знизився в порівнянні з контролем при індометациновій виразці на 87 % (р<0,01), при стресовій на 62 % (р<0,05).
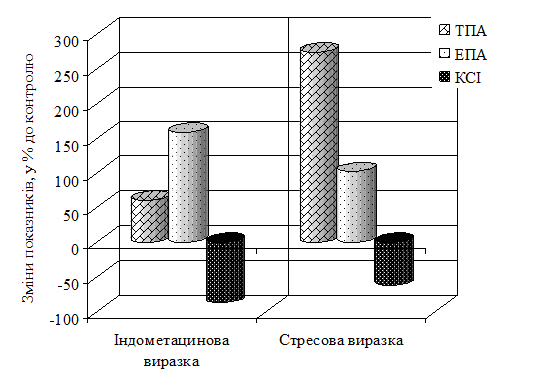
Рис. 1. Показники системи протеолізу супернатанту стравохідного відділу слизової оболонки шлунка щурів.
Дослідження в супернатантіфундального відділу слизової оболонки шлунка показало зниження ТПА на 33,8 % при індометациновій виразці, а при стресовій виразці - на 48,7 % (р<0,05) відносно контролю. Проведені дослідження показали збільшення ЕПА в порівнянні з контрольною групою на 45,6 % (р<0,05)при індометациновій виразці і на 54,1 % (р<0,001) при моделюванні стресової виразки. Активність КСІсупернатантуфундального відділу слизової оболонки шлунка при індометациновій виразці знизилася на 78 % (р<0,001)стосовно контролю, а при стресовій виразці на 32 % (р<0,05).
При індометациновій виразці у кишковому змиві відзначався ріст ТПА на 133,9 % (р<0,01) у порівнянні з контрольною групою. При стресовій виразці мало місце зниження активності ТПА кишкового змиву в порівнянні з контролем на 28,8 %. ЕПА при індометациновій виразці в кишковому змиві збільшилось на 43,2 % (р<0,01) у порівнянні з контрольною групою, а при стресовій - на 14,2 %. Відбувалося зниження рівня КСІ кишкового змиву на 60 % і на 34% при індометациновій і стресовій виразках відповідно у порівнянні з контролем. У супернатанті слизової оболонки тонкої кишки ТПА збільшилася в порівнянні з контролем на 45 % при індометациновій виразці, а при стресовій на 48,5 %. При індометациновій виразці спостерігалося збільшення ЕПА в супернатанті слизової оболонки тонкої кишки на 52,2 % (р<0,01) у порівнянні з контролем, а при стресовій на 35,4 % (р<0,01). Рівень КСІ знизився на 32 % (р<0,05) у супернатанті слизової оболонки тонкої кишки у порівнянні з контролем при стресовій виразці і на 78 % (р<0,001) при індометациновім.
При моделюванні індометацинової і стресової виразок спостерігається активація місцевих неспецифічних протеїназ - ТПА і ЕПА і зниження активності КСІ, що вказує на участь неспецифічних протеїназ й їхніх інгібіторів у механізмах деструкції слизової оболонки гастродуоденальної зони й свідчить про патогенетичну значимість їх активації при даній патології.
Описана нами динаміка змін біохімічних показників при моделюванні гострої виразки шлунка супроводжувалася специфічними змінами структури його слизової оболонки. При огляді у світловому мікроскопі у щурів, яким моделювали індометацинову і стресову виразки розвивався набряк слизової оболонки шлунку з виразками, з ознаками кровотечі і множинними ерозіями шлунка, найбільш виразними у фундальному відділі шлунка. У щурів, яким моделювали стресову виразку, морфологічні зміни носили менш виразний дистрофічний і деструктивний характер, при цьому зміни в стані протеїназ-інгібіторного балансу також були менш виразні.
Електронно-мікроскопічне дослідження виразок виявило порушення нормальної структури епітеліального шару, з хаотично розташованими клітинами однорядного залозистого призматичного епітелію, між якими виявлялися поодинокі клітини запального ряду й елементи клітин власних залоз шлунка. У ділянках з виразковими дефектами спостерігалася лейкоцитарна інфільтрація. У індометациновій виразці лейкоцити знаходились серед клітинного детриту й були оточені деструктивно некротизованими екзокриноцитами або їх відламками. При індометациновій виразці в деяких екзокриноцитах мають місце деструктивні зміни комплексу внутрішньоклітинних органел із формуванням вакуолеподібних утворень з дрібними секреторними гранулами. Змінюється також структура парієтальних екзокриноцитів. Очевидно, порушення структури й функції секреторних клітин
8-09-2015, 22:06
