При аналізі репродуктивної функції відзначено, що одну й більше вагітностей мали 44 (91,7%) хворих. Не було вагітностей у 4 (8,3%) обстежених, які представляли групу хворих з первинною безплідністю. При цьому вторинна безплідність була виявлена у 8 (16,6%) пацієнток. Наявність в анамнезі пологів встановлено у 39 (81,3%) жінок, абортів - у 33 (68,75%), серед яких у 9 (18,8%) були мимовільні аборти. Зіставлення числа пологів, медичних і мимовільних абортів до загальної кількості вагітностей показало, що найбільшу частотність мали медичні аборти - 80 (54,1%), далі пологи - 54 (36,5%) і мимовільні аборти - 14 (9,4%).
Клінічна симптоматика у хворих I групи із внутрішнім ендометріозом характеризувалася поступовим розвитком і повільним наростанням симптомів: спочатку з'являвся біль перед менструацією та під час неї, згодом біль супроводжувався нудотою, блювотою, цисталгією, дизурією та доповнювався іррадіацією в спину, пряму кишку, пах. Менструації носили характер мено- і метрорагії, що сполучалися з анемією різного ступеня виразності. Клінічний аналіз не виявив достовірних розходжень у віці, часі настання менархе, кількості пологів залежно від ступеня поширення й форми патологічного процесу.
Клінічні прояви захворювання при зовнішньому ендометріозі залежали від локалізації й розповсюдження патологічного процесу. Так, клінічний перебіг захворювання при ендометріоїдних кістах (I ст. і «малих формах» ендометріоза) супроводжувався слабковираженими болями поза менструаціями та виразним болючим синдромом під час менструацій, що викликало у хворих очевидне зниження працездатності та психоемоційні порушення, що здобували стійкий характер. При розповсюджених формах зовнішнього ендометріозу (III і IV ст.) дисменореєю страждали 68,8% тематичних хворих, біль в області таза носив постійний характер, диспареунія була майже в кожної другої хворої 43,4%. У деяких випадках при розповсюджених формах зовнішнього ендометріозу тазові болі постійного характеру підсилювалися й здобували симптоматику “гострого живота” з іррадіацією в пряму кишку й крижі, що, можливо, було зумовлено мікроперфорацією ендометріоїдних кіст. Такий стан відзначався в 33,3% хворих, що страждали зовнішнім ендометріозом. В окремих випадках 18,8% відзначалися слабковиражені симптоми подразнення очеревини, озноби, нудота.
У результаті дослідження ендокринного профілю були уточнені ендокринні порушення у хворих на генітальний ендометріоз і мастопатію до процесу лікування: відносна гіперестрогенемія сполучалася з гіперкортизолемією і функціональною гіперпролактинемією, в 27,1% хворих було порушене співвідношення ЛГ/ФСГ, що призводило до зміни стероїдогенеза та ановуляції або НЛФ.
Характерні зміни ендокринної системи у хворих з генітальним ендометріозом також полягали в зміні функції щитоподібної залози (зниження продукції як Т3 , так і Т4 і зміні рівня ТСГ у в лютеїновій фазі менструального циклу). Слід зазначити, що у 18 (37,5%) тематичних хворих цієї групи ендокринологом були виявлені клінічні ознаки гіпотиріоза або ХАТ, що в наслідку визначало спільну тактику лікувальних заходів.
Після контролю показників гормонального профілю у хворих внутрішнім ендометріозом, що приймали гестагени 3 і 6 місяців, відзначалася виражена тенденція до нормалізації гормональних показників у 33 (68,8%) випадках. У 15 (31,3%) випадках тенденція нормалізації показників ендокринного профілю була статистично достовірною (р<0,05).
Контроль показників гормонального профілю у хворих із внутрішнім ендометріозом, що приймали даназол, виявив тенденцію до нормалізації ендокринних показників у 39 (81,3%) хворих. У 9 (18,8%) хворих нормалізація показників ендокринного гомеостазу була статистично недостовірною(р<0,05). Оскільки клінічний ефект антигормонів зумовлений придушенням секреції ЛГ і ФСГ, внаслідок чого гальмується секреція стероїдних гормонів яєчниками, то з'ясовані особливості зниження цих гормонів до базального рівня були зафіксовані у хворих даної групи. У 23 (47,9%) хворих було підвищення Т=5,64±0,18 нмоль/л, що було статистично достовірним у фолікуліновій фазі, це пояснювалося властивістю даназола витісняти Т із з'єднаних глобулінових комплексів і призводило до підвищення рівня вільного Т в крові, наслідком чого у 18 (37,5%) хворих клінічно спостерігався андрогенний ефект.
Своєрідністю психопатологічної симптоматики при генітальному ендометріозі було тісне переплетіння та взаємовплив невротичних і неврозоподібних розладів з вираженою вегетативною стигматизацією частіше вагоінсулярної спрямованості судинних реакцій, що збігалося з думкою ряду авторів (В.П. Баскаков, Ю.В. Цвелев 2002). Психопатологічні прояви у хворих були безпосередньо взаємозалежні з порушеннями ендокринно-обмінних процесів і вегетативних реакцій, зумовлених наявністю ендометріоїдних гетеротопій.
Вивчаючи преморбідні фактори ризику виникнення мастопатії, ми змогли виділити причинно-наслідкові зв'язки 9 симптомокомплексів у психологічному стані хворих ендометріозом, які безпосередньо можуть являти собою основні фактори ризику виникнення нейроендокринних і психогенних змін, це – ригідність поведінки й мислення, низький рівень соціальної саморефлексії, нераціональні способи самозахисту, збереження особистісного самобалансу за рахунок порушення вегетативного, агресивне занепокоєння, «втеча» в роботу, пошук «цапів-відбивайлів», фіксація на задоволенні потреб, «занурення» у хворобу та соціальна дезадаптація.
У наших дослідженнях було визначено, що ситуативні диспозиції, пов'язані зі ставленням до хвороби, корелюють із самопочуттям пацієнток: серед песимістів у кілька разів більше хворих із поганим і дуже поганим самопочуттям, ніж серед «борців» і оптимістів. Очевидно, що високий рівень вольового ресурсу пацієнтки сприяє її видужанню, поліпшенню стану, і, навпаки, низький рівень вольового ресурсу заважає боротися із хворобою, а можливо, і знижує імунний стан хворої. Можна припустити, що існує «поріг терпимості» страждань, за яким наступає параліч волі. Предметом аналізу, на підставі якого можливий прогноз якості медико-соціальної реабілітації, виступає процес соціальної адаптації в умовах складного економічного становища та психоемоційного дисонансу.
У результаті вивчення психоемоційного стану, можна припустити, що однією із причин виникнення мастопатії й генітального ендометріозу можуть виступати не тільки ендокринні порушення, але й соціально-екологічна депривація різної етіології, обумовлена впливом навколишнього оточення. Однак, власне суб'єктивне ставлення до навколишнього середовища, а також механізми впливу й взаємодії соціально психологічних параметрів у хворих з різним ступенем поширення ендометріоїдних гетеротопій у стадії захворювання призводять до різної «внутрішньої картини хвороби» і розумінню суб'єктивних відчуттів об'єктивного стану хвороби.
Наведені дані дозволяють констатувати, що як при будь-якій формі мастопатії, так і при генітальному ендометріозі мають місце порушення психоемоційного стану й зміни «внутрішньої картини хвороби», що істотно ускладнювали лікувально-реабілітаційну програму. Це послужило підставою для включення в лікувальну тактику хворих генітальним ендометріозом комплексу заходів із використанням медикаментозних засобів не тільки гормонального профілю, але й психотропних препаратів («малих» антидепресантів, «модуляторів» настрою) у сполученні з фізіотерапевтичним впливом і застосуванням психо-сугестивних методик, що дозволило досягти більш високих рівнів медичної реабілітації у 79,2% тематичних хворих спільно з лікарями: невропатологом, психотерапевтом, психологом.
Були виявлені певні клінічні предиктори генітального ендометріозу (диспареунія, порушення менструальної та репродуктивної функцій, болючий синдром на тлі конкретних показників гомеостаза), що дозволило оптимізувати лікувальну тактику й реабілітацію хворих із ДЗМЗ і генітальним ендометріозом. В результаті були отримані наступні данні: регресія мастопатії – у 14 (29,2%) пацієнток, клінічне знищення болючого синдрому - в 35 (72,9%), нормалізація менструального циклу – в 33 (68,7%), відновлення співвідношень ендокринного гомеостазу – в 36 (75%), нормалізація психоемоційного стану - в 42 (87,5%). На підставі отриманих даних нами була розроблена та запропонована клінічно апробована система обстеження та диференційованої тактики ведення хворих з різними формами мастопатії та стадіями генітального ендометріозу.
Поряд із представленою стандартною інформацією із клінічного протоколу на вибір лікування жінок з ДЗМЗ у хворих з лейоміомою матки можуть впливати: виразність суб'єктивно важких симптомів захворювання (мено- і метроррагій, анемізація, біль в молочних залозах, внизу живота, у попереку, мастодинія, порушення функції суміжних органів), безпліддя, а також особистісні особливості пацієнток, включаючи їхній темперамент і характер. Було обстежено 44 жінки з лейоміомою матки, з них після хірургічного лікування (тотальна оваректомія та розширена гістеректомія)12 (27,3%) і без оперативного втручання - 32(72,7%). Вік жінок коливався від 38 років до 51 року, середній вік обстежених жінок складав 49,3 року. Особливо необхідно виділяти підгрупу пацієнток, що звернулися в клініку зі скаргами на безплідність і невиношування – 7 (15,9%), однак, більше половини жінок – 25 (56,8%) вважали реалізованою репродуктивну функцію до моменту обстеження.
Результати анкетування свідчили про те, що жінки, яким в репродуктивному віці була проведена гістеректомія із приводу лейоміоми матки – у 8 (18,2%) пацієнток, відрізнялися більш раннім виникненням патології молочних залоз, а також різнилися за темпераментом від аналогічної групи після органозберігаючої операції – 4 (9,1%). Виражена імпульсивність жінок, яким була проведена гістеректомія в репродуктивному віці із приводу міоми, супроводжувалася клінічно більш вираженою мастопатією, що диктувало необхідність проводити вивчення структури особистості для пропозиції оптимальної лікувальної тактики.
Зміни ендокринного гомеостазу у хворих з мастопатією та лейоміомою матки вимагали індивідуально підібраної, патогенетично осмисленої лікувальної тактики: при функціональній гіперпролактинемії у 15 (34,1%) – застосування препаратів, що нормалізують дофамінергічну регуляцію пролактинсекреторної функції гіпофіза - достінекс, при зниженні рівня прогестерона – гестагени, вітаміни, а також імунокоректори, адаптогени, а також корегуючу гормонотерапію – КОК і місцеве лікування прожестожелем, що дозволило досягти наступних результатів: регресія мастопатії – у 12 (27,2%) жінок, клінічне поліпшення – у 29 (65,9%), відсутність мастодинії – у 39 (88,6%) пацієнток. Загальновідомо, що поліпрогмазія при сполученні гінекологічної патології та захворювань гепатобіліарної системи визначає ймовірність проонкогенного, тромботичного наслідку гормональної терапії. Досить актуальною є проблема небажаних ефектів після призначення естрагенів і гестагенів, тому ми вважали за доцільне до комплексу медикаментозної тактики включати хофітол або інші гепатопротектори, тому що головну роль печінкового метаболізму у фармакокінетиці препаратів і метаболізмі гормонів важко переоцінити. Остаточний вибір тактики та корекції стану гепатобіліарної системи у ході гормональної терапії (або після неї) повинен бути обговорений з гепатологом (гастроентерологом, клінічним фармакологом). Доцільність і тактика гормональної терапії при ДЗМЗ у хворих на лейоміому матки з появою небажаних ефектів конкретизується індивідуально, у тому числі, з урахуванням прогнозу основного захворювання, необхідності використання гормонів у кожному конкретному випадку, при інформуванні пацієнток про позитивні й можливі негативні наслідки призначеної їм гормональної терапії. Ймовірний ризик гепатотоксичності, холестаза, збільшення ваги або ризику тромбофілічних ускладнень диктує необхідність моніторингу біохімічних показників і клінічного аналізу крові, при цьому він не повинен перевищувати очікувану користь від гормональної терапії.
СДЗГ здебільшого представляють спектр запальних процесів в області верхніх відділів статевого тракту у сполученні з фоновими захворюваннями шийки матки, лейоміомою матки, ендометріозом.
Клініко-патогенетичні особливості хворих III групи (ДЗМЗ у хворих із запаленням придатків матки) виявили наявність болю – у 35 (92,1%), патологічну секрецію виділень – 28 (73,7%) гіперфункцію ФСГ=4,8±1,2МЕ/л і Е2=2,13±0,12нмоль/л, гіпопрогестеронемію у 24 (63,2%) випадках, що проявлялося порушенням базальної та циклічної секреції ЛГ і ФСГ і було наочно виражене в момент передбачуваної овуляції. У цих хворих у 21 (63,2%) випадку була виявлена дисфункція щитоподібної залози, що не тільки визначало порушення кореляційної залежності між стероїдними та тиреоїдними гормонами r = 0,81 (р<0,05), але й диктувало необхідність спільної лікувальної тактики із лікарем-ендокринологом та маммологом. Беручи до уваги думку інших дослідників (В.Н. Сєров, А.П. Тихомиров 2003), які займаються даною проблемою, вважали за доцільне включення до комплексу лікування КОК (для нормалізації гормонального гомеостазу, профілактики рецидивів запалення, у деяких випадках – не тільки з лікувальною, але й контрацептивною метою), імунотропні засоби (пірогенал, адаптогени, індуктори інтерфероногенеза), метаболічну терапію (вобензим) на тлі апаратної фізіотерапії та бальнеолікування (йодобромні ванни). Усі хворі даної групи були двічі з інтервалом в 4 – 6 тижнів обстежені на наявність вовчакового антикоагулянту та змін деяких ланок системи гемостазу. Ні в кого із хворих даної групи не була виявлена циркуляція ВА, в 11 (28,9%) пацієнток була виявлена хронічна форма синдрому ДВЗ, що визначало необхідність застосування в комплексі лікувально-реабілітаційних заходів, антиагрегантів і антикоагулянтів, електрофореза. Місцеве лікування складалося з курсового застосування гестагена – прожестожеля не менше 6-9 місяців.
Якщо у хворих з генітальним ендометріозом після ретельно виконаного діагностичного алгоритму були виявлені наступні форми ДЗМЗ: дифузна форма мастопатії з перевагою фіброзного компонента – у 26 (54,2%), фіброзно-кістозна форма – у 17 (35,4%), дифузна форма мастопатії з перевагою залозистого компонента (аденоз) – 5 (10,4%), то у пацієнток з лейоміомою матки ми спостерігали наступні форми мастопатії: дифузна форма мастопатії з перевагою фіброзного компонента – у 26 (59,1%), фіброзно-кістозна форма - 15 (34,1%), дифузна форма мастопатії з перевагою залозистого компонента (аденоз) – 3 (6,8%). Структура ДЗМЗуШ групіхворихсклала: дифузна форма мастопатії з перевагою фіброзного компонента – у 19 (50%), фіброзно-кістозна форма 15 (39,5%), дифузна форма мастопатії з перевагою залозистого компонента (аденоз) – 4 (10,5%).Рис. 1.
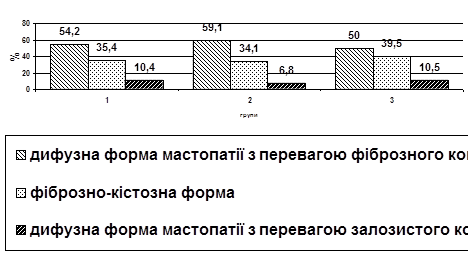
Рис.1 Варіанти ДЗМЗ у тематичних хворих по групах
За допомогою математичного аналізу з маси анамнестичних, лабораторних, клінічних та інструментальних даних були виділені та охарактеризовані 14 найбільш значимих факторів ризику. Останні були внесені в діагностичну таблицю 3, призначену для визначення ймовірності патологічного процесу молочних залоз. Із цією метою в обстежених жінок, шляхом опитування, була встановлена наявність тих або інших факторів ризику, що враховувалися.
Таблиця 3.
Фактори ризику виникнення ДЗМЗ
| Фактори ризику | Коефіцієнт значимості фактору |
| 1. Сочетані доброякісні захворювання геніталій в анамнезі | 17 |
| 2. Безпліддя | 15 |
| 3. Невиношуваннявагітності | 12 |
| 4. Спадковасхильністьдо онкопатології | 11 |
| 5. Гіперпролактинемія | 10 |
| 6. Пізнє менархе | 8 |
| 7. Гіпогалактія | 7 |
| 8. Оперативнівтручання на геніталіях | 6 |
| 9. Сексуально-трансмісивні захворювання | 5 |
| 10.Наявність екстрагенітальної патології | 4 |
| 11. Галакторея | 3 |
| 13. Перенесений хронічний процес додатків матки | 2 |
Проведені нами дослідження з урахуванням створеної програми прогностичного ризику факторів виникнення ДЗМЗ у хворих з різними нозологічними формами гінекологічної патології дозволили виявити не тільки конкретні механізми патогенезу, але й рекомендувати в клінічну практику рівень диспансеризації цього розповсюдженого контингенту гінекологічних хворих, що, можливо, доповнить клінічні протоколи Наказів МОЗ України.
ВИСНОВКИ
У дисертаційній роботі наведено нове рішення актуальної задачі сучасного акушерства та гінекології - підвищення ефективності лікування ДЗМЗ шляхом визначення прогностичної значимості і патофізіологічної ролі порушень репродуктивної системи, як наслідку генітального ендометріозу, лейоміоми матки, хронічного запалення геніталій, з урахуванням впливу лікування на органи мішені репродуктивної системи.
1. У пацієнток з наявністю генітального ендометріозу, лейоміоми матки, хронічного запалення геніталій, які супроводжуються порушеннями специфічних функцій жіночого організму, ДЗМЗ зустрічаються в 92,6% випадків, що підтверджує теорію про єдність патогенезу патологічних змін в органах-мішенях і про синхронний розвиток доброякісних гіперпластичних процесів у них.
2. У хворих з такою гінекологічною патологією як генітальний ендометріоз, лейоміома матки, хронічне запалення геніталій нейроендокринні порушення протікають у вигляді відносної гіперестрогенії, гіперкортизолемії та функціональної гіперпролактинемії, що призводить до ановуляціі та розвитку гіперпластичних процесів у молочних залозах. Характерні зміни ендокринної системи при поєднанні генітального ендометріозу та мастопатії полягають в пригніченні функції щитоподібної залози у лютиіновій фазі менструального циклу у 27,1% пацієнток (зниження рівня Т3 на 28.5%, Т4 на 55.9%, підвищення ТЗГ на 18,2%). Наявність позитивної кореляційної залежності між ТЗГ та Прл (r = +0,63) у цих хворих дозволяє прогнозувати виникнення рецидивів ендометріоїдних гетеротопій, ефективність лікування та реабілітації генеративної функції.
3. Застосування сучасних діагностичних методів (УЗД, маммографії, гормональних досліджень) при обстеженні пацієнток з гінекологічними захворюваннями дозволяє не тільки своєчасно, доклінічно діагностувати ДЗМЗ, але й виділити групи ризику за розвитком мастопатії та провести превентивну корекцію.
4. Для хворих з мастопатією та генітальними захворюваннями (ендометріозом, лейоміомою матки) характерні наступні психогенні синдроми: тривожно-депресивний (у 37,5% пацієнток), обсессивно-фобічний (у 31,3%), депресивно-ергопатичний (у 16,7%), неврастеноподібний (у 14,6%), які коррелюють з нейроендокринними зсувами (r = + 0,78) і, таким чином, створюють умови формування системних порушень, що призводять до патології молочних залоз.
5. Еволюція мікробного фактора при сучасних хронічних запаленнях геніталій представлена розповсюдженням хронічних рецидивуючих форм хламідійної та вірусної інфекції, що обумовило зміни нейроендокринного гомеостазу та, таким чином, створило умови розвитку ДЗМЗ.
6. Відносна або абсолютна гіперестрогенія (Е2 =84±16нмоль/л) на тлі підвищеного або нормального рівня Прл, яка складає основу патогенезу лейоміоми та генітального ендометріозу, дозволяє використовувати показники Е2 та Прл як предиктори розвитку, прогресування захворювань молочних залоз та як об’єктивні критерії ефективності гормональної або немедикаментозної терапії ДЗМЗ. Паціентки з такими гінекологічними захворюваннями як генітальний ендометріоз, лейоміома матки, хронічні запальні захворювання складають групу підвищеного ризику розвитку ДЗМЗ та повинні перебувати під диспансерним наглядом.
7. Застосування КОК або гестагенів в комплексі лікування хворих з ДЗМЗ поєднаних з порушеннями репродуктивної системи (лейоміома матки, генітальний ендометріоз, хронічні запальні захворювання) сприяє позитивному перебігу захворювання у 73,6% хворих, що дозволяє рекомендувати їх у якості патогенетично обґрунтованої, базисної лікувальної тактики.
8. Значна розповсюдженість ДЗМЗ, кореляційні зв’язки між станом молочних залоз, нейроендокринними порушеннями, гінекологічними захворюваннями (лейоміома матки, генітальний ендометріоз, хронічні запальні захворювання), висока ефективність гормональної терапії в лікуванні ДЗМЗ, обумовлюють необхідність залучення гінекологів до лікування, виділення груп ризику та профілактики ДЗМЗ.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. Для визначення діагностичних критеріїв генітального ендометріозу у хворих із ДЗМЗ клінічно доцільно проводити гормональний моніторинг, що визначає місце гормональної терапії до і після оперативного втручання, а також динамічне спостереження за станом молочних
8-09-2015, 22:02
