- ефективним режимом для цитоцентрифугування є – 1500 об/хв, 7 хв;
- оптимальна концентрація оригінальних очищених моноклональних антитіл, для ефективного та специфічного застосування повинна складати - 1: 100.
У результаті запропонованих змін в тесті зберігалась більша кількість морфологічно цілих лейкоцитів, а комплекс АГ-АТ, що виявлявся за допомогою методу пероксидазного зафарбування, мав чіткий колір та контури.
Для дослідження діагностичної ефективності тесту на виявлення антигенемії ми відібрали групу хворих, що складалась із 17 пацієнтів після трансплантації нирки. Лiмфоцитарні фракції та сироватки хворих досліджували на наявність вірусних антигенів трьома методами: за допомогою тесту на виявлення антигенемії, швидкого культурального методу та полімеразної ланцюгової реакції (табл. 3). Досліди проводились у трьох повторах.
При порівнянні отриманих результатів встановлено, що методом ПЛР (якісний) у всіх 17-ти пацієнтів (100%) було виявлено ДНК ЦМВ (рис. 2). Дослідження лейкоцитів цієї групи хворих швидким культуральним методом виявило, що у 12 хворих (70%) було виявлено антиген ЦМВ, за допомогою тесту на виявлення антигенемії у лiмфоцитах крові, наявність раннього білку рр65 до ЦМВ було показано у 5-ти хворих (30%), при чому ці хворі мали клінічно виражені симптоми ЦМВІ і знаходились на гемодіалізі. Ідентичність результатів, отриманих ШКМ та у тесті на виявлення антигенемії спостерігалась у 10 хворих (59%) із них 5 позитивних та 5 негативних (рис. 3).
Таблиця 3
Порівняння результатів виявлення маркерів ЦМВ у крові паціентів після трансплантації нирки методами: тАГ, ШКМ та ПЛР
№ п/п лейкоцитарних фракцій сироваток |
Методи обстеження | ||
| ШКМ in vitro | тАГ | ПЛР | |
| антиген-позитивних клітин | антиген-позитивних клітин | ДНК | |
| 1 | - | - | + |
| 2 | - | - | + |
| 3 | 4 | - | + |
| 4 | - | - | + |
| 5 | 2 | - | + |
| 6 | - | - | + |
| 7 | 2 | - | + |
| 8 | 4 | - | + |
| 9 | 14 | - | + |
| 10 | 3 | - | + |
| 11 | 16 | 12 | + |
| 12 | 9 | 10 | + |
| 13 | 7 | 9 | + |
| 14 | 1 | - | + |
| 15 | 8 | 6 | + |
| 16 | 1 | 1 | + |
| 17 | - | - | + |
Примітка:
1. “+” - позитивний результат;
2. “-“ - негативний результат.
У 12 хворих співпадав позитивний результат при діагностиці ШКМ та ПЛР, що складало 70% (рис. 3). Трьома методами однакові результати було отримано тільки у 5-ти випадках, що складало 30%. Швидкий культуральний метод та метод прямої детекції АГ у 5-ти випадках виявляв кількість антиген-позитивних клітин, що супроводжувалось наявністю клінічних симптомів у хворих і може характеризувати інфекцію як гостру, в наслідок реактивації персистентної інфекції (усі пацієнти приймали раніше анти-ЦМВ терапію). У 5-ти інших хворих ШКМ та методом детекції антигенемії ЦМВ виділено не було, а ДНК методом ПЛР виявлялось. Це також пояснюється тим, що метод ПЛР є дуже чутливим, і виявляє ДНК вірусу навіть коли інфекція перебуває у персистентній формі.
Аналіз результатів дозволяє зробити висновок, що отримані нами дані вказують на високу ступінь співпадання результатів тесту на виявлення антигенемії та швидкого культурального методу, а також клінічними проявами ЦМВІ. Висока чутливість тесту на виявлення антигенемії дає можливість швидко діагностувати гостру форму ЦМВІ у пацієнтів після трансплантації нирки, до того ж антигенемія може бути виявлена протягом 3-4 год.
Таким чином, отримані дані по виявленню ранніх білків ЦМВ за допомогою нових швидких діагностичних методів показали їх діагностичну цінність і дозволяють застосовувати їх у медичних закладах. Ефективність швидкого культурального методу становила 70% у хворих після трансплантації нирки.
Дослідження антивірусної активності 6-аzaC. Вивчали цитотоксичність 6-azaC у культурі ФЛЕЛ за дією на життєздатність клітин використовуючи барвник трипановий синій. Було встановлено, що на 3-ю добу культивування клітин з 6-azaC у концентраціях від 50000 мкг/мл до 30000 мкг/мл життєздатних клітин у дослідах не спостерігалось. У присутності 6-azaC у концентрації 26000 мкг/мл кількість життєздатних клітин складала - 20% від контролю клітин, а при концентрації 20000 мкг/мл - 80%. 6-azaC у концентрації 10000 мкг/мл виявляв незначну цитотоксичну дію, кількість життєздатних клітин складала - 95%. Нижчі концентрації 6-azaC на життєздатність клітин протягом 3-х діб культивування не впливали. Отримані результати представлені на рис. 4. Життєздатність клітин у 100% зберігалася протягом 7-и діб у присутності у концентрації 2000 мкг/мл, і протягом 10-и діб при концентраціях речовини 500 мкг/мл – 100 мкг/мл. Розрахунки зроблені за графіком показали, що цитотоксична доза (СD50)6-azaC, тобто така, що не спричиняла незворотніх змін у морфології та життєздатності клітин на 3-ю добу складала – 24000 мкг/мл.
Дослідження цитотоксичної дії 6-azaC на синтез ДНК клітин ФЛЕЛ показало, що у контрольній культурі через 1 добу 30% клітин перебували у стадії синтезу ДНК. У процесі культивування кількість мічених клітин у контрольній культурі поступово знижувалася. Через 3-и доби кількість мічених клітин складала 12%.

Рис. 4. Цитотоксичний вплив 6-azaC на кількість життєздатних клітин ФЛЕЛ
по осі ординат- % життєздатних клітин від контролю клітин,
по осі абсцис – концентрація 6-azaC, мкг/мл
У культурі, обробленій 6-azaC концентраціями від 12000 мкг/мл до 240 мкг/мл, число клітин, із пригніченим синтезом ДНК через 1 добу незначно відрізнялось від контролю (рис. 5). Однак, через 3 доби число клітин, що синтезували ДНК, знизилось щодо контрольної популяції на 50% у присутності 2400 мкг/мл 6-azaC, а при концентрації 24000 мкг/мл практично на 100%. Отримані дані показують, що на 3-ю добу 50% зниження числа клітин, що синтезують ДНК, відбувалося при концентрації 6-azaC - 2400 мкг/мл.
Таким чином, було встановлено, що концентрація препарату що на 50% пригнічувала синтез ДНК і на 50% інгібувала приріст клітин (CD50) для 6-azaC становила - 2400 мкг/мл, і виявилася значно нижче концентрації, що впливала на життєздатність клітин – 24000 мкг/мл.
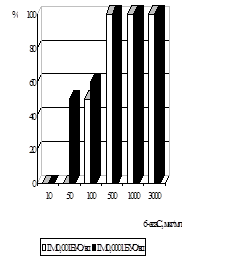
Дослідження антивірусної активності 6-azaC показало, що у терапевтичній схемі використання 6-azaC у концентраціях від 500 мкг/мл до 300 мкг/мл призводили до 100% пригнічення розвитку ЦПД вірусу при інфекційній множинності (ІМ) 0,001 БУО/кл і 0,0001БУО/кл. Аналіз дозозалежності дії 6-azaC показав, що 50% ефективна доза (ЕD50 ) при ІМ 0,001 БУО/кл складає 100 мкг/мл, при ІМ 0,0001 БУО/кл - 50 мкг/мл (рис. 6). При концентрації 6-azaC 10 мкг/мл і нижче інгібуючого ефекту не спостерігалось. ІS для 6-azaC у терапевтичній схемі при ІМ 0,001 БУО/кл складав 24, а при ІМ 0,0001БУО/кл – 48.
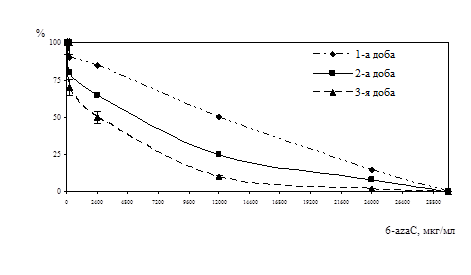 |
Рис. 5. Цитотоксична дія 6-azaC на пригнічення синтезу ДНК клітин ФЛЕЛ
по осі ординат- % від контролю клітин, що синтезують ДНК,
по осі абсцис – концентрація 6-azaC, мкг/мл.
При дослідженні впливу 6-azaC на розвиток вірусної ЦПД у профілактичній схемі було встановлено, що при ІМ 0,0001 БУО/кл концентрації 10мкг/мл і 100 мкг/мл призводили до пригнічення вірусоспецифічної ЦПД на 70%, при 1000 мкг/мл - на 90%, при ІМ 0,001 БУО/кл концентрація 10 мкг/мл пригнічувала ЦПД вірусу на 13%, 100 мкг/мл і 1000 мкг/мл - на 30% і 33% відповідно (рис. 7).
Вивчення антивірусної дії 6-azaC показало, що препарат ефективно пригнічує репродукцію ЦМВ у культурі клітин при профілактичній схемі застосування. Було встановлено, що інгібуюча доза ED70 , що відповідає концентрації 6-azaC, при якій спостерігалося 70% пригнічення утворення включень ЦМВ, становила 10 мкг/мл. ІS даного засобу при ІМ 0,0001 БУО/кл складав 240.
|
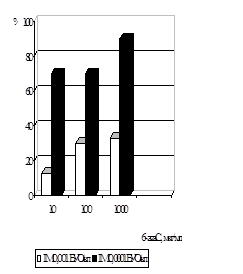 |
Рис. 6. Анти-ЦМВ активність 6-azaC у терапевтичній схемі по осі ординат- % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація 6-azaC, мкг/мл |
Рис. 7. Анти-ЦМВ активність 6-azaC у профілактичній схемі. по осі ординат- % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація 6-azaC, мкг/мл |
Дослідження впливу 6-azaC на синтез вірусних білків показав, що у концентраціях 100 мкг/мл і 1000 мкг/мл число клітин інфікованих ЦМВ, що містили білки р72 і рр65 у присутності сполуки 6-azaC практично не відрізнялось як від контрольної популяції клітин, так і від культури, обробленої ганцикловіром.
Структурний білок gВ ![]() був зареєстрований у 2,5% клітин контрольної культури через три доби після зараження, у той час як у клітинах оброблених 6-azaC у концентраціях 1000 мкг/мл і 3000 мкг/мл кількість клітин, що ситезували gВ складало 1% і 0,5% відповідно. Максимальне розходження результатів у числі клітин, що синтезували gВ, було відзначено на п’яту добу після зараження, коли число клітин, що містили вірусний білок у необробленій популяції було у 10 разів більше, ніж у досліді. Під дією 6-azaC і ганцикловіру нагромадження пізнього структурного білку gВ було знижено приблизно однаковою мірою.
був зареєстрований у 2,5% клітин контрольної культури через три доби після зараження, у той час як у клітинах оброблених 6-azaC у концентраціях 1000 мкг/мл і 3000 мкг/мл кількість клітин, що ситезували gВ складало 1% і 0,5% відповідно. Максимальне розходження результатів у числі клітин, що синтезували gВ, було відзначено на п’яту добу після зараження, коли число клітин, що містили вірусний білок у необробленій популяції було у 10 разів більше, ніж у досліді. Під дією 6-azaC і ганцикловіру нагромадження пізнього структурного білку gВ було знижено приблизно однаковою мірою.
Таким чином було встановлено, що (СD50)6-azaC, що не спричиняла незворотніх змін у морфології та життєздатності клітин на 3-ю добу складала – 24000 мкг/мл, а концентрація препарату що на 50% пригнічувала синтез ДНК (CD50) становила - 2400 мкг/мл. 50% ефективна доза (ЕD50 ) у терапевтичній схемі застосування при ІМ 0,001 БУО/кл відповідала 100 мкг/мл, при ІМ 0,0001 БУО/кл – ED50 - 50 мкг/мл. Індекс селективності (ІS) для 6-azaC в залежності від множинності інфікування складав 48-240.
Оцінка анти-ЦМВ активності амізону. Цитотоксичність амізону за дією на життєздатність клітин вивчали використовуючи сполуку у концентраціях 0,1 мкг/мл - 1000 мкг/мл. Протягом першої доби культивування амізон виявляв незначну цитотоксичну дію (рис. 8). На 3-ю добу культивування при концентрації амізону 1000 мкг/мл спостерігалася загибель 80% клітин. У присутності препарату амізон у концентрації 800 мкг/мл кількість життєздатних клітин становила 50% від загального числа клітин, а при концентрації 500 мкг/мл - 70%. Амізон у концентрації 200 мкг/мл виявляв незначну цитотоксичну дію, кількість нежиттєздатних клітин становила менше 10%. У нижчих концентраціях цитотоксичної дії препарату не спостерігалось. Цитотоксична доза (СD50), яка зменшувала кількість життєздатних клітин для амізону становила 800 мкг/мл.
Дію амізону на синтез ДНК клітин ФЛЕЛ з використанням методу мічення клітинної ДНК, досліджували в концентраціях 1 мкг/мл, 10 мкг/мл, 100 мкг/мл, 800 мкг/мл та 1000 мкг/мл (рис. 9). Підрахунок клітин, що містили ³Н-ТД-мітку, показав, що у культурі, не обробленій амізоном, через добу 30% клітин перебували у стадії синтезу ДНК. У процесі культивування кількість мічених клітин у контрольній культурі поступово знижувалась. Через три доби їх кількість становила 12%. У культурі, обробленій амізоном у концентраціях від 1 мкг/мл до 10 мкг/мл, число клітин, що містили ³Н-ТД-мітку, через добу культивування незначно відрізнялось від контролю. При концентраціях препарату 100 мкг/мл та 800 мкг/мл число мічених клітин щодо контролю становило 60% і 30% відповідно. Через три доби число клітин, що синтезують ДНК, знизилось щодо контрольної популяції на 50% у присутності 100 мкг/мл амізону, при концентрації 800 мкг/мл на 100%. Таким чином, отримані дані показали, що на 3-ю добу 50% зниження числа клітин, що синтезують ДНК (CD50), відбувається при концентрації амізону 100 мкг/мл.
 |
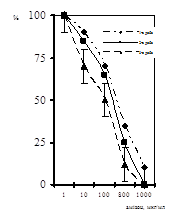 |
Рис. 8. Цитотоксичний вплив амізону на кількість життєздатних клітин ФЛЕЛ по осі ординат- % життєздатних клітин від контролю клітин, по осі абсцис – концентрація амізону, мкг/мл |
Рис. 9. Цитотоксична дія амізону на пригнічення синтезу ДНК клітин ФЛЕЛ по осі ординат - % віл контролю клітин, що синтезують ДНК, по осі ординат- концентрація амізону, мкг/мл |
Крім того, вивчали приріст клітин у контрольній і дослідній культурах. Для цього проводили підрахунок числа клітин на одиницю площі. Через три доби культивування відбувалося зменшення числа клітин на 50% щодо контрольної популяції при концентрації амізону 100 мкг/мл. Таким чином, концентрація препарату, що пригнічувала синтез ДНК на 50% та інгібувала приріст клітин на 50% для амізону складала 100 мкг/мл, виявилася значно нижче концентрації, що впливала на життєздатність клітин – 800 мкг/мл.
Дослідження анти-ЦМВ активності амізону у терапевтичній схемі досліджували у концентраціях 10 мкг/мл, 5 мкг/мл, 1 мкг/мл, 0,5 мкг/мл, 0,1 мкг/мл та при ІМ вірусу 0,001 БУО/кл та 0,0001 БУО/кл. Ні при одній із досліджуваних концентрацій амізону та інфекційній множинності вірусу препарат не виявляв інгібуючої активності відносно ЦМВ.
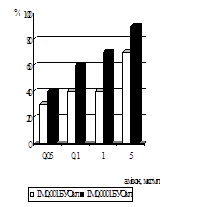
Дослідження впливу амізону на репродукції ЦМВ у профілактичній схемі було вивчено в присутності препарату у концентраціях 5 мкг/мл, 1 мкг/мл, 0,1 мкг/мл, 0,05 мкг/мл, з ІМ вірусу 0,0001 БУО/кл й 0,001 БУО/кл (рис. 10). Присутність амізону у концентрації 5 мкг/мл при зараженні ЦМВ із ІМ 0,0001 БУО/кл приводила до пригнічення вірусоспецифічної ЦПД через 5 діб на 90%, з ІМ 0,001 БУО/кл - на 70%. Амізон у концентрації 1 мкг/мл інгібував здатність вірусу до утворення антигенвмісних включень при ІМ 0,0001 БУО/кл на 70%, при ІМ 0,001 БУО/кл на 40%. Зменшення цитопатичної дії ЦМВ із ІМ 0,0001 БУО/кл було виявлено при концентрації 0,1 мкг/мл на 60%, із ІМ 0,001 БУО/кл - на 40%. Амізон у концентрації 0,05 мкг/мл інгібував здатність вірусу до утворення антигенвмісних включень при ІМ 0,0001 БУО/кл на 40% та при ІМ 0,001 БУО/кл на 30%.
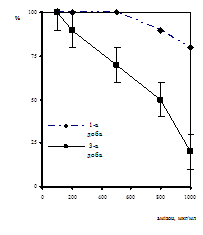
Вплив амізону на розвиток ЦМВІ у клітинах ФЛЕЛ було вивчено також при використанні накопичувальної профілактичної схеми (рис. 11). Для цього препарат у концентраціях сполуки 5 мкг/мл, 1 мкг/мл, 0,1 мкг/мл, 0,05 мкг/мл та 0,001 мкг/мл тричі вносили у культуру клітин - за 48 год., за 24 год. і за 1 год. до внесення вірусу (ІМ 0,001 БУО/кл і 0,0001 БУО/кл). Дослідження концентрацій сполуки показало, що ефективна доза (ЕD50) зменшується до 10% при вивченні усіх концентрацій амізону у порівнянні із ЕD50 ЦМВ у звичайній профілактичній схемі.
Таким чином, вивчення антивірусної дії амізону показало, що препарат ефективно пригнічував розвиток ЦМВІ у культурі клітин при профілактичній схемі застосування. Було встановлено, що цитотоксична доза (CD50 ), що відповідає концентрації амізону, при якій спостерігалося 50% інгібування ЦПД ЦМВ, із ІМ 0,001 БУО/кл становила 1 мкг/мл, а з ІМ 0,0001 БУО/кл - 0,1 мкг/мл, IS в залежності від інфекційної множинності складав 100 – 1000.
 |
 |
Рис. 10. Анти-ЦМВ активність амізону у профілактичній схемі по осі ординат - % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація амізону, мкг/мл |
Рис.11. Анти-ЦМВ активність амізону у профілактичній накопичувальній схемі по осі ординат - % пригнічення формування включень від контролю вірусу, по осі абсцис – концентрація амізону, мкг/мл |
Результати дослідження дії амізону на синтез ЦМВ білків при ІМ 0,001 БУО/кл. показали, що протягом трьох діб спостереження число клітин, що містили білки р72 і рр 65 у культурі, попередньо обробленій амізоном, практично не відрізнялось як від контрольної популяції клітин, так і від культури, обробленої ганцикловіром. Кількість клітин, що містила структурний вірусний білок gВ, у контролі та у досліді вірогідно не відрізнялась протягом перших двох діб. Через три доби після зараження вірусний білок gВ у контрольній культурі був визначений у 2,5% клітин. У клітинах, оброблених амізоном, кількість клітин, що містили gВ, становила 0,5%. На п’яту добу після зараження спостерігалось найбільше розходження між контрольною і дослідною культурами у кількості клітин, зафарбованих МКА до gВ. Так, число клітин, що синтезують gВ у культурі, обробленій aмізоном, ганцикловіром і у контрольній культурах склало 3%, 1,8% і 10%, відповідно. Таким чином, на п’яту добу після зараження, під дією aмізону накопичення пізнього структурного білку gВ було знижено приблизно у 3 рази щодо контрольної популяції. Таким чином, амізон пригнічував синтез пізніх структурних білків, продукція яких залежить від реплікації вірусної ДНК.
ВИСНОВКИ
У дисертаційній роботі представлено вирішення актуального наукового завдання щодо удосконалення ранньої лабораторної діагностики цитомегаловірусної інфекції та визначення нових вітчизняних хіміотерапевтичних засобів, що володіють противірусними властивостями.
1. Показано високу діагностичну цінність застосування методу культур клітин ФЛЕЛ у лабораторній діагностиці, який дозволяє протягом 24 год. виявляти ранні білки (р72 та рр65) ЦМВ і цим підтвердити розвиток гострої форми ЦМВІ у 65%-70% обстежених хворих.
2. Доведено ефективність виявлення у лейкоцитах крові раннього білку ЦМВ рр65, за допомогою моноклональних антитіл, як маркеру активації ЦМВІ на прикладі хворих після трансплантації нирки.
3. Встановлено активність 6-аzaC проти ЦМВ та визначено критерії цієї активації: цитотоксичну дозу (CD50 ), по дії на ДНК - 2400 мкг/мл, ефективну дозу (ED50 ) - 50 мкг/мл та індекс селективності (IS) 48.
4. Встановлено активність амізону проти ЦМВ та визначено критерії цієї активації: цитотоксичну дозу (CD50 ) по дії на ДНК - 100 мкг/мл, ЕD50 (1 мкг/мл), IS (100).
5. Доведено, що механізм антивірусної дії 6-azaC та амізону проявляється пригніченням синтезу пізнього структурного білку ЦМВ – gВ. Вивчені препарати не впливають на синтез ранніх білків р72 та рр65.
СПИСОК НАУКОВИХ РОБІТ, ОПУБЛІКОВАНИХ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Абдуллаєва М.В., Фролов А.Ф., Федорова Н.Е., Меджидова М.Г., Адуева С.М., Дегтярьова М.В., Воронцова Ю.Н., Алямовская Г.А., Кешищан Е.С., Кущ А.А. Лабораторна діагностика цитомегаловірусної інфекції у дітей раннього віку: порівняльний аналіз ефективності серологічного, швидкого культурального методів і полімеразної ланцюгової реакції // Вісник Київського національного університету імені Тараса Шевченка. – 2005.- N 44. - С. 4-6.
2. Абдуллаєва М.В.,
8-09-2015, 22:02