Найбільш інтенсивно розміри щитовидної залози зростали у віці 11-13 років, але темпи збільшення були різними в залежності від статі. У дівчаток значне збільшення щитовидної залози відбувалося вже у 8-9 років, максимально перевищив об'єми залози хлопчиків у 13 років. Виявлений статевий диморфізм та гетерохронність інтенсифікації збільшення ЩЗ у пубертатному періоді можна пояснити, як розвитком відносної йодної недостатності на тлі підвищення ренальної екскреції йоду під впливом естрогенів (Л.І. Васечкина, 2003), так і більшою частотою вроджених дефектів гормоноґенезу в осіб жіночої статі (Э.П Касаткина, 2003).
Виявлені статево-вікові особливості розвитку зобу були підтверджені даними гормонального дослідження. Якщо розвиток зобу в пубертатному періоді у хлопчиків дозволяв досягти ефективної компенсації функціонального стану ЩЗ (ТТГ - 1,92±0,41 мОД/л), то в дівчаток зберігався вірогідно вищий рівень секреції ТТГ гіпофізом (2,37±0,47 мОД/л; р<0,05), що зумовлювало подальшу стимуляцію ЩЗ. Отримані дані збігаються з думкою інших дослідників, що жіноча стать є фактором ризику щодо виникнення зобу та прихованої гіпотироксинемії.
Взагалі визначення в крові дітей концентрації Т3 , Т4 , віл. Т4 , ТТГ продемонструвало тісну взаємодію ланцюга щитовидна залоза – аденогіпофіз. У дітей 6-11 років із зобом встановлено статистично значиме зниження віл. Т4 (13,73±1,24 пмоль/л; р<0,01), на тлі підвищеного рівня ТТГ (3,18±0,3 мОД/л; р<0,05). Ще більше зниження функціональних резервів ЩЗ у межах субклінічного гіпотиреозу виявлено у дітей із структурно зміненим зобом (ТТГ - 4,85±0,62 мОД/л; Т4 - 62,15±0,61 нмоль/л) у порівнянні із аналогічними показниками у дітей із дифузним зобом (ТТГ - 2,3±0,2мОД/л; Т4 - 107,05±9,27 нмоль/л; р<0,01). Ці діти мали й найгірше йодне забезпечення (медіана йодурії - 60 мкг/л; р<0,01). Таким чином, неспроможність гіпертрофії та гіперплазії щитовидної залози повністю компенсувати порушення в гіпофізарно–тиреоїдній системі призводила до незворотних морфологічних змін тканини ЩЗ та сприяла вузлоутворенню. Виявлений взаємозв’язок між тяжкістю перебігу захворювання та тиреоїдними показниками узгоджується з даним інших авторів (Э.П. Касаткина, 2005; В.В. Потемкин, 1986).
Установлено наявність прямого кореляційного зв’язку між рівнем ТТГ та об’ємом ЩЗ (r=0,4; р<0,05) і зворотного зв’язку між ТТГ та рівнем йодурії (r=-0,37; р<0,05). Цей зв’язок був найбільш тісним у хворих із вузловою патологією (r=-0,58; р<0,05). Отримані дані дають можливість віднести рівень ТТГ до маркерів розвитку зоба та вузлової патології щитовидної залози.
Було встановлено, що оптимальний функціональний стан ЩЗ у дітей (медіана ТТГ - 1,59 мОД/л) забезпечувався тільки за умов адекватного надходження йоду (медіана йодурії - 112 мкг/л). Зниження функціональної активності ЩЗ у межах субклінічного гіпотиреозу (медіана ТТГ - 4,10 мОД/л) частіше спостерігалось при йодному дефіциті середнього ступеня (медіана йодурії - 40 мкг/л).
Визначення стану йодного забезпечення продемонструвало зниження йодурії нижче оптимального рівня у 79,8 % обстежених дітей. У дітей із зобом медіана йодурії була вірогідно меншою, ніж у дітей без проявів ЙДЗ (78 мкг/л та 88,6 мкг/л відповідно; р<0,05). Дівчатка основної групи мали вищу за хлопчиків медіану йодурії (84 мкг/л та 79,5 мкг/л відповідно; р<0,05). Найгірше йодне забезпечення (зниження екскреції йоду в 86,9 % випадків) було виявлено у молодших школярів із проявами ЙДЗ, чим можна пояснити нижчу функціональну активність їх ЩЗ. У дітей 12-16 років спостерігалося зменшення сили кореляційного зв’язку між рівнем йодурії та ТТГ (r=-0,21), що підтверджує вплив на йодну екскрецію в періоді статевого дозрівання інших факторів (Л.А. Щеплягина, 1999).
Установлена значна частота субклінічного гіпотиреозу серед обстежених дітей (22,9 %). Вірогідно частіше СГ спостерігався у дітей 6-11 років із зобом (30,2 %), ніж в однолітків із групи порівняння (25,0±2,2 %; р<0,05) та у підлітків із зобом (18,2 %; р<0,01). У пубертатному віці частіше стан субклінічного гіпотиреозу спостерігався у дівчаток із зобом (12,1 %), ніж у хлопчиків із зобом (6,0 %; р<0,05). Якнайменше, один із симптомів, специфічних для гіпотиреозу, мали 68 % дітей із відповідними гормональними зсувами. Наявність у дітей 6-11 років із нормальними розмірами ЩЗ проявів мінімальної тиреоїдної недостатності свідчать на користь високого ризику виникнення у них ЙДЗ за умов недостатнього йодозабезпечення.
Оцінка фізичного розвитку продемонструвала загальну тенденцію до зниження росту та маси тіла дітей із ЙДЗ. Показники маси тіла нижче за 25 перцентиль мали 23,8 % (р<0,05) дітей із зобом, росту - 20,6 % (р<0,05). Достовірно частіше в основній групі зустрічалися діти з низьким ростом (8,0 %, р<0,05). Формування зобу за умов нестачі йоду в довкіллі призводило до збільшення частки дітей із дисгармонійним розвитком (19,6 %; р<0,01). Різко дисгармонійний фізичний розвиток було виявлено тільки в групі дітей зі збільшеною ЩЗ (6,2 %; р<0,01). Таким чином, нестача йоду в довкіллі та пов’язані з нею захворювання можуть бути одним із факторів ретардації, тенденція до якої за даними літератури (Л.К. Пархоменко, 2004; А.А. Баранов, 2001) відзначилась у світі з кінця 80-х рр. XX ст. У той час, як серед дітей із нормальним йодним забезпеченням зберігається тенденція до помірної акселерації.
Доведено, що наявність ендемічного зобу у дітей негативно впливає на їх статевий розвиток. Це проявлялось тенденціями до затримки статевого дозрівання у дівчаток (16,2 %; р<0,05), порушення менструальної функції (46,5 %; р<0,05), диспропорціональністю вторинних статевих ознак у хлопчиків (36,8 %; р<0,05). Отримані нами дані збігаються з даними багатьох дослідників щодо значимого впливу стану гіпофізарно-тиреоїдної системи на рівень статевого розвитку дітей (Т.В. Коваленко, 2000; Н.В. Кроха, 2001 та ін.).
Результати клінічного обстеження та аналізу анамнестичних даних свідчать про те, що йододефіцитні захворювання у дітей супроводжуються високою частотою захворювань серцево-судинної системи (28,4%), органів травлення (17,0 %) та сечостатевої системи (12,1 %), що підтверджує наявність тісного зв’язку цих систем із функціональним станом щитовидної залози (Л.И. Браверманн, 2000; Н.Т. Старкова 2002; Э.Б. Яковлєва, 2004).
У 35,0 % дітей із зобом було виявлено залізодефіцитну анемію 1 ступеня тяжкості (25,0 % у групі порівняння; р<0,05). До того ж у дівчаток вона зустрічалася в 1,7 разів частіше (46,3 % проти 27,6 % у дівчаток в групі порівняння; р<0,05). За даними кореляційного аналізу між рівнем гемоглобіну та об’ємом ЩЗ (r=-0,66; р<0,05) визначався зворотній зв’язок. Значна частота поєднання йодо- та залізодефіцитних станів може впливати на перебіг тиреоїдної патології і знижувати ефективність лікувально-профілактичних заходів, що збігається з даними закордонних учених (M. Zimmermann, 2002).
Діти з зобом мали більший ризик розвитку серцево-судинної патології (порушення ритму), ніж їх однолітки без проявів ЙДЗ. Результати покрокового аналізу ВСР продемонстрували підвищення середньої, мінімальної та максимальної ЧСС у 72 % дітей із зобом, появу одиничних надшлуночкових екстрасистол у 82 % випадків. Навантажувальні проби супроводжувались виникненням синусової тахікардії з досягненням максимальних значень ЧСС у 100 % обстежених.
Установлено наявність змін вегетативної регуляції у дітей із зобом переважно за рахунок парасимпатикотонії (60,8 %; р<0,05) у вихідному вегетативному тонусі. За даними навантажувальної проби серед дітей із зобом частіше мало місце перенапруження компенсаторних механізмів симпатичного відділу вегетативної нервової системи (26,1 %; р<0,05). Діти з ЙДЗ демонстрували зниження впливу гуморальної регуляції (Мо=670,2±176,7 до проби, Мо=412,4±185,2 після її проведення, р<0,01) та незначне підвищення симпатичних впливів (збільшення показників ВПР з 1,6±1,2 у стані спокою до 2,3±1,5 після проби; ПАПР з 101,9±66,4 у стані спокою до 140,4±72,4 після; р<0,05). Збереження на високому рівні гуморального компоненту регуляції та парасимпатичних впливів у дітей групи порівняння може обумовлювати їх кращі адаптаційні механізми до йододефіциту за рахунок підвищення процесів органіфікації йоду опосередковано через б1 -адренорецептори, та поліпшення кровотоку крізь ЩЗ завдяки активації парасимпатичних нервів (Н.Т. Старкова, 2002).
При визначенні рівня сформованості інтелектуальних функцій, майже в кожної четвертої обстеженої дитини, було виявлено зниження інтелекту нижче середнього рівня незалежно від наявності проявів ЙДЗ. Низький рівень інтелектуальних функцій спостерігався у 36,5 % дітей зі збільшеною ЩЗ (37,8 % у групі порівняння, р>0,05). Тобто, проживання в умовах легкої нестачі йоду в довкіллі призводить до зниження інтелектуального рівня за рахунок уже вродженого дизонтогенезу вищих психічних функцій, як результат зниження функціональної активності ЩЗ матері в період вагітності (В.В. Утенина та ін., 2001; F. Delange, 2001).
Найнижчий рівень інтелекту спостерігався серед дітей із зобом 6-11 років (2,14 ± 0,16 проти 3,92 ± 0,28 у групі порівняння; р<0,05). Із віком інтелектуальний розвиток значно поліпшувався, досягаючи середнього рівня у більшої частини підлітків. Однак, інтелект дівчаток-підлітків із зобом був меншим за показники інтелекту дівчаток без зобу (відповідно 3,65±0,33 і 4,2±0,35; р<0,05) та хлопчиків із зобом (4,55±0,39; р<0,05). Таким чином, формування ендемічного зобу в ранньому віці з функціонально напруженою роботою ЩЗ обумовлює продовження негативного впливу йодного дефіциту на сформованість інтелектуальних здібностей у дітей, про що свідчить і достовірний зворотній зв’язок між рівнем інтелекту та ТТГ (r=-0,641; p<0,05).
Функціональні порушення ЦНС у дітей із зобом проявлялися синдромом дефіциту уваги (67,1 %; р<0,05), низьким об’ємом короткочасної пам’яті (13,4 %,; р<0,05). Процес навчання в школі позитивно впливав на розвиток пам’яті та уваги, але в дітей із зобом ці показники змінювалися більш повільно.
У дітей з ендемічним зобом достовірно частіше виявлялись психоемоційні розлади у вигляді астенії (54,3 %), інтровертованості, зосередженості на своїх проблемах (45,7%; р<0,05), зниження працездатності (П=16,8±1,6; р<0,05), підвищення рівня стресового стану (С=9,3±1,1; р<0,05). Відзначена більша активність, ініціативність хлопчиків (гетерономність -3,0±0,43; р<0,05) та суперечливість, нестійкість характеру в дівчаток (баланс особистісних властивостей 3,4±0,37; р<0,05). Виявлені розлади, за умов зберігання дефіциту йоду, значно погіршуються з віком (р<0,05).
Установлено наявність тісного зв’язку між показниками тесту Люшера та рівнем ТТГ у дітей. Найбільш показовим виявилося значення стресу під час розвитку зоба (r = 0,51; р<0,05) . Рівень стресу показав негативний вплив на працездатність (r = -0,81), рівень інтелекту (r = -0,42) та інші психологічні показники.
Аналіз отриманих у ході дослідження даних дозволив створити алгоритм прогнозування ризику виникнення ендемічного зобу й вузлової патології ЩЗ для динамічного спостереження та здійснення ефективних профілактичних дій серед цього контингенту дітей.
На основі визначення інформативності для 44 ознак, що виявили вірогідний зв’язок (за тетрахорічним показником із вірогідністю за критерієм ч2 ) із розвитком зобу було отримано 20 позитивних високоінформативних індикаторів наявності зобу або його розвитку у дітей. Найбільш вагомими з них установлені: підвищене психоемоційне навантаження (тетрахорічний показник 0,33), зниження когнітивних функцій (0,31), низька матеріальна забезпеченість сім’ї (0,23), нераціональне харчування (0,21), неповна родина (0,19), незадовільні побутові умови (0,19), часті гострі респіраторні захворювання до 3-х років (0,17), обтяжена спадковість по захворюванням ЩЗ з боку матері (0,11), наявність патології ССС (0,06) та інші. Також отримано 10 негативних високоінформативних ознак, що знижують або компенсують ризик розвитку патології: раціональне харчування (-0,46), добра успішність у школі (-0,32), задовільні когнітивні функції (-0,27), низька захворюваність до 3-х років (-0,24) та інші. Рангування групи індикаторів по убутній дозволило призначити їм прогностично вагомі коефіцієнти (індексні показники), які при підсумовуванні дають оцінку ступеня ризику розвитку зоба у дітей.
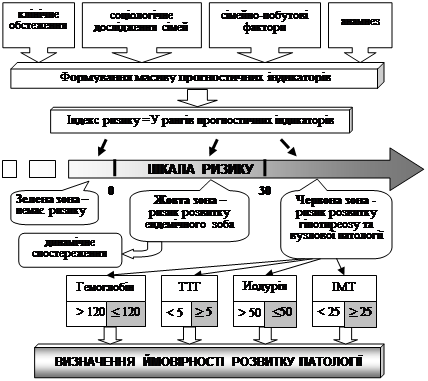
Рис.1. Алгоритм прогнозування йододефіцитної патології щитовидної залози у дітей.
На підставі аналізу значень показників індексу ризику (ІР) для різних груп дітей (із ендемічним зобом, із субклінічним гіпотиреозом, із вузловою патологією та без зобу) розроблено шкалу ризику розвитку зобу й вузлової патології ЩЗ та виділено три інтервали для прогнозування (рис.1.):
- «зелена зона» ІР ≤ 0, немає ризику розвитку йододефіцитної патології ЩЗ;
- «жовта зона» 0 < ІР ≤ 30, є ризик розвитку ендемічного зоба;
- «червона зона» 30 < ІР, є ризик розвитку субклінічного та клінічного гіпотиреозу, вузлової патології ЩЗ.
За результатами кореляційного аналізу та клінічного спостереження до прогностичних маркерів високої імовірності розвитку вузлової патології щитовидної залози було віднесено: рівень ТТГ і гемоглобіну, значення йодурії та індексу маси тіла. Результативність правильного прогнозу становила 77,8%. Найбільша вірогідність розвитку вузлової патології щитовидної залози (98,9 %) встановлена при підвищенні рівня ТТГ ≥ 5 мОД/л та ІМТ ≥ 25 кг/м2 , зниженні рівня гемоглобіну ≤ 120 г/л, йодурії ≤ 50 мкг/л.
Розроблений алгоритм прогнозування розвитку ендемічного зобу та його ускладнень реалізований у комп’ютерній версії регіональної автоматизованої програми медико-соціального моніторингу здоров’я дітей та підлітків з йододефіцитними захворюваннями у відповідному модулі - „Модуль прогнозування”. Дана програма моніторингу має суттєві відмінності від уже існуючих: адаптованість до реальних умов регіону; диференційований підхід до групи дітей із ЙДЗ, урахування впливу йодної ендемії на формування репродуктивного, нервово-психічного та інтелектуального розвитку дітей; створення регіонального банку даних щодо дітей з патологією ЩЗ; можливість використання системи, як інтелектуальної підказки лікарям різних фахів.
ВИСНОВКИ
1. У дисертації наведено теоретичне узагальнення й нове вирішення актуальної задачі сучасної педіатрії - підвищення ефективності лікувально-профілактичних заходів у дітей із йододефіцитними захворюваннями на основі поглибленого вивчення клініко-патогенетичних особливостей ураження органів та систем на різних етапах формування патологічних станів в умовах йодної ендемії та розробки програми прогнозування, діагностики, спостереження та профілактики.
2. Стан йодного забезпечення дітей Луганської області відповідає легкому ступеню йодної недостатності (медіана йодурії 85,8 мкг/л). Інтегрована дія йодного дефіциту та інших зобогенів довкілля призводить до напруженості зобної ендемії в регіоні (частота зобу до 55 %). У структурі захворюваності дітей із йододефіцитними станами перші місця займає патологія серцево-судинної системи (28,4 %), органів травлення (17 %), сечостатевої системи (12,1 %), частіше виявляється залізодефіцитна анемія (35,0 %). У пубертатному віці в 4 % дітей розвиваються порушення обміну речовин у вигляді різних ступенів ожиріння.
3. Дефіцит йоду призводить до напруження функціонального стану гіпофізарно-тиреоїдної системи та високої частоти розвитку синдрому субклінічного гіпотиреозу у дітей шкільного віку (22,9%), що компенсується виникненням гіпертрофічно-гіперпластичних змін у щитовидній залозі та формуванням зобу переважно дифузного характеру (97,4 %). Декомпенсація пристосувальних механізмів у 2,6 % випадків призводить до вузлоутворення, що супроводжується максимальним рівнем гормональної дезадаптації в межах субклінічного гіпотиреозу (р<0,05).
4. Серед дітей із ендемічним зобом спостерігаються процеси ретардації, у той час як у дітей із нормальним йодозабезпеченням зберігається тенденція до акселерації. Вплив йодного дефіциту призводить до порушень фізичного розвитку дітей за рахунок зниження маси тіла (23,8 %), зменшення росту (20,6 %), різкої дисгармонічності розвитку (6,2%); затримки статевого розвитку (16,2 %) та порушень менструальної функції (46,5 %) у дівчаток; уповільнення темпів статевого дозрівання хлопчиків (36,8 %).
5. Зниження рівня тиреоїдного забезпечення у більшості населення в умовах легкого йодного дефіциту призводить до погіршення інтелектуального розвитку у 60,5 % дітей, при найнижчому рівні інтелекту у дітей молодшого шкільного віку із зобом. Розвиток ендемічного зобу також супроводжується розладами когнітивних функцій у вигляді дефіциту уваги (67,1 %) і порушення пам’яті (13,4 %) та змінами психоемоційного стану за рахунок астенії (54,3 %), інтравертованості (52,4 %), зниження працездатності (19,6 %) та підвищення рівня стресового стану (28,3 %).
6. Порушення вегетативної регуляції у дітей із ендемічним зобом виявляються перевагою ваготонічного (60,8 %) варіанту вихідного вегетативного тонусу при недостатній (21,7 %) або надмірній (26,1 %) реактивності симпатичної ланки вегетативної нервової системи.
7. Найбільш інформативними прогностичними медико-соціальними індикаторами розвитку зобу та його ускладнень у дітей є підвищене психоемоційне навантаження (ІП-20), зниження когнітивних функцій (ІП-19), низька матеріальна забезпеченість сім’ї (ІП-18), нераціональне харчування (ІП-17). Вагомими маркерами вузлової патології є підвищення рівня ТТГ ≥ 5 мОД/л та ІМТ ≥ 25 кг/м2 , зниження рівня гемоглобіну ≤ 120 г/л та йодурії ≤ 50 мкг/л.
8. Розроблено прогностичний алгоритм, що дозволяє з високою ймовірностю (76,0 %) прогнозувати виникнення дифузного зобу у дітей та розвиток вузлової патології (77,0 %) за умов декомпенсації наявних структурно-функціональних змін. Алгоритм прогнозування реалізований у створеній автоматизованій програмі “Система підтримки прийняття лікарських рішень для діагностики, лікування та медико-соціального моніторингу дітей та підлітків із йододефіцитними захворюваннями”
практичні рекомендації
1. В умовах йодної ендемії у дітей із порушеннями фізичного, статевого розвитку, психоемоційного стану, зниженням інтелекту та когнітивних функцій, із захворюваннями серцево-судинної системи, шлунково-кишкового тракту, залізодефіцитною анемією рекомендується проводити вивчення структурно-функціонального стану щитовидної залози для попередження виникнення та своєчасної діагностики йододефіцитних захворювань.
9-09-2015, 00:28
