Внесення до середовища інкубації АКТГ викликає вірогідні зміни вмісту каспази-3 в адренокортикоцитах (рис. 4).
Рівень каспази-3 за присутності кортикотропіну знижується як в абсолютних величинах (в 1,7 рази), так і у відсотках по відношенню до контролю (на 40 %). Хелеритрину хлорид (ХХ), який здатний інгібувати активність ПКС, виявляє протилежну дію: вміст каспази-3 збільшується на 22 %. При сумісному додаванні АКТГ і ХХ в більшій мірі спостерігається ефект, характерний для ХХ. Подібна закономірність спостерігається при дослідженні фрагментації ДНК. Під впливом АКТГ спостерігається зниження рівня фрагментації ДНК на 13 %, ці зміни є вірогідними. Тенденція до збільшення фрагментації ДНК спостерігається як при додаванні до середовища інкубації інгібітору ПКС ХХ, так і його комбінації з кортикотропіном. Отримані нами результати свідчать про те, що кортикотропін здійснює антиапоптичний вплив на кору надниркових залоз людини. Виявлені під дією АКТГ антиапоптичні зміни в клітинахнадниркових залоз, оцінювані за вмістом каспази-3 і ступенем фрагментації ДНК.
Наш час відзначається інтенсивними спробами залучити до кола протипухлинних засобів препарати, що діють саме на ланки сигнальних шляхів, залучених до трансформації клітин. Інгібування ПКС, зокрема хелеритрином, може стати допоміжним заходом для посилення апоптичної загибелі клітин під впливом канцеростатичних препаратів або іонізуючої радіації. Крім ПКС-залежного впливу хелеритрину, що може викликати апоптоз, ймовірною є його пряма дія на ДНК. Виходячи з цього, посилення фрагментації ДНК під впливом хелеритрину хлориду може пояснюватись його цитотоксичною дією, високим ступенем спорідненості до ДНК та здатності цього алкалоїда до інтеркаляції [Осип та ін., 2004; Kaminskyyetal., 2005]. Конформація молекул хелеритрину зумовлює його енергетично вигідне розміщення між парами азотистих основ у спіралі ДНК, що призводить до стабілізації спіралі (підвищення температури плавлення) ДНК і, як наслідок, до гальмування процесів реплікації.
Таким чином, можна стверджувати, що вплив кортикотропіну на функцію кори надниркових залоз є значно складнішим, ніж вважалось до цього часу. Ефекти АКТГ здебільшого пов’язані з регуляцією стероїдогенезу в адренокортикальній тканині. Однак отримані нами дані щодо впливу кортикотропіну на зміни рівня каспази-3 та фрагментації ДНК дозволяють віднести його до чинників, що регулюють одночасно апоптичні процеси в адренокортикоцитах.
Зв’язування 125 І-АКТГ та 125 І-ПРЛ в корі надниркових залоз за умов адренокортикальної патології. Відомо, що апоптоз не тільки відіграє важливу роль у елімінації пухлинних клітин, але й посилюється в останніх за дії деяких протипухлинних препаратів. Застосування хлодитану (о,п’ -ДДД, 2-о-хлорфеніл-2-п-хлорфеніл-1,1-дихлоретан) при хворобі та синдромі Іценка-Кушинга та при лікуванні певних випадків злоякісних перетворень у надниркових залозах значно підвищило ефективність терапії цих патологій [Комиссаренко, Резников, 1972; Schteingart, 2007].
![]()
![]()
|
|
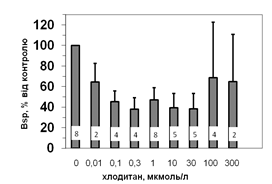
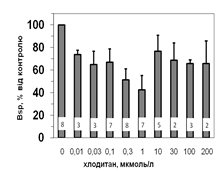
Рис. 5. Вплив хлодитану на специфічне зв’язування 125 І-АКТГ (А) та 125 І-ПРЛ (Б) мікросомами адренокортикоцитів людини.
Вплив хлодитану є вірогідним, p<0,001; критерій Фішера.
Кількість спостережень вказано всередині стовпчиків.
Вивчення відхилень гормональної рецепції в корі надниркових залоз під впливом хлодитану в певній мірі заповнює прогалину в розумінні механізму його дії, розвитку резистентності до нього та може стати підґрунтям для використання більш ефективної схеми лікування хвороби Іценка-Кушинга. Зважаючи на практично повну відсутність аналізу як рецепторної ланки в патогенезі захворювань надниркових залоз, так і зміни рецепції тропних гормонів гіпофіза при адренокортикальних патологіях та за умов їх терапії, ми провели дослідження впливу хлодитану на зміни рецепції 125 І-АКТГ та 125 І-ПРЛ. Для вивчення дії хлодитану на зв’язування 125 І-АКТГ та 125 І-ПРЛ використані мікросомні фракції клітин кори надниркових залоз пацієнтів з різними діагнозами: хвороба Іценка-Кушинга на різних стадіях, кортикостерома, альдостерома. Розглянувши наявний матеріал ми не помітили істотних відмін між ними в характері впливу хлодитану в залежності від типу патології. Тому всі дані охарактеризовано як одна вибірка.
Для вивчення зв’язування використано АКТГ, мічений за Tyr23, а Tyr2, який бере участь у формуванні центру, відповідального за гормон-рецепторну взаємодію, залишається нейодованим. Такий ліганд повністю зберігає біологічну активність, зокрема, здатність взаємодіяти з рецепторами та активувати стероїдогенез.
Параметри зв’язування 125 І-ПРЛ в мікросомній фракції кори надниркових залоз людини свідчать про наявність тільки одного типу сайту зв’язування ПРЛ, який за своїми характеристиками є типовим представником рецепторів високої афінності та низької ємності: Bmax =1,2±0,08 х 10-10 М; Ka =0,14±0,02 х 109 М-1 . Оцінка параметрів зв’язування 125 І-ПРЛ ізольованими адренокортикальними клітинами свідчить, що афінність рецепторів у цьому випадку є подібною до мембран мікросом. Цей факт може бути додатковим свідченням того, що диспергування і очищення адренокортикоцитів істотно не впливає на нативність клітин та їх здатність до відтворення нормальних фізіологічних процесів. Більш низьку абсолютну зв’язувальну ємність плазматичних мембран адренокортикоцитів порівняно до мембран мікросом можна пояснити тим, що на поверхні клітини є доступною лише незначна частка тих рецепторів, які містять мікросоми. Специфічне зв’язування (Bsp ) як 125 І-АКТГ, так і 125 І-ПРЛ знижується у мікросомах кори надниркових залоз людини за присутності хлодитану (рис. 5).
Зв’язування починає зменшуватись, починаючи з концентрації 0,01 мкмоль/л, та сягає мінімуму за присутності 0,3 мкмоль/л хлодитану (рецепція 125 І-ПРЛ) або 1,0 мкмоль/л хлодитану (рецепція 125 І-АКТГ). Подальше збільшення концентрації хлодитану нівелювало його інгібувальний ефект на зв’язування досліджуваних лігандів (рис. 5). Факт встановлення залежності зниження специфічного зв’язування 125 І-АКТГ та 125 І-ПРЛ від концентрації хлодитану у мікросомній фракції адренокортикоцитів може стати підставою для пошуків способів подолання резистентності деяких типів пухлин до цього препарату та збільшення ефективності його використання.
Шляхи внутрішньоклітинного перенесення регуляторних сигналів естрадіолу в корі надниркових залоз
Продукція cAMP та cGMP, активність ПКА та ПКС в корі надниркових залоз людини під впливом естрадіолу. Дослідження молекулярних механізмів дії естрогенів призвело до появи нових теорій, більш чітко окреслило етапи реалізації ефектів стероїдних гормонів. До останнього часу вплив естрогенів на клітини-мішені пов’язували виключно з геномними ефектами, що не потребують залучення вторинних посередників для внутрішньоклітинного перенесення регуляторних сигналів. Зараз розглядається участь в цих процесах декількох месенджерних систем, серед яких важливе місце відводять cAMP-залежному каскаду.
При визначенні вмісту сумарних 11-ОКС у середовищі інкубації ми показали дозозалежне збільшення продукції стероїдів зрізами кори надниркових залоз людини під впливом естрадіолу. Максимальний рівень синтезу кортикостероїдних гормонів спостерігається через 4 год інкубації при концентрації естрадіолу 100 мкМ і становить 6212 ± 841 нмоль/л у порівнянні з 2363 ± 271 нмоль/л у контрольних пробах (р < 0,01; n=10; критерій Фішера). Наші дослідження показали, що культивування адренокортикальних клітин новонарождених поросят в середовищі з 17b-естрадіолом також призводить до суттєвого збільшення продукції 11-ОКС.
Утворення cAMP тканиною кори надниркових залоз людини вірогідно збільшується через 3 год інкубації.
Ці зміни стають ще істотнішими через 4 год інкубації, коли спостерігається 7-разове збільшення продукції cAMP. Рівень cGMP не змінювався ні за умов використання різних концентрацій естрадіолу, ні за умов різних термінів інкубації.
Дослідження впливу естрадіолу на активність ПКА та ПКС в субклітинних фракціях кори надниркових залоз людини дозволило продемонструвати, що інкубація з естрадіолом-17β протягом 4 год у концентрації 10 мкМ не призводить до активації ПКА ні в мембранній, ні в цитозольній фракціях (табл. 3). При збільшенні концентрації до 100 мкМ протеїнкіназна активність у мікросомній фракції зростає більш ніж на 50 % порівняно з контролем. Визначення активності ПКС в мікросомній фракції показало, що естрадіол активує цю кіназу. Активність ПКС збільшується на 50 % у мікросомній фракції зрізів кори надниркових залоз за умов дії естрадіолу (100 мкМ) (табл. 3).
Таблиця 3
Вплив 17b-естрадіолу invitroна активність ПКА і ПКС (нмоль субстрату х хв-1 х мг-1 білка) у субклітинних фракціях зрізів умовно нормальної тканини кори надниркових залоз людини
| Фермент | Цитозольна фракція | Мікросомна фракція | |||||
| Е2, мкМ | Е2, мкМ | ||||||
| Контроль | 10 | 100 | Контроль | 10 | 100 | ||
| ПКА | 6,81 ± 1,24 | 7,62 ± 0,87 | 9,11 ± 2,10 | 11,78±1,55 | 14,80 ± 1,53 | 17,87 ± 1,31* | |
| ПКС | 8,64 ± 1,77 | 8,04 ± 0,18 | 11,18 ± 0,73 | 9,90 ± 0,68 | 11,68 ± 1,07 | 15,10 ± 1,31* | |
Примітка. * – різниця з контролем є вірогідною, р < 0,05; критерій Стьюдента; n = 5.
Продемонстровані шляхи пострецепторної передачі регуляторних сигналів естрадіолу за умовах in vitro на первинній культурі клітин надниркових залоз поросят і зрізах кори надниркових залоз людини залишають відкритим питання щодо тотожності цих шляхів на рівні цілісного організму. Відомо, що природні та синтетичні естрогени активно використовуються для лікування раку простати у чоловіків [Tammela, 2004], тому дослідження ефектів естрадіолу на інтактних та кастрованих експериментальних тваринах можуть дозволити певну екстраполяцію на зміни функції надниркових залоз у людини.
Після 3 днів введення естрадіолу спостерігалось істотне зростання рівня сумарних 11-ОКС у плазмі крові як інтактних, так і орхіектомованих щурів (табл. 4). Показано, що введення 50 мкг естрадіолу інтактним тваринам призводить до збільшення рівня кортикостероїдів у 1,5 рази порівняно з інтактними тваринами, що отримували ін’єкції олії. При введенні 100 мкг естрадіолу цей показник зростає більш ніж у 2 рази. Подібний ефект естрадіолу спостерігався і у кастрованих тварин. У контрольних орхіектомованих щурів рівень 11-ОКС був нижчим, ніж у інтактних (яким вводили сливову олію). Збільшення концентрації кортикостероїдних гормонів під впливом естрадіолу було подібним в обох експериментальних групах. Виходячи з цих даних можна стверджувати, що рівень тестостерону в організмі не має помітного впливу на зміни функції адренокортикальних клітин під впливом естрадіолу. Ні орхіектомія, ні замісне введення тестостерону щурам не призводили до змін концентрації вільного холестерину або його ефірів, які є попередниками синтезу кортикостероїдів [Dudaetal., 1985].
Таблиця 4
Вплив естрадіолу бензоату (Е2) invivo на вміст сумарних 11-гідроксикортикостероїдів у плазмі крові самців щурів (нмоль/л)
| Групи тварин | Е2, мкг | ||
| Контроль | 50 | 100 | |
| Інтактні | 1132 ± 140 n = 14 |
1756 ± 171* n = 16 |
2351 ± 230** n = 17 |
| Орхіектомовані | 781 ± 55+ n = 9 |
1235 ± 96*, + n = 8 |
1848 ± 190** n = 8 |
Примітки:
*, ** – різниця з контролем є вірогідною, відповідно р < 0,05 і р < 0,01;
+ – різниця між інтактними і орхіектомованими тваринами є вірогідною, р < 0,05; критерій Стьюдента.
Оскільки найважливішими етапами переносу сигналу основного регулятора функції кори надниркових залоз – АКТГ є активація аденілатциклази та cAMP-залежної протеїнкінази А, ми досліджували вплив естрадіолу in vivo на активність ПКA у субклітинних фракціях кори надниркових залоз. Відомо, що ПКА відіграє суттєву роль у найважливіших етапах стероїдогенезу: відщепленні бокового ланцюга холестерину цитохромом Р450scc , активації білка StAR, транспорті вільного холестерину до внутрішнього шару мембрани мітохондрій [Gallo-Payet et al., 2003; Richards, 2001]. Визначення активності ПКА в субклітинних фракціях показало, що триденне введення естрадіолу призводить до істотного зростання активності ПКА як у цитозольній, так і у мікросомній фракціях кори надниркових залоз інтактних та орхіектомованих щурів (табл. 5). Вірогідність змін була вищою у мікросомній фракції. Ми визначали також активність ПКС, яка може брати участь в опосередкуванні регуляторних сигналів естрогенів (табл. 5). Активність ПКС вірогідно збільшується як в цитозольній фракції адренокортикоцитів, так і, ще в більшому ступені, в мікросомній фракції надниркових залоз інтактних і орхіектомованих щурів, що отримували естрадіол.
Таблиця 5
Вплив естрадіолу бензоату (Е2) invivo на активність протеїнкіназ А та С у субклітинних фракціях кори надниркових залоз самців щурів (нмоль субстрату х хв-1 х мг-1 білка)
Групи тварин |
Цитозольна фракція | Мікросомальна фракція | ||||
| Е2, мкг | Е2, мкг | |||||
| Контроль | 50 | 100 | Контроль | 50 | 100 | |
| Протеїнкіназа А | ||||||
Інтактні n = 6 |
3,96 ± 0,81 | 5,23 ± 0,83 | 8,41 ± 1,71* | 8,42 ± 0,85 | 9,79 ± 1,41 | 16,62 ± 0,48** |
Орхіекто-мовані n = 4 |
6,10 ± 1,31 | 6,93 ± 1,36 | 11,14 ± 1,21* | 11,02 ± 0,31+ | 13,10± 0,43+ | 18,20 ± 0,77** |
| Протеїнкіназа С | ||||||
Інтактні n = 6 |
6,65 ± 0,81 | 8,90 ± 0,85 | 10,30 ± 1,90* | 5,76 ± 0,75 | 9,56 ± 1,05 | 10,07 ± 1,24** |
Орхіекто-мовані n = 4 |
3,08 ± 0,40+ | 6,16 ± 0,49+ | 8,65 ± 0,41** | 6,86 ± 0,29 | 10,91 ± 0,20 | 13,84 ± 0,31**,+ |
Примітки:
*, ** – різниця з контролем є вірогідною, відповідно р < 0,05 і р < 0,01; критерій Фішера; + – різниця між інтактними і орхіектомованими тваринами є вірогідною, р < 0,05; критерій Стьюдента.
Естрадіол підвищує активність ПКС в мікросомній фракції кори надниркових залоз у 1,7 рази в групі інтактних тварин та у 2,0 рази в групі орхіектомованих тварин. Зміни рівня кортикостероїдів і активності ПКА та ПКС під впливом естрадіолу бензоату є подібними у інтактних та кастрованих самців щурів, що дозволяє зробити висновок: видалення сім’яників не впливає на відповідь надниркових залоз на естрогени. Таким чином, отримані дані дозволяють вважати, що збільшення синтезу кортикостероїдів та активація ПКА і ПКС у субклітинних фракціях адренокортикоцитів інтактних та орхіектомованих щурів внаслідок дії естрадіолу свідчить про причетність естрогенів до регуляції функції кори надниркових залоз і про залучення протеїнкіназ до перенесення регуляторного сигналу естрадіолу в адренокортикальних клітинах.
Отже, естрадіол in vitro та in vivo посилює продукцію кортикостероїдних гормонів в корі надниркових залоз і збільшує рівень cAMP, який, в свою чергу, є активатором cAMP-залежної ПКА. У субклітинних фракціях клітин збільшується активність ПКА і ПКС, що свідчить про участь цих ферментів в реалізації ефектів естрогенів в корі надниркових залоз. Узагальнюючи наші результати і дані інших дослідників [Aronica et al., 1994; Seval et al., 2006] можна висловити припущення, що регуляція стероїдогенезу естрогенами в корі надниркових залоз зумовлена здебільшого cAMP-залежною системою. Ймовірною є також участь систем, до яких залучена ПКС. Отримані дані дозволяють розширити розуміння сукупності негеномних механізмів, за якими естрогени здатні чинити контроль метаболічних процесів в адренокортикальній тканині.
Участь сигнального каскаду, пов’язаного з протеїнкіназами, що активуються мітогенами, в опосередкуванні сигналу естрадіолу. В опосередкуванні впливу естрогенів на клітини-мішені зараз розглядається участь декількох сигнальних систем, серед яких важливе місце відводять крім протеїнкіназ А і С, месенджерним системам, що використовують як вторинні посередники протеїнкінази, що активуються мітогенами. Каскад MAPK/ERK є одним з провідних шляхів сигнальної трансдукції естрогенів, що залучається до реалізації широкого спектру ефектів, спрямованих на проліферацію клітин-мішеней. Показано, що активована естрогенами форма ERK1/2 здатна до транслокації в ядро і прямої взаємодії з ядерними транскрипційними факторами [Edwards, 2005; Lee, McEwen, 2001].
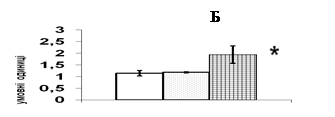
В корі надниркових залоз щурів естрадіол бензоат чинить найбільш виразний вплив на рівень ERK1/2 кінази (рис. 7). За результатом Вестерн-блот аналізу, введення 50 мкг естрадіолу не призводить до змін вмісту ERK1/2 в адренокортикальній тканині порівняно із контрольними тваринами, що отримували ін’єкції олії. Після тридобового введення естрадіолу в дозі 100 мкг цей показник вірогідно зростає в 1,7 рази(рис. 7). Збільшення вмісту JNK кінази спостерігається в адренокортикальній тканині при введенні 100 мкг естрадіолу бензоату. Рівень р38 МАР-кінази при введенні естрадіолу в обох дозах залишається без змін.
В інших типах клітин, зокрема раку молочної залози MCF-7, фосфорилювання р38 кінази і, особливо, ERK1/2 збільшується під впливом 17β-естрадіолу в клітинах [Gutzmanetal., 2005].
Потрібно зазначити, що стимульована естрогенами транскрипція полягає в активації експресії низки генів, серед яких протоонкогени c-jun та c-fos [Albanitoetal., 2007]. Продукти активації цих генів, білки с-jun і c-fos, утворюючи гомодимерні та гетеродимерні комплекси, входять до складу фактора транскрипції АР-1, який є надзвичайно важливим елементом трансдукції сигналу в ядрі. Ми визначали в адренокортикоцитах щурів рівень білкових факторів транскрипції с-jun та c-fos, які можуть брати участь в опосередкуванні регуляторних сигналів естрогенів в корі надниркових залоз (рис. 7). Максимальний рівень с-fos спостерігається при введенні 100 мкг естрадіолу. В цих умовах рівень білка с-jun в корі надниркових залоз практично не змінюється.
Встановлено, що c-jun та c-fos не єдині ранні протоонкогени|, експресія яких стимулюється естрогенами. 17β-εстрадіол також істотно|суттєво| збільшує рівень експресії мРНК|посилює| протоонкогена|c-myc в ембріональних стовбурових клітинах [Hanetal., 2006].
Таким чином, можна зробити висновок, що до перенесення регуляторного сигналу естрадіолу в клітинах кори надниркових залоз можуть бути залучені МАРК ERK1/2 та фактор транскрипції c-fos, який активується цією кіназою.
 |
||
|
||

 |

![]()
![]()
Рис. 7. Вплив естрадіолу бензоату (Е2) in vivo на вміст ERK1/2 та c-fos у корі надниркових залоз щурів.
Репрезентативні результати імуноблот-аналізу одного з 3-х дослідів (А) та усереднені дані (Б). 1 – контроль, 2 – Е2 50 мкг/тварину, 3 – Е2 100 мкг/тварину. Різниця з контролем є вірогідною, * – p < 0,05; непараметричний U-критерій Вілкоксона-Манна-Уїтні, критерій Стьюдента.
Дослідження впливу NAE на стероїдогенез в корі надниркових залоз. участь систем вторинних посередників перенесення регуляторних сигналів nae в адренокортикоцитах
Зміна біосинтезу кортикостероїдів під впливом NAE та дофаміну.
N-ацилетаноламіни завдяки ліпотропним властивостям добре поглинаються збагаченими на ліпіди тканинами, зокрема адренокортикальною. Розподіл введеного щурам міченого N-пальмітоїлетаноламіну свідчить про переважне його включення саме до надниркових залоз [Жуков та ін., 2000]. Оскільки стероїдогенез є основною функцією цієї залози, NAE можуть відігравати важливу роль в синтезі кортикостероїдних гормонів. Відповідь кори надниркових залоз на введення NAE в організм може бути пов’язана із зміною функції гіпофізу і вищих регуляторних центрів. Тому дослідження кортикостероїдогенезу було проведено на зрізах надниркових
8-09-2015, 19:29
