Ця функція пробіотиків в наш час визиває досить великий інтерес і активно досліджується, проводиться пошук штамів із найбільш вираженими імуногенними властивостями. В літературі можна зустріти судження про пробіотики – молочнокислі бактерії як пероральні вакцини, альтернативних подібним препаратам із аттенуйованих мікрорганізмів. Молочнокислі бактерії розглядаються як живі носії імуногенів і захисних антигеннів, а розробка ефективних імунних препаратів із пробіотиків являється одним із самих пріоритетних напрямків сучасної вакцинології. В той же час відомо успішне використання при імунодефіцитах пероральних та ректальних препаратів із пробіотиків – представників кокових мікрорганізмів Lactococcus, Enterococcus, Micrococcus, Streptococcus – у високих концентраціях.
Таким чином, приведені дані свідчать про те, що використання живих культур мікроорганізмів – представників нормальної мікрофлори в складі пробіотичних препаратів для лікування і профілактики дисбактеріозів різноманітної етіології являються новим і перспективним направленням у медицині. Ці дослідження потребують продовження в плані більш глибшого вивчення механізмів взаємовідносин мікро- та макроорганізма.
1.3.2 Застосування у ветеринарній практиці
Використання пробіотиків, як лікарських засобів досить поширене у ветеринарній практиці. Аналізуючи дані літератури бачимо, що для здоров'я тварин дуже важливим є наявність балансу між нормальною і потенційно патогенною мікрофлорою кишечника. Будь-яка зміна в цій рівновазі супроводжується функціональними порушеннями, які призводять до зниження продуктивності тварин.
В наш час більшість авторів доводить, що важливою умовою виникнення сальмонельозів, колібактеріозів, клостідіозів і інших кишкових інфекцій являється дія провокуючих факторів аліментарної природи: різке переведення молодняку на концентрований тип годування, взаємодія комплексу стрес-факторів. До останніх відноситься неправильне транспортування тварин, зміна кліматичних умов, застосування у великих дозах лікарських препаратів, особливо антибіотиків. У молодняку всіх видів тварин неонатальний період характеризується домінуванням кишкових хвороб. Це пов'язано в першу чергу з тим, що отриманий від матері після народження тварин імунітет згасає, а стабільність набутого залежить виключно від складу нормальної мікрофлори в кишечнику. Тому у вказаний період необхідно стабілізувати баланс за рахунок застосування пробіотиків. Пробіотики стимулююють процеси харчування завдяки нормалізації мікрофлори, яка в свою чергу слугує джерелом адьювантно-активних речовин, останні, попадаючи в кров, надають стимулюючий вплив на імунокомпетентну систему організму тварини [61].
Вченими встановлено, що використання пробіотиків, які містять живі культури B.subtilis, B.licheniformis, L.fermentum, L.salivarius, Str.bovis, Megasphaera elsdenii, Selenomonas ruminantium і ін., стимулює біосинтетичні процеси в травному тракті і сприяє збільшенню продуктивності тварин [62,63].
Найбільш перспективними вважають пробіотики створенні на основі мікроорганізмів, які відносяться до родів Bacillus, Lactobacillus, Propionibacterium, а серед них – ті види, котрі являються складовою частиною мікробіоценозів рубця жуйних тварин, зобу птахів, ШКТ поросят і ін. Відповідно аналізу даних літератури, проведеного Миршуновою і Киржаєвим [61], в більшості країн світу застосовують пробіотичні препарати для тварин, основані на монокультурах. В той же час, по даним інших авторів, ветеринарні спеціалісти, які використовують пробіотики для профілактики і лікування різних захворювань, віддають перевагу комплексним біопрепаратам, мікробним компонентом яких являється сполучення декількох видів мікрорганізмів (стрептококи, лактобацили, бактероїди, біфідобактерії і ін.). Такі пробіотики, як стверджують автори, сприяють збереженню голів великої рогатої худоби, овець, свиней, птиць. Звертаючись до зарубіжних даних, автори стверджують, що пробіотики, які використовують для підвищення продуктивності тварин, приймають в мінімально ефективній дозі (10-10 КУО в 1 г корму). При цьому їх вводять кожен день напротязі 1-2 місяців до досягнення результату. Для пробіотика важлива його постійна присутність в порожнині кишечника в значних кількостях, щоб отримати ефект при варіаціях, пов'язаних із годуванням і умовами утримання.
Приводимо перелік пробіотиків, які найбільш часто застосовуються для сільськогосподарських тварин [64]. У Франції запропонований препарат до складу якого антибіотикостійкі штами молочнокислих бактерій - L.acidophilus, L.bulgаricus, Lactococcus lactis. Крім того, в цій країні використовують препарат ліо-біфідус і біфідаген, в Австрії – сугалон, в Німеччині – омніфлора, які представляють собою суміш чистих ліофілізованих культур біфідобактерій, ацидофільної і кишкової паличок. В Угорщині для боротьби із дизентерією застосовують лактомікс, який складається із суміші ентерококів і лактобацил. У Швеції розроблені і користуються великою популярністю серед ветеринарів пробіотики фірми “Medifarm”, основою яких являються також ентерококи і лактобацили, - лактиферм, лакктомікс, пробіоз, пигфегс, лако, ферлак, галако, овікарб, бовіферм і ін [65]. В Росії в практику сільського господарства впроваджено ряд біопрепаратів на основі бактерій-симбіонтів ШКТ, такий як лактовіт, що містить молочнокислі бактерії і вітамін В![]() . З ціллю профілактики шлунково-кишкових захворювань молодняку сільськогосподарських тварин застосовують препарату СБА (L.lactis, L.acidophilus, B.bіfidum), пропацид АВК (L.acidophilus). В США для профілактики діарей молодняку в ранньому віці застосовують ацидофільно-дріжджове молоко (L.acidophilus + S.cerevisiae). В Інституті мікробіології і вірусології НАН України створено три пробіотичних препарати на основі лактобацил і ентерококів – Бовілакт, Лактосан, Лакктин-К для сільськогосподарських тварин [66].
. З ціллю профілактики шлунково-кишкових захворювань молодняку сільськогосподарських тварин застосовують препарату СБА (L.lactis, L.acidophilus, B.bіfidum), пропацид АВК (L.acidophilus). В США для профілактики діарей молодняку в ранньому віці застосовують ацидофільно-дріжджове молоко (L.acidophilus + S.cerevisiae). В Інституті мікробіології і вірусології НАН України створено три пробіотичних препарати на основі лактобацил і ентерококів – Бовілакт, Лактосан, Лакктин-К для сільськогосподарських тварин [66].
Штами спороутворюючих молочнокислих бактерій застосовують в Південній Кореї в якості стимуляторів росту курчат. Широке розповсюдження у ветеринарній практиці знайшли пробіотики із бацил. Відомий пробіотичний препарат на основі живих клітин B.subtilis і B.licheniformis – бактерин SL, розроблений в Інституті мікробіології і вірусології НАН України. Препарат широко впроваджений у ветеринарну практику і являється високоефективною терапевтичною речовиною при профілактиці і лікуванні діарей телят в післяпологовому періоді. В ІМВ НАНУ розроблений також новий пробіотик ендоспорин, призначений для лікування і профілактики післяпологових захворювань сільськогосподарських тварин. За своєю ефективністю немає аналогів в практиці ветеринарної медицини [52].
Представників роду Bacillus використовують для профілактики і терапії стафілококової, сальмонельозної, колібактеріозної і синєгнойної інфекцій (препарат Qiangsite). Новий бацилярний пробіотик “Biomate 2B Plus”, який складається із B.subtilis і B.licheniformis розроблений для поросят. Його застосування покращує засвоєння їжі, збільшує вагу, позитивно впливає на всі показники стану здоров'я тварин.
Введення бацил у склад комплексних препаратів і спеціальних кормових сумішей, призначених для профілактики сальмонельоза у домашніх птиць, показало їх високу ефективність в пробіотиках “Primalas” і “Protexin”. Також відомий препарат БСП, створений Українським інститутом сільськогосподарської мікробіології (м.Чернігів). Уробактерин (Казахстан) містить уробактерії, які стимулюють продукцію вітаміну В![]() в організмі тварин. “Бовітокс” (Інститут ветеринарної медицини, Київ) – комплексний пробіотик, котрий містить непатогенні штами роду Bacillus і мікробні культури заквасок кисломолочних продуктів. Володіє загально-стимулюючою дією, викликаючи в організмі новонароджених телят індукцію інтерферона [52].
в організмі тварин. “Бовітокс” (Інститут ветеринарної медицини, Київ) – комплексний пробіотик, котрий містить непатогенні штами роду Bacillus і мікробні культури заквасок кисломолочних продуктів. Володіє загально-стимулюючою дією, викликаючи в організмі новонароджених телят індукцію інтерферона [52].
Отже, виходячи із висновку спеціалістів ветеринарної медицини, пробіотики являються ефективними лікувально-профілактичними і ростостимулюючими препаратами. Їх застосовують для нормалізації мікрофлори екологічних систем організму тварин, особливо в умовах, промислового ведення тваринництва, птахівництва, свинарництва. Це екологічно чисті препарати, вони фізіологічні і безпечні за своєю дією для тварин [64].
Потреба у пробіотиках досить висока. Враховуючи несприятливу екологічну ситуацію в Україні, а також рівень загальної захворюваності понад 72 – 86 % населення України, особливо дітей, повинні не менше як двічі на рік проводити курс пробіотикотерапії чи пробіотикопрофілактику.
На сьогодні пробіотичні препарати в Україні виробляють досить мало підприємств. Серед них Одеське підприємство з виробництва імунобіологічних препаратів, Київське підприємство з виробництва бактерійних препаратів “Біофарма”, Харківське орендне підприємство “Біолік”. Це такі препарати, як біфідобактерин, лактобактерин, біфікол. На превеликий жаль технологія виготовлення флаконних лікарських форм пробіотиків, що використовується українськими виробниками, настільки несучасна, що говорити про забезпечення населення України вітчизняними пробіотиками нині неможливо. Підходи до технології виробництва, що існують в Україні (відсутність порошкоподібних форм) не дозволяють вирішити питання повноцінного широкого профілактичного застосування пробіотиків на цивілізованому рівні.
Винятком є деякі молокозаводи, що виробляють кисломолочні суміші з включенням біфідобактерій. Слід розробляти препарати пробіотиків, збагачені компонентами, які сприяють кращій проліферації і адсорбції біфідо- і лактобактерій (лактулоза, вітаміни, харчові і синтетичні волокна). Необхідно розширювати спектр кисломолочних харчових продуктів.
Отже, в сучасний період застосування пробіотиків та пребіотиків, в звязку із встановленням позитивної дії останніх на організм людини, набуває все більшого поширення. Значно збільшується кількість пробіотичних препаратів, розширюється спектр їх використання. Часто, однак, активність пробіотиків в експерименті та клінічних умовах не співпадають, що потребує подальшого збагачення знань відносно способу дії окремих препаратів, проведення коректних досліджень з метою визначення показів для застосування пробіотичних препаратів.
Розділ 2. Матеріали та методи досліджень
2.1 Матеріали досліджень
Обєктом дослідження являлись:
- виробничі штами: E.coli M17 (препарат “Колибактерин”) та B.cereus IP 5832 (“Бактисубтил”).
Препарат “Колибактерин сухой” (Colibacterinum siccum) представляє собою ліофілізовану мікробну масу живих кишкових паличок - штам E.coli М17, виготовлений Київським підприємством з виробництва бактерійних препаратів “Біофарма”. Випускається у флаконах. Одна доза містить 1*10![]() МК.
МК.
“Бактисубтил” (Bactisubtil) – кожна капсула препарату містить 1млрд. спор бактерій культури B.cereus IP 5832. Фірма-виробник Hoechst Marion Roussel.
- колекція свіжевиділених та музейних тест-культур (включаючи набір тест-штамів, які використовуються при контролі антагоністичної активності пробіотиків: Shigella sonnei 2802, 5063 Shigella flexneri 337, 170; Escherichia coli 157; Proteus vulgaris 177; Proteus mirabilis 24а, 249; Staphylococcus aureus 209): 24 клінічних штами роду Shigella (збудники дизентерій); 26 клінічних штамів – представників патогенної та умовно патогенної мікрофлори людини (родів Escherichia, Staphylococcus, Klebsiella, Pseudomonas, Enterobacter, Proteus); 4 колекційні штами (Staphylococcus epidermidis) та 11 музейних штамів, які були люб`язно надані нам для проведення досліджень Київським науково-дослідним інститутом епідеміології та інфекційних хвороб ім.Л.В. Громашевського (КНДІЕІХ), за що висловлюємо вдячність.
2.2 Методи дослідження культурально-біохімічних властивостей штамів
Дослідження культуральних і ферментативних властивостей штамів продуцентів проводили загальноприйнятими методами, використовуючи диференціально-діагностичні середовища (середовище Ендо, Левіна, Плоскірева, Сабуро, КА,Цейсслера).
2.3 Метод визначення антагоністичної активності мікроорганізмів
Для оцінки явища мікробного антагонізму окремих компонентів та композицій пробіотичних продуктів, а також офіціальних препаратів-пробіотиків в умовах in vitro використовували відповідні методики [68]. Антагоністичну активність визначали по відношенню до патогенних та УПМ з колекції живих культур лабораторії загальної мікробіології КНДІЕІХ і до клінічних ізолятів, виділених із обстежених осіб, використовуючи метод відстроченого антагонізму.
Тест-культури
З метою оцінки антагоністичної активності виробничого штаму використовують тест-культури, які повинні знаходитись в S-формі клітинного циклу, володіти типовими морфологічними, серологічними, біохімічними властивостями і вірулентністю, яка визначається для мікробів кишкової групи величиною LD50 при внутрішньочеревному заражені білих мишей; для шигелл Флекснера повинна бути не більше 250 млн МК при зараженні суспензії живих мікроорганізмів в 0.9% розчині хлориду натрію або не більше 20 млн МК при зараженні в 0.4% голодному агарі; для S. sonnei - не більше 50 млн МК при зараженні в 0.9% розчині хлориду натрію; для штамів Proteus - не більше 350 млн МК в 0.9% розчині хлориду натрію і 30-50 млн МК в 0.4% голодному агарі.
Тест-культури шигелл Флекснера і Зонне повинні давати позитивну кератоконюктивну пробу у морських свинок.
Тест-культури стафілококу повинні володіти наступними властивостями: утворювати зону гемолізу розміром (3-5) мм через (19±1) годин росту на МПА з 0.5% крові (людини, барана, кроля), розлитому в чашки Петрі шаром (2-3) мм; коагулювати плазму крові кроля на протязі (2±1) годин; викликати некроз при підшкірному введенні 200 млн МК добової культури в 0.2 см3 0.9% розчину хлориду натрію кролям вагою (1.5±0.2) кг на протязі 48-72 годин.
Антагоністичну активність штамів перевіряли до таких музейних штамів як S.flexneri, S.sonnei, ентеропатогенних E. coli, S.aureus, Proteus vulgaris i Proteus mirabilis (стандартних тест-штамів, які використовуються для контролю антагоністичної активності пробіотиків) та клінічних ізолятів. Стандартні тест-штами ідентифіковані по тестам сучасної класифікації, мають певні властивості, які визначають їх видову характеристику.
Виробничі штами повинні володіти високою антагоністичною активністю по відношенню до всіх вказаних тест-культур. Зони відсутності росту тест-культур повинні бути не менше 10 мм.
Музейні культури мікроорганізмів перед використанням активізували із ліофілізованого стану перенесенням в середовище м`ясо-пептонного бульйону (3-5 мл на одну ампулу), інкубували при 37ºС 1-3 доби та після одержання густої суспензії мікробних клітин переводили на агаризоване середовище (МПА).
Для визначення антагонізму виробничих штамів використовували метод препендикулярних штрихів на твердому поживному середовищі, сутність якого полягала в наступному: на підсушені чашки Петрі із середовищем МПА по діаметру петлею діаметром (3,5![]() 0,5)мм висівали штрихом суспензію двохдобової культури пробіотичних мікроорганізмів в концентрації 1 млрд МК в 1мл ізотонічного розчину NaCl. Посіви інкубували в термостаті при (37
0,5)мм висівали штрихом суспензію двохдобової культури пробіотичних мікроорганізмів в концентрації 1 млрд МК в 1мл ізотонічного розчину NaCl. Посіви інкубували в термостаті при (37![]() 1)ºС. Через 2 доби перпендикулярним штрихом до отриманої полоси росту відступив на 1-2мм підсіювали суспензію однодобових культур тест-штамів мікроорганізмів в концентрації 10
1)ºС. Через 2 доби перпендикулярним штрихом до отриманої полоси росту відступив на 1-2мм підсіювали суспензію однодобових культур тест-штамів мікроорганізмів в концентрації 10![]() МК в 1 мл. Досліди проводили в 3-х повторюваннях. Результати враховували через 18год інкубування за величиною зон пригнічення росту тест-штамів (вимірюючи ці зони лінійкою: від дослідженої культури до початку росту тест-культури в мм). Контролем росту тест-культур слугував їх паралельний посів штрихом на чашки із тим же середовищем (МПА) без досліджуваної культури. Позитивним вважали результат при відстані затримки росту тест-штаму більший за 7 мм.
МК в 1 мл. Досліди проводили в 3-х повторюваннях. Результати враховували через 18год інкубування за величиною зон пригнічення росту тест-штамів (вимірюючи ці зони лінійкою: від дослідженої культури до початку росту тест-культури в мм). Контролем росту тест-культур слугував їх паралельний посів штрихом на чашки із тим же середовищем (МПА) без досліджуваної культури. Позитивним вважали результат при відстані затримки росту тест-штаму більший за 7 мм.
В кожному випадку розраховували для кожного тест-штаму середнє арифметичне значення затримки росту та його похибку (М![]() m).
m).
2.4 Методи математичної обробки результатів досліджень
Для обробки експериментальних матеріалів, отриманих при проведені досліджень, застосовують методи математичної статистики. За допомогою математичної статистики можна оцінити відтворюваність аналізу; встановити величину випадкових похибок; виключити результати, які містять промахи; встановити правильність отриманого результату; оцінити надійність результатів досліджень [67].
Важливою характеристикою випадкових величин є середньоарифметичне значення випадкової величини і її дисперсія.
Середньоарифметичне значення випадкової величини дорівнює сумі результатів всіх визначень, розділеній на їх кількість. Якщо х1, х2, х3,..., хі,..., хn означають n результатів визначень будь-якої величини, отже середньоарифметичне з n результатів буде:
![]() (2.4.1)
(2.4.1)
З теорії похибок, середньоарифметичне є найбільш вірогідним і найкращим значенням величини, яка визначається.
Дисперсія показує яким чином групуються всі отримані результати аналізу навколо середньоарифметичного, тобто характеризує ступінь розкиду ![]() навкол
навкол![]() .
.
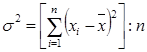 (2.4.2)
(2.4.2)
Середньоквадратична похибка окремого вимірювання визначається з рівняння дисперсії:
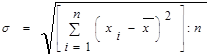 (2.4.3)
(2.4.3)
Інтервал значень, в який потрапляє вимірювана величина, називається довірливим інтервалом.
Вірогідність потрапляння нового результату у довірливий інтервал називається довірлива імовірність, надійність або коефіцієнт надійності і позначається літерою a.
Найчастіше користуються величиною надійності a=0,95, яка означає, що при великій кількості дослідів 95 результатів на кожні 100 будуть мати значення в межах ![]() ±2s.
±2s.
Приведені вище рівняння стандартного відхилення і дисперсії можна використовувати для характеристики випадкових похибок, знайдених при достатньо великій кількості дослідів (при n®¥).
Оцінку точності і правильності досліджень проводять за наступними критеріями:
середньоарифметичне значення ![]() , розраховується за (2.4.1);
, розраховується за (2.4.1);
одиничне відхилення або відключення окремих визначень від середньоарифметичного:
![]() (2.4.4)
(2.4.4)
Алгебраїчна сума одиничних відхилень дорівнює нулю:
![]() (2.4.5)
(2.4.5)
Дисперсія знайдених значень х1, х2,..., хn при n паралельних дослідів визначається:
![]() (2.4.6)
(2.4.6)
- стандартне відхилення або середньоквадратична похибка окремого вимірювання:
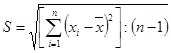 (2.4.7)
(2.4.7)
Відносна квадратична похибка, виражена у відсотках від середньоарифметичного значення, називається коефіцієнтом варіації і позначається літерою u:
![]() (2.4.8)
(2.4.8)
Дисперсія середнього результату при n паралельних дослідів складає n-ну частину початкової дисперсії:
![]() (2.4.9)
(2.4.9)
Стандартне відхилення середнього результату (середньоквадратична похибка середнього арифметичного результату) є позитивним значенням кореня квадратного з дисперсії середнього результату:
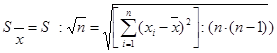 (2.4.10)
(2.4.10)
Для визначення значення n, при якому значення ![]() наближується до істинного значення а, вводиться нова величина, яку називають коефіцієнтом Ст’юдента і позначають символом ta:
наближується до істинного значення а, вводиться нова величина, яку називають коефіцієнтом Ст’юдента і позначають символом ta:
![]() (2.4.11)
(2.4.11)
Є таблиця коефіцієнтів, де даються значення ta залежно від коефіцієнта надійності a та числа ступенів свободи k (k = n-1, де n – число дослідів).
Точність результату аналізу при вибраному a визначається величиною відхилення середнього результату від істинного (очікуваного) і виражається рівнянням:
![]() (2.4.12)
(2.4.12)
Довірливий інтервал та довірлива вірогідність (надійність) при вибраному коефіцієнті надійності a описується рівняннями:
![]() (2.4.13)
(2.4.13)
![]() (2.4.14)
(2.4.14)
Із збільшенням кількості дослідів, точність результатів зростає. Коли відоме істинне значення, відносна похибка середнього результату (у %) з надійністю a знаходять як відношення:
(ea: а)100% (2.4.15)
Відносна похибка середнього результату (у %) може бути виражена і за середньоарифметичним значенням ![]() з цією ж надійністю a:
з цією ж надійністю a:
(ea:![]() )100% (2.4.16)
)100% (2.4.16)
Виявлення систематичних похибок проводять шляхом порівняння різниці між середнім значенням величини ![]() і її істинним значенням а з точністю метода ea. Якщо |
і її істинним значенням а з точністю метода ea. Якщо |![]() -а |>ea, то має місце систематична похибка.
-а |>ea, то має місце систематична похибка.
Розділ 3. Експериментальна частина
3.1 Культурально-біохімічні властивості штамів продуцентів
3.1.1 Штам E.coli M 17
Виробничий штам E.coli M17(О2: К1: Н6) відноситься до виду Escherichia coli, роду Escherichia, трибу Eschericiеaе, родини Enterobacteriaceae. Штам E.coli M17 являє собою рухомі грамнегативні короткі палички з закругленням на кінцях, довжиною від 1,5мкм до 4,0 мкм.
Штам E.coli M17- факультативний аероб, на МПА через (15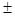
8-09-2015, 22:02
