Антиоксидантна активність сироватки крові у постраждалих у порівнянні з результатами, отриманими у донорів, була знижена в групі А на 47,4±3,4%(р<0,05), у групі В на 56,5±4,2%(р<0,05). У найбільш тяжких пацієнтів відзначалося зниження показника АОА на 66,9±7,5% (р<0,05) у порівнянні з контрольними показниками у донорів і на 24±4,9% (р<0,05) у порівнянні із групою В. Таким чином, відзначалося вірогідне (р<0,05) зниження антиоксидантної активності сироватки крові в міру наростання клінічної тяжкості стану постраждалих.
Аналіз результатів свідчить про збільшення прооксидантної активності сироватки крові залежно від тяжкості стану й ступеня ушкодження ГМ. Зростання рівня ТБКАП є ознакою, що підсилюється оксидантне ушкодження ГМ. Зміни показників антиоксидантної активності сироватки крові характеризують вичерпання адаптаційного резерву на тлі зростання концентрації вільних радикалів. Виявлено зниження активності СОД і загальної антиоксидантної активності сироватки крові, збільшення вмісту дісульфідних, зменшення тіолових груп а також зниження тіолдісульфідного коефіцієнта. Таким чином ступінь оксидантного стресу та буферна місткість сироватки крові прямо залежить від тяжкості пошкодження головного мозку.
Вихідний стан вегетативного статусу оцінювався на етапі операції, що безпосередньо передував виконанню шкірного розрізу. До цього моменту всі постраждалі, незалежно від тяжкості вихідного стану після індукції в наркоз, перебували в порівняних умовах протягом 5 хвилин перед початком шкірного розрізу покровів. Отримані дані демонструють достовірне поетапне зниження характеристик потужності активності симпатичного й парасимпатичного відділів вегететивної нервової системи (ВНС) (рис.1).

Рис.1. Вихідні показники варіабельності ритму серцевої діяльності у постраждалих.
Представлені дані демонструють істотні розходження вегетативної відповіді у постраждалих, що свідчить про участь автономної нервової системи в розвитку адаптаційних реакцій на передопераційному етапі. Порівняння значень логарифмів показників потужності осциляцій, зумовлених активністю симпатичного й парасимпатичного відділів ВНС, вірогідно підтверджує різний ступінь залучення її відділів у регуляцію серцевої діяльності. У групі А відзначалася виражена в 6 разів, у порівнянні с групою В, та в 2 рази, в порівнянні с групою С (р<0,05) відповідно перевага тонусу симпатичної нервової системи. У групі С активність парасимпатичної нервової системи була підвищена в 7,7 рази, у порівнянні с групою А, та в 1,8 рази, у порівнянні с групою В (р<0,05). При аналізі потужності високочастотних осциляцій відзначене стійке підвищення активності парасимпатичної нервової системи в міру поглиблення тяжкості стану постраждалих і ступеня ушкодження головного мозку.
Таким чином, у постраждалих із забоєм мозку у поєднанні із субарахноїдальним крововиливом зберігався вихідний баланс обох гілок вегетативної нервової системи. У пацієнтів із забоєм мозку у поєднанні із внутрішньочерепними гематомами збільшення потужності низькочастотних осциляцій (LF) є ознакою адекватної відповідної реакції СНС на стресорний вплив. Підвищення потужності високочастотних осциляцій (HF) у пацієнтів з найбільш важкими ушкодженнями (забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами) свідчить про неузгодженість керуючого впливу обох гілок ВНС на тлі залучення стовбурних структур.
Порівняння антистресорної ефективності різних методів анестезії в досліджених групах хворих з гострою черепно-мозковою травмою проводили поетапно згідно з методами дослідження, що застосовувалися.
У групі хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом всі досліджувані методи анестезії сприяли достовірному зниженню прооксидантної активності наприкінці операції. Достовірних розходжень вмісту ТБКАП на II етапі дослідження при різних методах анестезії не виявлено. Це свідчить про достатні антиоксидантні властивості всіх досліджуваних методів анестезії у хворих з невисоким ступенем ушкодження головного мозку.
У групах із забоєм мозку у поєднанні із внутрішньочерепними гематомами й забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами застосування пропофолу з фентанілом викликало недостовірне зниження прооксидантної активності, що дозволяє зробити висновок про недостатній захист від оксидантного стресу даного методу анестезії у хворих з тяжким ушкодженням ГМ. Виражене зниження рівня ТБКАП на прикінці операції досягалося у хворих груп В і С використанням тіопенталу натрію з фентанілом і поєднання оксибутирату натрію з тіопенталом натрію, кетаміном і морфіном. Достовірні розходження між показниками ТБКАП на II етапі дослідження дозволяють відзначити антистресорну ефективність II і III методів анестезії у хворих з тяжким оксидантним ушкодженням головного мозку.
Для оцінки антиоксидантної активності був досліджений вміст супероксиддісмутази, тіолових груп і антиоксидантна активність сироватки крові. Проведені дослідження показали, що у хворих групи А на тлі всіх трьох методів анестезії до кінця операції відзначалося достовірне збільшення активності супероксиддісмутази в сироватці крові. Достовірних розходжень активності СОД на II етапі дослідження при проведенні анестезії всіма трьома методами не виявлено, що дозволяє зробити висновок про ефективну активацію СОД, що забезпечується компонентами кожного методу анестезії у хворих з невисоким ступенем оксидантного ушкодження головного мозку. При використанні пропофолу у хворих груп В і С зміни активності ферменту до кінця операції були невірогідними. Таким чином, застосування пропофолу в групах В і С не забезпечувало активації СОД на тлі анестезії. Дані свідчать про вірогідну активацію СОД після операції в групі тяжких хворих при використанні тіопенталу натрію з фентанілом і оксибутирату натрію з тіопенталом натрію, кетаміном і морфіном як компонентів анестезії. Вірогідні розходження між показниками СОД на другому етапі дослідження демонструють ефективну активацію антиоксидантного фактора першого рівня (СОД) на тлі використання II і III методів анестезії, що є підставою для віддання переваги застосуванню цих методів у хворих із забоєм мозку у поєднанні із внутрішньочерепними гематомами й забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами. Низький рівень активності СОД сироватки крові хворих групи С до кінця операції дозволяє зробити висновок про вичерпання антиоксидантних резервів при тяжкому ушкодженні головного мозку.
Аналіз вмісту сульфгідрильних і дисульфідних груп у сироватці крові хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом не виявив вірогідної зміни їх концентрації наприкінці операції, а також вірогідних розходжень між використаними методами анестезії на II етапі дослідження. У групі IВ відзначалося вірогідне зниження SH на 15,8± 3,1% та підвищення SS на 22,03 ±3,8% (p<0,05), зниження тіолсульфідного коефіцієнта на 30,4±2,2% (p<0,05). У той час, як у підгрупах II B і III B відзначалося зниження SH на 10,4±3,2% (p<0,05) і 11,8±4,9% (p<0,05), SS підвищилося на 15,1±3,0% і 14,7±5,7% (p<0,05) відповідно. Тіолдисульфідний коефіцієнт при цьому знизився на 21,7±3,7% і 23,1±5,0% (p<0,05). Дані показники підтверджують ефективність використання тіопенталу натрію з фентанілом і сполучення оксибутирату натрію з тіопенталом натрію, кетаміном і морфіном як компонентів анестезії у хворих групи В і демонструють їхні антирадикальні властивості.
У групі тяжких хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами відзначався значно знижений вихідний (до 241,4±12,7 мкм/л) рівень SH і підвищений (до 333,8±21,4 мкм/л) рівень SS. На II етапі дослідження в підгрупі I С відзначалося вірогідне зниження SH на 20,1±6,3%(p<0,05), підвищення SS на 25,3±2,1% (p<0,05) і зниження тіолсульфідного коефіцієнта на 37,1±6,1% (p<0,05), тоді як у підгрупах II С і III С відзначалося зниження SH на 15,0±3,2% і 15,1±2,3% (p<0,05) відповідно, а SS підвищилося на 18,1±3,6% і 20,3±3,2% (p<0,05) відповідно. Тіолдисульфідний коефіцієнт при цьому знизився на 29,1±1,5% (p<0,05) і 29,7±3,5% (p<0,05). Використання тіопенталу натрію і оксибутирату натрію в комбінації з морфіном і кетаміном як компонентів анестезії у хворих групи С дозволило забезпечити більш надійний антирадикальний захист, ніж пропофол з фентанілом. Низький рівень SH і збільшення SS у хворих групи C є ознакою вираженого оксидантного стресу й зсуву тіолдисульфідної реакції убік окислювання на тлі операційної травми. Такі результати можна розцінити як вичерпання адаптаційного резерву організму. Аналіз антиокисної активності сироватки крові у хворих групи А виявив вірогідне підвищення цього показника після операції при відсутності вірогідних розходжень між методами анестезії на II етапі дослідження. У групі В спостерігалося вірогідне підвищення АОА при анестезії тіопенталом натрію і його поєднання з оксибутиратом натрію морфіном і кетаміном, у той час, як даний показник у хворих підгрупи I B змінювався невірогідно.
Вірогідного збільшення антиокисної активності в підгрупі I C не виявлено, в той час як у підгрупах II C і III C даний показник зростав незначно. Це свідчить про вичерпання адаптаційного резерву у хворих з важким ушкодженням ГМ. Вищевикладене дозволяє рекомендувати проведення антиоксидантного захисту у тяжких хворих тіопенталом натрію і фентанілом, а також оксибутиратом натрію з тіопенталом натрію, морфіном і кетаміном, як компонентів анестезії.
Аналіз результатів свідчить про збільшення прооксидантної активності сироватки крові залежно від тяжкості стану й ступеня ушкодження ГМ. Зміни показників антиоксидантної активності сироватки крові характеризують вичерпання адаптаційного резерву на тлі росту концентрації вільних радикалів. У групі хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом анестезія пропофолом забезпечує достатню стабілізацію про - і антиоксидантних систем організму, у той час як при тяжкому ушкодженні ГМ підтримка про - і антиоксидантної систем може здійснюватися на тлі тіопенталу натрію і фентанілу або тіопенталу натрію у поєднанні з оксибутиратом натрію, кетаміном і морфіном як компонентами анестезії.
У всіх обстежених пацієнтів індукція в анестезію викликала односпрямовані зміни стану ВНС, що виразилися прогресуючим пригніченням активності симпатичного й парасимпатичного відділів. Інгібіторний ефект різного ступеня виразності проявлявся до початку хірургічного втручання. Активність систем регуляції ритму серцевої діяльності була пригнічена у нерівному ступені: тонус симпатичної (адренергічної) системи регуляції ритму серцевої діяльності вірогідно (p<0,05) знижувався в середньому до 48±4%, тоді як активність парасимпатичної системи зменшувалася до 27±2% (p<0,05) (рис.2,3,4).
З моменту виконання шкірного розрізу відповідні реакції ВНС різнилися залежно від тяжкості стану й методу анестезії.
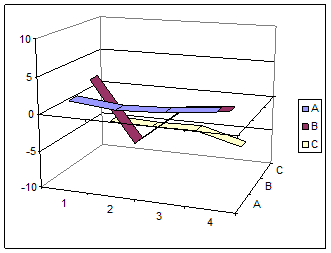
Рис.2. Зміна балансу активності симпатичної й парасимпатичної нервової системи на різних етапах операції при проведенні анестезії пропофолом і фентанілом.
Тут і далі на осі абсцис позначені етапи хірургічного втручання для груп А, В і С:
1 – виконання шкірного розрізу; 2 – виконання трепанації; 3 – розкриття ТМО; 4 – накладення швів на шкіру, по осі ординат відкладені значення десяткового логарифма відношення потужності осциляцій інтервалограми низькочастотного до високочастотного діапазону.
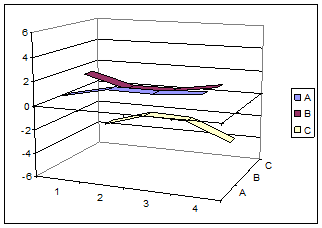
Рис.3. Зміна балансу активності симпатичної й парасимпатичної нервової системи на різних етапах операції при проведенні анестезії тіопенталом натрію і фентанілом.

Рис.4. Зміна балансу активності симпатичної й парасимпатичної нервової системи на різних етапах операції при проведенні анестезії тіопенталом натрію, оксибутиратом натрію, кетаміном і морфіном.
Проведення анестезії пропофолом і фентанілом у групі пацієнтів із забоєм мозку в поєднанні із субарахноїдальним крововиливом супроводжувалося збалансованим пригніченням реакцій з боку вегетативної нервової системи.
Уже на етапі виконання розрізу шкіри досягався ефект вірогідного пригнічення активності обох відділів ВНС. На наступних етапах операції на тлі підтримки анестезії зберігалася стабільна вегетативна рівновага. До етапу накладення шкірних швів виразність відповідної реакції у хворих вірогідно підсилювалася, що дозволило 92% пацієнтів підгрупи I А відновити рефлекси й спонтанне дихання. Це дозволило провести екстубацію на операційному столі після накладення пов'язки через 24±8 хв. Є очевидним, що проведення багатокомпонентної анестезії пропофолом і фентанілом у хворих із забоєм мозку в поєднанні із субарахноїдальним крововиливом поряд з адекватним анестезіологічним захистом забезпечує збереження вихідного вегетативного статусу й погодженої діяльності функціональних систем мозку, також раннє відновлення його активності після операції.
У хворих із забоєм мозку у поєднанні із внутрішньочерепними гематомами анестезія пропофолом, забезпечуючи мінімальний рівень пригноблення активності ВНС, підсилювала вихідний дисбаланс симпатичної й парасимпатичної складової. При використанні пропофолу з фентанілом як компонентів анестезії у групі хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами не вдалося досягти стійкого пригнічення вегетативних рефлексів (p>0,1). На всіх етапах відзначалася підвищена активність обох відділів вегетативної нервової системи. На етапі накладення швів на шкіру відзначене зниження потужності низько - і високочастотних осциляцій інтервалограми з посиленням дисбалансу тонусу симпатичної й парасимпатичної нервової системи. Очевидно, це обумовлено недостатньою ефективністю профолу як основного гіпнотика в групі тяжко постраждалих.
Анестезія із застосуванням тіопенталу натрію і фентанілу в групі пацієнтів із забоєм мозку у поєднанні із субарахноїдальним крововиливом викликала значне пригнічення активності ВНС, не порушуючи балансу низькочастотної й високочастотної складової інтервалограми. Більш тривале відновлення вітальних функцій вимагало тривалого післяопераційного спостереження й моніторингу.
Антиноцицептивний захист у хворих із забоєм мозку в поєднанні із внутрішньочерепними гематомами більш ефективно забезпечувався тіопенталом натрію. Застосування його як седативного компоненту анестезії викликало вірогідне зниження виразності вегетативних реакцій практично на всіх етапах оперативного втручання при схоронності балансу активності обох гілок ВНС. Найбільш виражене пригнічення балансу ВНС за рахунок зниження симпатичного компонента відзначено на етапі трепанації. У хворих групи С зберігалися вихідні низькі показники потужності частотних складових. У тяжких хворих, незважаючи на грубу вихідну неузгодженість механізмів центральної регуляції ритму серцевої діяльності, застосування тіопенталу натрію справляло на вегетативний баланс дію, що вирівнює, і сприяло позитивній зміні співвідношення активності LF/HF у бік рівноваги.
Комбіноване застосування оксибутирату натрію й тіопенталу натрію з кетаміном і морфіном у всіх групах хворих сприяло значному посиленню симпатичної активності (можливо обумовлене дією кетаміну), про що свідчить вірогідне (p<0,05) збільшення потужності низькочастотного компоненту на завершальних етапах операції.
Використання даного методу анестезії у хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом приводило до помірно вираженого дисбалансу ВНС, а також до необґрунтованого продовження медикаментозного сну й ШВЛ.
Таким чином, диференційований підхід до вибору методу анестезіологічного захисту визначається, насамперед, клінічним статусом і тяжкістю первинного травматичного ушкодження головного мозку. У хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом анестезію доцільно проводити за допомогою пропофолу і фентанілу. У цьому випадку забезпечується підтримка активності ВНС у ході операції на прийнятному безпечному рівні, створюються умови для забезпечення адекватного антиоксидантного захисту, раннього відновлення вегетативних рефлексів і вітальних функцій організму пацієнта. Більш рання активізація даної групи хворих у післяопераційному періоді сприяє поліпшенню віддалених прогнозів лікування.
Застосування тіопенталу натрію як основного седативного компонента анестезії дозволяє досягти глибокого пригнічення активності ВНС при збереженні балансу обох гілок. Крім того, тіопентал натрію відновлює антиоксидантні резерви організму, проявляючи свій нейропротекторний потенціал. Даний метод анестезії, очевидно, варто вважати найбільш ефективним у хворих із забоєм мозку у поєднанні із внутрішньочерепними гематомами.
Анестезіологічне втручання із застосуванням оксибутирату натрію, тіопенталу натрію, кетаміну і морфіну забезпечує потужний антиноцицептивний захист, що супроводжується придушенням різноспрямованої рефлекторної активності ВНС, зміщенням її у бік симпатичного відділу. Стимулюючий вплив симпатичного відділу ВНС на адренергічні структури стабілізує показники системної гемодинаміки, що покращує мозковий кровотік. Останнє, нарівні із забезпеченням умов для тривалої післяопераційної седації, дозволяє розглядати оксибутират натрію і тіопентал натрію у поєднанні з кетаміном і морфіном як головні компоненти анестезіологічного забезпечення хворих із забоєм мозку у поєднанні із субарахноїдальним крововиливом і внутрішньочерепними гематомами.
ВИСНОВКИ
В дисертації наведено узагальнення і нове вирішення актуальної наукової задачі - диференційованої анестезії у хворих із різною тяжкістю ГЧМТ на підставі вивчення маркерів перекисного окислювання ліпідів та вегетативного статусу та розробки оптимального методу анестезіологічного забезпечення залежно від ступеня ушкодження ГМ.
При надходженні до операційної у 88,7% постраждалих з ГЧМТ спостерігається порушення показників перікисного окислювання ліпідів. Підвищення прооксидантної активності сироватки крові, збільшення рівня ТБКАП є ознакою триваючого ушкодження ГМ; зменшення показників антиоксидантної активності сироватки крові першої ланки (СОД) та зміни показників другої ланки (тіолдісульфідноі системи) являються маркерами глибини оксидантного стресу. У 76,9% постраждалих має місце виснаження адаптаційного резерву на тлі збільшення концентрації вільних радикалів у залежності від тяжкості клінічного стану та ступеня травми ГМ. Маркери вегетативного статусу демонструють істотні розходження вегетативної відповіді у 97,9% постраждалих.
У постраждалих із забоєм головного мозку у поєднанні із субарахноїдальним крововиливом віявляється вірогідне зниження рівня ТБКАП в 1,6 рази, підвищення рівня активності СОД у 1,7±0,6 рази, антиокислювальної активності сироватки крові – на 60±8,7% та стабілізація маркерів вегетативної рівноваги на тлі анестезії пропофолом і фентанілом. Цей метод є оптимальним з урахуванням його антистресорної властивості.
У постраждалих із забоєм головного мозку і внутрішньочерепними гематомами спостерігаються вірогідне зниження ТБКАП у 1,7±0,8 рази, підвищення СОД – у 1,7±0,4 рази, антиокислювальної активності сироватки крові в1,5 на тлі анестезії тіопенталом натрію і фентанілом. Анестезія приводить до збалансованого вірогідного пригнічення показників симпатичної та парасимпатичної нервової системи у 3,7±0,2 рази з прогнозованим встановленням активності до завершення операції. Вказані дані свідчать про ефективність методу у цих хворих.
У постраждалих із забоєм головного мозку, субарахноїдальним крововиливом і внутрішньочерепними гематомами було виявлене вірогідне зниження рівня ТБКАП у 1,9±0,2 рази, вірогідне підвищення рівня активності СОД – у 1,4±0,6 рази, після проведення
8-09-2015, 22:25
