За нашими даними кількість мітозів у різних зразках пухлинної тканини значно коливалась. На матеріалі перших операцій середнє значення мітотичного індексу (МІ) становило (M±m 0,41±0,07%). Крива розподілу частот в залежності від значення МІ мала двохфазний характер, на основі чого всі досліджені зразки були розподілені на дві неоднорідні групи: з низькими та більш високими показниками мітотичної активності. У 11% випадків МБ мали дуже низькі показники мітозу, 50% – показували значення мітотичного індексу близькі до вказаного середнього, для решти 29% МБ – значення МІ коливались від 0,33% до 1,2%, з максимумом частоти при значенні МІ=0,78%, та суттєво не відрізнялись в різних вікових групах. У випадках продовженого росту на матеріалі повторних операцій МІ дещо зростав (M±m 0,58±0,06%), але різниця не була достовірна (р>0,05).
Експресія ядерного антигена Кі-67 спостерігалась в усіх досліджених зразках. Для того, щоб виявити можливі коливання індексу мічення (ІМ) Кі-67 було виділено кілька груп: до першої були включені пацієнти з тривалістю безрецидивного виживання (БРВ) більше 12 місяців, до другої випадки продовженого росту, третю групу складали метастази. Всі ці випадки співставлялись з матеріалом першої операції та досліджувались в динаміці. Значення ІМ Кі-67 в МБ у пацієнтів з БВ >12 місяців коливались від 14,7% до 34,2% (M±m 24,66±1,5%). У другій дослідній групі з випадками продовженого росту МБ, коли паралельно досліджували матеріал першої та другої операцій, значення ІМ Кі-67 на матеріалі перших операцій становили від 17,9% до 42,3% (M±m 29,54±2,32%). Значення ІМ Кі-67 при продовженому рості коливались від 19,1% до 41,6% (M±m 31,34±1,8%). Тобто різниця в проліферативній активності первинних та рецидивних пухлин суттєво не відрізнялась та її показники мали близькі значення в різних вікових групах.Але при співставленні динаміки змін ІМ Кі-67 в індивідуальних спостереженнях МБ були виявлені хвилеподібні коливання проліферативної активності, як в один, так і в інший бік. Цей факт може свідчити, по-перше, що біологічні особливості росту МБ носять нелінійний характер, а по-друге це може бути обумовлене впливом протипухлинного лікування.
Порівняльний аналіз первинних та метастатичних пухлин виявив достовірну відмінність та особливості розподілу Кі-67 позитивних клітин в метастатичних вогнищах. Індекс мічення Кі-67 в первинних пухлинах цієї групи становив М±m 35,9±3,04%, а на матеріалі метастазів – М±m 21,88±1,97% (р<0,05). Розподіл Кі-67 позитивних клітин в зразках метастатичної пухлини був нерівномірний, власне пухлинний вузол найчастіше виявлявся негативним, чи демонстрував слабку експресію цього антигену. Найбільша активність спостерігалась в зонах інвазії пухлини, де різко позитивні клітини утворювали ланцюжки та вогнищеві скупчення. Також високі показники ІМ Кі-67 реєструвались навколо судин, в периадвентиціальних пухлинних комплексах.
Апоптозні ядра виявлялись, як в “класичних” МБ, так і в інших структурних підтипах цих пухлин, але найбільш високі показники апоптозного індексу (АІ) спостерігались при десмопластичному варіанті. Розподілення апоптозних ядер в МБ було, як правило, нерівномірне, вони частіше зустрічались в густоклітинних ділянках пухлини, а також навколо некротичних вогнищ. При дослідженні АІ спостереження розподілялись на декілька груп, за аналогією з тими, які виділялись для аналізу проліферативної активності.
Значення АІ в МБ у пацієнтів з БВ>2 місяців коливалось від 0,1% до 0,9% (M±m 0,41±0,06%). У другій групі значення АІ на матеріалі перших операцій коливалось від 0,4% до 1,2% (M±m 0,67±0,07%), а при продовженому рості АІ знаходився у інтервалі від 0,4% до 3,8% (M±m 1,18±0,24, р=0,05). Деяке підвищення рівня апоптозу при продовженому рості МБ можливо пов’язане з впливом опромінення та його некротизуючою дією на пухлинну тканину, що непрямо могло сприяти появі більшої кількості клітин в стані апоптозу навколо зон променевої деструкції.
За результатами співставлення матеріалу перших операцій з тканиною метастазів, які видалялись під час першої операції разом з основним пухлинним вузлом, або метастазів видалених з головного чи спинного мозку під час повторної операції була виявлена достовірна різниця (р=0,04). Апоптозний індекс в первинних пухлинах становив 2,74±0,77%, а в тканині метастазів – 6,41±1,06%, тобто в метастатичних вогнищах різко підвищувалась апоптотична активність.
З отриманих нами даних, коли порівнювався рівень апоптозу в групах, відмінних за показниками безрецидивного виживання та проявами прогресуючого перебігу, були виявлені чіткі статистично-вірогідні відмінності у пацієнтів з високим ризиком метастатичного ураження (р=0,001). Той факт, що дані результати були встановлені на матеріалі первинних пухлин, ще до призначення курсу комбінованого лікування, підтверджує вагу цього показника у прогнозуванні перебігу МБ. Тобто АІ вищий або рівний 1,5% можна вважати фактором ризику метастазування цих пухлин.
Аналіз морфологічної структури МБ виявив, що ці пухлини не тільки відрізняються між собою тканинною архітектонікою, але й неоднорідні за клітинним складом. Нами були описані чисельні клітинні форми, які входять до складу МБ. За сукупністю цитоморфологічних ознак та на підставі їх систематизації та морфометричного обчислення, нами були виділені за клітинним складом три варіанти (типи) МБ.
Перший тип – відносно однорідного складу, серед якого переважають клітини невеликого розміру 8-15 мкм з дрібним ядром округлої форми та чіткими контурами та слабо розвиненою, або зовсім невираженою цитоплазмою. Ці клітини вирізняються за структурою хроматину, переважно дрібноглибчастою з окремими грубими хроматиновими зернами та поодинокими компактними ядерцями з нечіткими контурами. В меншій кількості зустрічаються клітини з ядрами видовженої форми та не дуже чіткою ядерною мембраною з помірною кількістю зернистого та глибчастого хроматину.
Другий тип утворюють декілька клітинних форм, які при цьому не дуже відрізняються між собою за розміром та формою. Переважають одноманітні клітини, 8-12 мкм, з невеликим ядром і структурним ядерцевим утворенням та дрібні клітини, 7-11 мкм, з округлим ядром, багатим на хроматин, та слаборозвиненою цитоплазмою, які нагадують середній лімфоцит. Поряд з ними виявляються клітини видовженої форми з нормохромними ядрами.
Третій тип характеризується наявністю різко поліморфних клітин, розміри яких коливаються від 9 до 32 мкм. Переважно це клітини неправильної вугловатої форми з округлим гіпо- або нормохромним ядром, в якому визначаються компактні мікроядерця (від одного до п’яти) та клітини з ядрами порушеної конфігурації, з ознаками анізохромії та грубопетлистим розподілом хроматину. Часто виявлялись клітини в стані прямого мітотичного поділу. Знайдені клітинні форми були більш-менш густо розсіяні між більш типовими елементами МБ.
Використання високоспецифічної та в достатній мірі об’єктивної методики сріблення кислих негістонових білків дозволило не лише виявити ядерцеутворюючі регіони, але і визначити ступінь їх активності, який безпосередньо був пов’язаний зі структурою та функціональним станом клітин, які досліджуються. Вміст аргірофільних білків, які асоційовані з ділянками ядерцевих організаторів, був значно вище в МБ, порівняно з клітинами інтактного зернистого шару мозочка, який досліджувався в якості контрольного зразка та тканинами у нормі (p<0,05), що пов’язано з суперекспресією цих білків в клітинах з високим рівнем проліферації.
Серед низькодиференційованих пухлинних клітин, які входять до складу першого цитологічного типу, порівняно з контролем різко зростала кількість високоактивних компактних ядерець (M±m 0,87±0,11%), та в меншій мірі нуклеолонемних (M±m 0,50±0,1%); при цьому кількість кільцеподібних ядерець суттєво не змінювалась (M±m 0,24±0,1%), а вміст неактивних мікроядерець знижувався (M±m 0,21±0,01).
Другий цитологічний тип відрізнявся як більш високою загальною проліферативною активністю, так і показниками вмісту окремих ядерцевих форм, а саме – характерним збільшенням вмісту не лише компактних (M±m 3,95±1,24%), але і кільцевидних ядерець (M±m 1,12±0,54%).
Найвищі показники вмісту активних ядерцевих форм показували клітини, що були віднесені до третього цитологічного типу. Загальна кількість ядерцевих утворень у цьому випадку збільшувалась до (M±m 5,09±0,69%), компактних та нуклеолонемних – до 2,04±0,1% та 1,94±0,45% відповідно.
Тобто, дослідження ядерцевих структур дало змогу додатково та більш достовірно верифікувати виділені нами цитологічні типи, а також, на основі існуючих кореляцій між показниками активних ядерцевих форм з проліферативною активністю клітини, виявити ще один критерій злоякісності для МБ. Опираючись на отримані результати ми встановили, що наявність третього цитологічного типу є несприятливим прогностичним фактором, який необхідно враховувати при аналізі перебігу МБ.
В одноваріантному аналізі були досліджені клінічні та гістобіологічні чинники, які впливають на виживання (табл. 1).
Таблиця 1
Вплив клінічних та морфологічних чинників на тривалість трирічного безрецидивного виживання (3-БРВ)
| Чинник | (3-БРВ), % | р | |
Вік: (0-17 років) (18-48 років) |
47 37 |
0,2 | |
Стать: чоловіча жіноча |
38 53 |
0,4 | |
Первинна локалізація пухлини: черв’як гемисфера |
35 66 |
0,9 | |
Стадія (Т), за Chang: Т2-Т3а Т3b-T4 |
40 23 |
0,04 | |
Стадія (М), за Chang: М0 М1 М2-М4 |
58 18 12 |
0,04 |
|
Об’єм оперативного втручання: тотальне – майже тотальне видалення субтотальне – часткове видалення |
57 12 |
0,01 |
|
Гістопатоло-гічний тип |
МБ: “класичної” будови десмопластичні |
46 35 |
0,049 |
МБ: недиференційовані з ознаками клітинного (гліального, епендимарного) диференціювання |
46 30 |
0,06 | |
| Експресія Кі-67 | Не впливає | – | |
Апоптозний індекс: ≤1,5% >1,5% |
68 12 |
0,0001 | |
Цитоморфологічний тип: І, ІІ ІІІ |
49 21 |
0,03 | |
Терміни безрецидивного виживання у групі досліджень розподілялись наступним чином (рис.1).
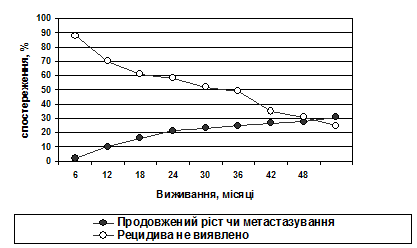
Рис. 1. Терміни безрецидивного виживання (вся група)
Таким чином, на трирічне безрецидивне виживання впливають наступні фактори: топографо-анатомічні особливості росту (інфільтрація дна IV шлуночка, вростання у стовбурові відділи головного мозку), наявність мікро- та макрометастазів на момент першої операції, об’єм оперативного видалення пухлини, гістологічний варіант будови, значення апоптозного індексу, виявлення певного цитоморфологічного типу.
ВИСНОВКИ
В роботі вирішена актуальна медична задача – визначені морфологічні особливості медулобластом мозочка та на підставі проведеного клініко-морфологічного співставлення виявлені незалежні прогностичні чинники перебігу цих пухлин, які впливають на показники трирічного безрецидивного виживання.
1. До несприятливих прогностичних чинників перебігу медулобластом мозочка відносяться інфільтрація дна IV шлуночка (Т3b-Т4 стадії за класифікацією Chang), наявність мікро- та макрометастазів на момент першої операції, а також субтотальний або частковий об’єм хірургічного видалення пухлини.
2. Специфічними морфологічними проявами пухлинної прогресії у випадках продовженого росту і метастазування медулобластом є трансформація типової гістоархітектоніки з переважанням дрібноклітинного малодиференційованого типу будови.
3. Лікувальний патоморфоз після проведеної променевої терапії характеризується сполучнотканинною активацією у оболонах мозку, дегенеративними змінами стінок судин з проявами порушення мікроциркуляції, вогнищами некрозів, появою багатоядерних клітин.
4. Диференціальна діагностика між гістологічними варіантами медулобластом має прогностичне значення у дітей віком після 3 років, у яких встановлена вірогідна різниця між показниками трирічного безрецидивного виживання при десмопластичній медулобластомі (35%) і медулобластомі “класичного” типу (46%).
5. Морфологічний прогноз росту медулобластом пов’язаний зі співвідношенням між показниками проліферативної активності та смерті клітин; особливо важливе значення мають показники апоптозного індексу. При всіх гістологічних варіантах медулобластом вони корелюють із можливістю метастазування цих пухлин: рівень апоптозного індексу більший 1,5% слід вважати несприятливим чинником, який співпадає з їх прогредієнтним перебігом.
6. Особливості клітинного складу медулобластом дозволяють виділити три цитоморфологічних типи цих пухлин (І, ІІ, ІІІ). Найбільш прогностично несприятливим є третій цитоморфологічний тип, який відрізняється наявністю різко поліморфних клітин, розміри котрих коливаються від 9 до 32 мкм. Відображенням проліферативної активності клітин медулобластоми є показники морфофункціональних типів ядерець, відсотковий вміст котрих коливається від 1,82±0,34% до 5,09±0,69% і який разом з особливостями їх розподілу вірогідно характеризує певні цитологічні типи цих пухлин.
7. Доцільно проводити прогностичний розподіл пацієнтів з медулобластомами за морфологічними ознаками на дві групи ризику: група стандартного ризику – Т1-Т3а, М0 стадії за класифікацією Chang, повне або майже повне видалення пухлини, апоптозний індекс нижчий або рівний 1,5 %, І або ІІ цитоморфологічний тип; група високого ризику – Т3b-Т4 стадії за класифікацією Chang, наявність мікро- та макрометастазів на момент першої операції, субтотальний або частковий об’єм хірургічного видалення, апоптозний індекс більший за 1,5%, наявність ІІІ цитоморфологічного типу будови.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
Пропонуються діагностичні підходи до визначення морфологічних особливостей медулобластом мозочка для використання в практичній роботі спеціалізованих нейохірургічних закладів.
Операційний матеріал, отриманий від пацієнтів з медулобластомами мозочка необхідно досліджувати не лише стандартними гістологічними методиками, але і з використанням цитогенетичних методів визначення ядерцевих організаторів із морфометричним аналізом.
На підставі проведених морфологічних досліджень доцільно проводити прогностичний розподіл пацієнтів з медулобластомами за клініко-морфологічними ознаками на групи високого та стандартного ризику.
Пацієнтам, які за визначеними критеріями відносяться до високої групи ризику, має бути індивідуалізована лікувальна тактика для попередження можливої прогресії медулобластоми (продовженого росту, метастазування).
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Черненко О.Г. Особливості продовженого росту та метастазування медулобластом мозочка // Укр. нейрохірург. журнал. – 2007. – №2 (38). – С. 29-36.
2. Черненко О.Г. Цитоморфологічна характеристика медулобластом мозочка // Патологоанатомічна діагностика хвороб людини: здобутки, проблеми, перспективи: Матеріали Всеукр. наук.-практ. конф., присвяченої 100-річчю з дня народження професора Н.М. Шінкермана (Чернівці, 21-22 травня 2007 р.). Буковинський медичний університет, 2007. – C. 178-181.
3. Семенова В.М., Черненко О.Г. Прогностические факторы продолженного роста медуллобластом мозжечка и особенности их патоморфоза после лучевой терапии // Вестник неотложной и восстановительной медицины. – 2007. – Т. 8, №3. – С. 347-352. (Дисертантом особисто було проведено розподіл тематичних випадків за відповідними критеріями у декілька груп та досліджено показники проліферативної активності і рівень апоптозу в первинних пухлинах порівняно з випадками продовженого росту і метастазування).
4. Орлов Ю.А., Лисяний А.Н., Шаверский А.В., Малышева Т.А., Черненко О.Г., Примушко Л.И. Экспрессия Fas-рецептора на клетках медуллобластомы // Укр. нейрохірург. журн. – 2005. – №4. – С. 35-39. (Дисертантом проведено морфологічне дослідження медулобластом мозочка з напівкількісною оцінкою отриманих результатів з використанням особисто запропонованої шкали критеріїв. Виконано підрахунок показників мітотичної активності в клітинах медулобластоми та встановлені характерні закономірності).
5. Черненко О.Г. Цитологическая диагностика медуллобластом // Матеріали ХІ з’їзду онкологів України (Судак, АР Крим 29 травня-02 червня). – К., 2006. – С. 64.
6. Черненко О.Г. Структурные особенности медуллобластом мозжечка при прогрессирующем росте и метастазировании // Молекулярні основи і клінічні проблеми резистентності до лікарських засобів: Матеріали Всеукр. наук.-практ. конф. з міжнар. участю (2-3 листопада 2006 р.). – К., 2006. – Oncology Special issue. – C. 62.
7. Черненко О.Г. Малишева Т.А. Значення цитологічної діагностики в комплексі морфологічного дослідження при нейроонкології // Нові технології в нейрохірургії: Матеріали конф. нейрохірургів (Ужгород, 2006). – Укр. нейрохірург. журн. – 2006. – №1. – С. 37. (Дисертантом власноручно виконанні методики цитологічного ти цитогенетичного фарбування та аналіз отриманих результатів цитологічного фенотипування пухлин головного мозку).
8. Орлов Ю.А., Шмелева А.А., Черненко О.Г. Особенности анаплазии опухолей головного мозга у детей // Матеріали III з’їзду нейрохірургів України (Алушта, Крим 23-25 вересня 2003 р.). – К., 2003. – С. 24. (Особисто дисертантом проаналізовані результати дослідження біоптичного матеріалу пухлин у пацієнтів дитячого віку за період з 1985 по 2003 рр., виконано розподіл цих випадків за основним типом ураження, аналіз результатів і статистичну обробку та написання доповіді за консультаційної допомоги співавторів).
АНОТАЦІЯ
Черненко О.Г. Морфологічні особливості медулобластом мозочка. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.03.02 – патологічна анатомія. – Національний медичний університет імені О.О. Богомольця, МОЗ України, Київ, 2008.
Дисертація присвячена визначенню морфологічних особливостей медулобластом мозочка, які впливають на перебіг захворювання. Встановлено, що інфільтрація дна ІV шлуночка з вростанням у стовбурові відділи головного мозку і поширення пухлини у суміжні анатомічні ділянки є прогностично несприятливим чинником. Виявлена вірогідна різниця між показниками трирічного виживання при десмопластичній медулобластомі і медулобластомі “класичного” типу (35% і 65 % відповідно) у дітей віком після 3 років. На основі порівняння гістологічних та цитологічних показників, морфофункціонального стану ядерець конкретизовані три цитоморфологічних типи медулобластом мозочка. Встановлено, що пухлини третього типу рецидивують частіше, порівняно з медулобластомами першого і другого цитоморфологічних типів. Доведено, що при значеннях апоптозного індексу більших 1,5% зростає ризик метастатичного ураження, незалежно від гістологічного варіанту медулобластоми. На основі встановлених прогностично-вагомих клініко-морфологічних критеріїв розроблено алгоритм розподілу пацієнтів з медулобластомами на групи ризику.
Ключові слова: медулобластома, морфологічні особливості, цитоморфологічний тип, ядерця, групи ризику.
АННОТАЦИЯ
Черненко О.Г. Морфологические особенности медуллобластом мозжечка. – Рукопись.
Диссертация на соискание ученой степени кандидата медицинских наук по специальности 14.03.02 – патологическая анатомия. – Национальный медицинский университет имени А.А. Богомольца, МЗ Украины, Киев, 2008.
Диссертация посвящена определению морфологических особенностей медуллобластом мозжечка, которые влияют на течение заболевания. В результате изучения топографо-анатомических характеристик роста этих опухолей было выявлено, что медуллобластомы характеризуются инвазивным распространением. Установлено, что инфильтрация дна ІV желудочка с врастанием в стволовые отделы головного мозга и распространение опухоли в смежные анатомические области являются прогностически неблагоприятным фактором. Распределение медуллобластом по структурным подтипам отличалось в разных возрастных группах, тенденция к клеточной дифференцировке была более выразительной в младшем возрасте. Выявлена достоверная разница между показателями трехлетнего безрецидивного выживания при десмопластической медуллобластоме и медуллобластоме “классического” типа (35% и 65% соответственно) у детей старше 3-х лет. На момент первичной диагностики диссеминация процесса с формированием имплантационных метастазов подтверждалась в 22,1% всех наблюдений (у 23,7% пациентов младше 18 лет, и 18% взрослых). В разные сроки после первой операции в 30,1% всех случаев выявлялись признаки продолженного роста медуллобластомы и/или метастатическое поражение. Специфические морфологические проявления опухолевой прогрессии в случаях продолженного роста и метастазирования медуллобластом – трансформация типичной гистоархитектоники с преобладанием мелкоклеточного малодифференцированного типа строения. Лечебный патоморфоз после проведенной лучевой терапии характеризовался соединительно-тканной активацией в оболочках мозга, дегенеративными изменениями стенок
8-09-2015, 22:26
